Это означает, что объем, занимаемый газом, обратно пропорционален его давлению. Однако существует константа, которая определяет, насколько обратно пропорционально это соотношение.
Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
Уравнения Клапейрона и Менделеева-Клапейрона; законы Шарля, Гей-Люссака, Бойля-Мариотта, Авогадро и Дальтона — такого количества «номинальных» законов нет, пожалуй, ни в одной другой области физики. За каждым из них стоит кропотливая работа в лабораториях, тщательные измерения, долгие аналитические размышления и точные расчеты. для нас все гораздо проще. Мы уже знаем основы теории, и нам легко «открыть» все упомянутые выше законы.
Давление газа полностью определяется температурой и концентрацией его молекул: p=nkT. Запишем это уравнение в виде: pV = NkT. Если известны состав и масса газа, то число молекул газа можно определить следующим образом.
Произведение числа Авогадро k равно 8,31 Дж/(моль⋅K). Подставьте уравнение Менделеева-Клапейрона в уравнение (*)).
Примечание. Состояние данного газа с данной массой однозначно определяется двумя его макроскопическими параметрами; третий параметр может быть определен из уравнения Менделеева-Клапейрона.
Уравнение Клапейрона
Уравнение Менделеева-Клапейрона можно использовать для определения взаимосвязи между макроскопическими параметрами газа при его переходе из одного состояния в другое. Рассмотрим газ с массой m и молярной массой M из состояния ( ) (рисунок 30.1).
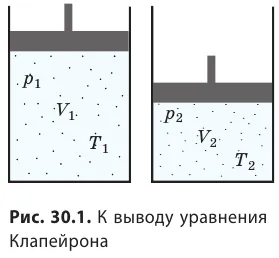
Для каждого состояния напишем уравнение Менделеева-Клапейрона:, а второй — в уравнении Клапейрона:
Для данного газа с данной массой отношение произведения давления и объема к температуре газа постоянно.
Изопроцессы
Процесс, при котором один из макроскопических параметров газа с заданной массой остается постоянным, называется равновесным процессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, существуют также три возможных изопроцесса: при постоянной температуре, при постоянном давлении и при постоянном объеме. Давайте рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
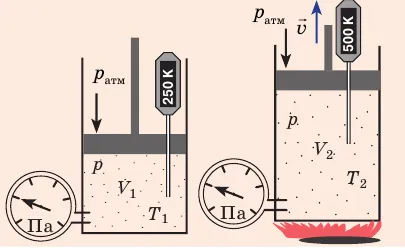
Пузырек воздуха, поднимающийся со дна глубокого водоема, может увеличить свой объем во много раз, в то время как давление внутри пузырька уменьшается из-за дополнительного гидростатического давления воды (
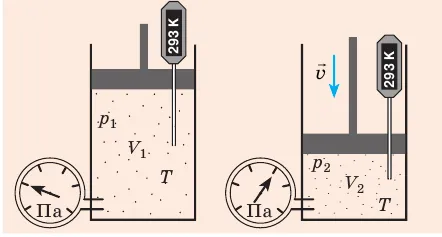
Рисунок 30.2: Изотермическое сжатие газа. Когда поршень медленно опускается, температура газа под поршнем остается постоянной и равной температуре окружающей среды. Давление газа увеличится
Изотермический процесс — это процесс, в котором состояние определенного газа с определенной массой изменяется при постоянной температуре.
Пусть газ переходит из состояния (. После сокращения на T получаем:
Закон Бойля-Мариотта:
Для данного газа с данной массой произведение давления газа и его объема остается постоянным, если температура газа не меняется:
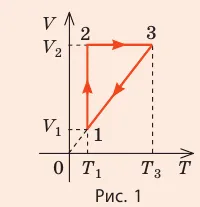
Графики изотермических процессов называются изотермами. Как видно из закона Бойля-Мариотта, давление газа с данной массой обратно пропорционально его объему при постоянной температуре:
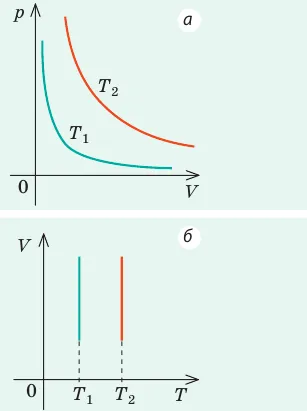

Что такое закон Бойля
Закон Бойля, также известный во Франции как закон Бойля-Мариотта, является экспериментальным законом для газов, который объясняет, как давление газа зависит от его объема.
Он показывает нам, как давление газа имеет тенденцию увеличиваться по мере уменьшения объема контейнера.
В современных научных терминах это можно сформулировать следующим образом:
Абсолютное давление, оказываемое данной массой идеального газа, обратно пропорционально объему, в котором он находится, если количество газа и температура в замкнутой системе остаются постоянными.
Здесь нам необходимо понять, что такое определение идеального газа, что подразумевается под термином «закрытая система» и связь слова «температура».
Теоретический газ, состоящий из ряда произвольно движущихся точечных частиц, единственным взаимодействием которых являются абсолютно упругие столкновения, называется идеальным газом.
Теория идеального газа полезна, поскольку он подчиняется закону идеального газа, упрощенному определяющему уравнению, и может быть модифицирован для анализа в рамках статистической механики.
Когда был выведен закон Бойля
Однако эта взаимосвязь между давлением и объемом была впервые зафиксирована Ричардом Таунли и Генри Пауэром в 17 веке.
Роберт Бойль провел множество экспериментов, собрал и проанализировал их данные и опубликовал результаты.
Роберт Хук, ассистент Бойля, построил экспериментальный аппарат, как считали Роберт Гудер и другие уважаемые эксперты.
Этот закон был основан на экспериментах с воздухом, который Бойль рассматривал как жидкость, состоящую из мелких частиц, покоящихся между маленькими невидимыми пружинами.
В то время было принято считать, что воздух является одним из четырех элементов, но Бойль не соглашался с этим мнением.
Бойл твердо верил, что воздух является важным элементом жизни, и опубликовал работу о росте растений без воздуха.
С помощью какого опыта был выведен закон
Бойль использовал закрытую J-образную трубку, в которую с одной стороны заливал ртуть, заставляя воздух с другой стороны сжиматься под давлением ртути.
Он повторил этот эксперимент несколько раз с различными количествами ртути и обнаружил, что в контролируемых условиях давление газа обратно пропорционально его объему.
Эдж Марриотт (1620-1684), французский физик, открыл тот же закон независимо от Бойля в 1679 году, но Бойль уже опубликовал его в 1662 году.
Однако Марриотт обнаружил еще один факт, а именно, что объем воздуха меняется в зависимости от температуры.
По этой причине данный закон также называют законом Мариотта или законом Бойля-Мариотта.
Ньютон опубликовал его в 1687 году в своей книге «Математические начала натуральной философии», в которой он математически показал и доказал, что в упругой жидкости, состоящей из покоящихся частиц, между которыми действуют отталкивающие силы, обратно пропорциональные их расстоянию, плотность прямо пропорциональна давлению.
Но этот математический трактат не является физическим объяснением наблюдаемой взаимосвязи.
Вместо статической теории нужна была кинетическая теория, которая была предложена двумя столетиями позже Максвеллом и Больцманом, когда они представили доказательные теории.
Первый физический закон в виде уравнения
Закон Бойля был первым физическим законом, выраженным в форме уравнения, описывающего зависимость двух переменных.
Математически закон Бойля можно выразить следующим образом.
т.е. что давление обратно пропорционально объему.
P x V = k, т.е. если мы умножим давление на объем, то получим константу
где P — давление газа, V — объем газа и k — константа.
Уравнение гласит, что при постоянной температуре произведение давления и объема постоянно для данной массы закрытого газа, и это верно.
Теперь, чтобы сравнить одно и то же вещество при двух различных условиях, закон можно выразить следующим образом
Выражение показывает, что с увеличением объема давление газа пропорционально уменьшается. Аналогично, при уменьшении объема давление газа увеличивается. Роберт Бойл опубликовал оригинальный закон в 1662 году, и именно так закон получил свое название.
Это выражение означает, что при постоянной температуре одинаковое количество энергии, выделяемой системой, сохраняется на протяжении всего времени ее работы, так что значение k остается теоретически постоянным.
Применение закона Бойля
Этот принцип используется и применяется в нашей повседневной жизни, включая приготовление пищи в скороварке. В продуктах написано, что рис варится, когда вода закипает.
Все мы живем на планете Земля в условиях атмосферного давления, которое измеряется как вес 13-миллиметрового столба ртути.
Вода, используемая для приготовления риса, закипает при атмосферном давлении только при температуре 100 градусов Цельсия.
Следуя этому принципу, вода в тяжелой, толстой металлической скороварке закипает при более высокой температуре, увеличивая вес или вызывая быстрый рост давления в посуде.
В результате вода быстро достигает температуры кипения более 100 градусов Цельсия, а рис готовится за гораздо более короткое время, чем в открытой кастрюле.
Когда мы закрываем крышку плиты, создается замкнутая система давления, поскольку мы закрываем кастрюлю. Вернемся к закону идеального газа и уравнению
PV = nRT,
где P = давление, V = объем и T = температура (для полноты картины n = число молекул и R = газовая постоянная).
Но в данном случае они не меняются, поэтому мы можем их игнорировать, а объем металлического контейнера действительно не меняется, поэтому мы игнорируем и его). Итак, это уравнение для закрытой системы, а это состояние находится в скороварке.
Итак, в основном мы имеем следующее уравнение
Если вы увеличиваете давление, температура повышается, и наоборот.
Почему вода в закрытой кастрюле закипает быстрее
В открытом или неплотно закрытом сосуде вода закипает при 100°C (212°F) под действием атмосферного давления.
Пар, испаряющийся из этого сосуда, также имеет температуру 100ºC (212ºF). Независимо от нагрева воды, она остается при температуре 100 ºC (212 ºF).
Когда на кастрюлю надевают крышку, чтобы плотно закрыть ее и задержать пар в кастрюле, давление в кастрюле повышается.
По мере увеличения давления увеличивается количество пара в сосуде под давлением, и температура воды поднимается выше нормальной точки кипения 100 ºC (212 ºF).
Пример работы мультиварки по закону Бойля
Когда вы начинаете нагревать плиту, внутреннее давление повышается, а с повышением давления повышается и внутренняя температура.
Оно продолжает расти, пока не достигнет давления запуска предохранительного клапана, которое примерно в два раза превышает давление на уровне моря.
В целом, для большинства химических реакций каждые 10 °C повышения температуры удваивают скорость реакции, поэтому время кипения можно сократить вдвое.
Увеличьте давление на ~15 psi, вы можете готовить пищу при ~250°F (121°C) и сократите время приготовления до четверти от обычного времени.
Однако необходимо также учитывать время, необходимое для достижения давления, и время, необходимое для повторного разогрева, так что в итоге получается примерно треть от первоначального времени, что все равно является огромным сокращением.
По этой причине скороварки готовят очень быстро.
Похожие страницы:
Парциальное давление газа При определении молекулярного веса газообразных веществ часто измеряют объем газа, собравшегося над водой.