Температура плавления железа довольно высока. Для получения технически чистого элемента требуется температура +1539 °C. Это вещество содержит примесь, а именно серу, и может быть извлечено только в жидком виде.
Железо: химические свойства и температура плавления
Во время сварки детали подвергаются воздействию высоких температур, поэтому важно учитывать температуру плавления металла, так как она играет важную роль в величине тока. В факеле тепловая энергия выделяется за счет сгорания газа в момент дуги, который разрушает кристаллическую решетку металла. Свойства плавления металлов учитываются при выборе материалов для изготовления деталей, склонных к истиранию, или металлических конструкций, подвергающихся воздействию температур.
Чтобы определить, при какой температуре плавится металл, в лаборатории с точностью до сотых долей градуса рассчитывается точка отсчета в начале процесса плавления. Это значение не зависит от силы, приложенной к заготовке.
Когда в условиях вакуума создается определенное давление, металлические детали имеют одинаковую температуру плавления. Это явление можно объяснить накоплением энергии в материале, которая разрушает связи между молекулами.
Нержавеющая сталь
Нержавеющая сталь — это один из многих сплавов железа, встречающихся в стали. Она содержит 15-30% хрома, который делает ее устойчивой к ржавчине, образуя на поверхности защитный оксидный слой, и углерод. Самые популярные виды стали поставляются из-за рубежа. Это серии 300 и 400, которые характеризуются прочностью, устойчивостью к неблагоприятным условиям и ковкостью. Серия 200 менее качественная, но более дешевая. Это выгодный фактор для производителя. Его состав был впервые замечен в 1913 году Гарри Бреарли, который провел множество различных экспериментов со сталью.
В настоящее время нержавеющая сталь подразделяется на три группы:
Читайте также: Можно ли закалить бронзу, как закалить бронзу и сделать ее тверже?
- Жаропрочная — при высоких температурах имеет высокую механическую прочность и устойчивость. Детали, которые из неё изготавливаются применяют в сферах фармацевтики, ракетной отрасли, текстильной промышленности.
- Ржаво-стойкая — имеет большую стойкость к процессам ржавления. Её используют в бытовых и медицинских приборах, а также в машиностроении для изготовления деталей.
- Жаростойкая — является устойчивой при коррозии в высоких температурах, подходит для использования на химических заводах.
Температура плавления нержавеющей стали составляет примерно от 1300 °C до 1400 °C, в зависимости от качества и количества сплавов.
Разница между температурой плавления и кипения
Температура плавления металла — это точка перехода из твердого состояния в жидкое. В расплавленном состоянии молекулы не имеют собственного положения; они удерживаются вместе под действием силы тяжести, поэтому в жидком состоянии объем сохраняется, но форма теряется.
Во время кипения теряется молекулярный объем, и молекулы медленно взаимодействуют друг с другом, хаотично двигаясь в разных направлениях и оставаясь за поверхностью. Кипение — это процесс приведения уровня давления пара металла в равновесие с давлением внешней среды.

Процесс плавления
Когда компонент подвергается термическому воздействию, его внутренняя структура изменяется из-за накопления энергии в молекулах. Скорость их движения увеличивается. В критической точке нагрева кристаллическая структура начинает разрушаться, и межмолекулярные связи больше не могут удерживать молекулы в узлах решетки. Колебательное движение внутри узла сменяется хаотичным движением, и в точке нагрева образуется бассейн расплава. Точка начала плавления определяется в лабораторных условиях с точностью до сотых долей градуса и не зависит от внешнего давления на заготовку. В вакууме и под давлением металлические детали начинают плавиться при одной и той же температуре; это связано с увеличением внутренней энергии, необходимой для разрушения межмолекулярных связей.
В физике переход из твердого состояния в жидкое характерен только для веществ с кристаллической структурой. Температура плавления металлов обычно задается серией значений; в случае сплавов трудно точно определить нагрев до предельного состояния. Для чистых элементов каждый градус имеет значение, особенно для легкоплавких элементов,
это не имеет значения. Сводная таблица t-значений обычно делится на 3 группы. Помимо огнеупорных элементов, максимальная температура которых составляет +600 °C, существуют огнеупорные элементы, выдерживающие температуру свыше +1600 °C, а также элементы средней плотности. В эту группу входят сплавы, которые образуют расплавленный бассейн при температуре от +600°C до 1600°C.
Читайте также: Методика ультразвукового контроля сварных соединений
Разница между температурой плавления и кипения
Точка фазового перехода вещества из твердого кристаллического в жидкое состояние часто называется температурой плавления металла. В расплаве молекулы не имеют определенного расположения, но удерживаются вместе за счет притяжения; в жидком состоянии кристаллическое тело сохраняет свой объем, но теряет форму.
При кипении теряется объем, молекулы слабо взаимодействуют, хаотично движутся во всех направлениях и отскакивают от поверхности. Температура кипения достигается, когда давление пара металла достигает давления внешней среды.
Для наглядности лучше показать разницу между критическими точками нагрева в таблице:
| Свойства | Температура плавления | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав превращается в расплав, кристаллическая структура разрушается, зернистая структура исчезает | Переход в газообразное состояние, отдельные молекулы парят над расплавом |
| Фазовый переход | Равновесие между жидкой и твердой фазой | Равновесие между давлением пара металла и давлением внешнего воздуха |
| Влияние внешнего давления | Не менять | Изменения, уменьшения при перепаде давления |
Таблицы температур плавления металлов и сплавов
Для простоты предельные значения для фазового перехода из твердого состояния в жидкое приведены в группах в порядке увеличения t фазового перехода. Из всех этих элементов были выбраны наиболее распространенные.
Таблица точек плавления расплавленных металлов и сплавов (температура плавления до +600°C).
| Название элемента или соединения | Алфавитный символ в периодической таблице элементов | Температура плавления | Температура кипения |
|---|---|---|---|
| Ртуть | Hg | -38,9°С | +356,7°С |
| Литий | Li | +18°С | +1342°С |
| Цезий | Cs | +28,4°С | +667,5°С |
| Калий | K | +63,6°С | +759°С |
| Натрий | Na | +97,8°С | +883°С |
| Индий | In | +156,6°С | +2072°С |
| Тинктадиен | Sn | +232°С | +2600°С |
| Висмут | Bi | +271,4°С | +1564°С |
| Таллий | Tl | +304°С | +1473°С |
| Кадмий | Cd | +321°С | +767°С |
| Вести | Pb | +327°С | +1750°С |
| Цинк | Zn | +420°С | +907°С |
Таблица температур плавления металлов и промежуточных сплавов, диапазон фазовых переходов от +600 до 1600 °C.
| Имя | Название металла или химический состав сплава | Температура плавления | Температура кипения |
|---|---|---|---|
| МЕТАЛЛЫ | |||
| Сурьма | Sb | +630,6°С | +1587°С |
| Магний | Mg | +650°С | +1100°С |
| Алюминий | Al | +660°С | +2519°С |
| Барий | Ba | +727°С | +1897°С |
| Кальций | Ca | +842°С | +1484°С |
| Серебро | Ag | +960°С | +2180°С |
| Золото | Au | +1063°С | +2660°С |
| Марганец | Mn | +1246°С | +2061°С |
| Медь | Cu | +1083°С | +2580°С |
| Бериллий | Be | +1287°С | +2471°С |
| Кремний | Si | +1415°С | +2350°С |
| Никель | Ni | +1455°С | +2913°С |
| Кобальт | Co | +1495°С | +2927°С |
| Железо | Fe | +1539°С | +900°С |
| САЛЮМ | |||
| Дюрали | Al+ Mg+Cu+Mn | +650°С | |
| Латунь | Медно-цинковые сплавы | +950…1050°С | |
| Никелевое серебро | Cu+Zn+Ni | +1100°С | |
| Чугун | Углеродистое железо | +1100…1300°С | |
| Углеродистые стали | +1300…1500°С | ||
| Нихром | Fe+Ni+Cr+Si+Mn+Al | +1400°С | |
| Инвар | Fe+Ni | +1425°С | |
| Фехраль | Fe+Cr+Al+Mn+Si | +1460°С | |
Таблица температур плавления тугоплавких металлов и сплавов (выше +1600°C).
Температура плавления: от чего зависит, как характеризуется и другое
Температура плавления — это состояние, при котором твердое кристаллическое тело приобретает свойства жидкости. Это граница между жидкостью и твердым телом. Обозначение температуры плавления — t. При дальнейшем нагревании системы вещество превращается в жидкость, а при охлаждении — в твердое тело.
- чистоты вещества (примеси придают системе большую и меньшую устойчивость);
- химического строения, состава (некоторые сплавы переходят в жидкое состояние при температуре выше 200°С, а другие при 2500°С).
Как определить температуру плавления?
Существует несколько методов экспериментального определения температуры плавления.
- Капиллярный способ Измельченное твердое вещество необходимо поместить в капилляр с открытым концом. Капилляр нагревают в таких условиях, чтобы тонкое стекло не лопнуло. Когда все вещество переходит в жидкую фазу, температуру фиксируют.
- Открытый капиллярный метод Этот способ схож с предыдущим, но вместо закрытого капилляра используют открытый.
- Мгновенное плавление На металлический блок, нагретый до температуры на 10°С ниже справочной температуры плавления, кладут измельченные порции сухого вещества. Регулируют нагревание так, чтобы градус повышался на 1°С в минуту. Затем записывают изначальную температуру t1Температура, при которой вещество приобретает свойства жидкости сразу после контакта с блоком. Как только это значение найдено, нагрев прекращается, и точка контакта между блоком и веществом гаснет. Во время постепенного охлаждения части вещества продолжают помещаться на блок. Таким образом, конечная температура t2, при которой вещество перестает плавиться.
Формула для определения температуры плавления по методу мгновенного плавления:
Методы 1 и 3 используются для определения температуры плавления твердых веществ, которые быстро превращаются в порошок, а метод 2 применяется для аморфных веществ, которые плавятся при температуре ниже 100 °C.
Температура плавления не может быть определена теоретически с помощью формул. Его можно найти в специальном химическом справочнике.

Температура плавления и кипения
Температура кипения и температура плавления описывают состояние, в котором происходят фазовые изменения в веществе. Эти понятия отличаются друг от друга. Температура плавления — это свойство, отражающее состояние равновесия между жидкой и твердой фазами. Точка кипения — это температура, при которой давление пара жидкости равно внешнему давлению.
Химический элемент со вторым атомным номером в периодической таблице Дмитрия Ивановича Менделеева имеет самую низкую температуру плавления. Гелий начинает плавиться при температур е-272°C. Он также имеет самую низкую температуру кипени я-268°C.
Графит, аллотропная модификация углерода, имеет самую высокую температуру плавления. Он начинает плавиться при температуре +3000°C. Другим аллотропным состоянием углерода является алмаз. Это твердое вещество начинает плавиться при температуре 3500°C.
Принцип определения температуры плавления
При плавлении изменяется яркость вещества. По сравнению с другими физическими величинами, изменение светопропускания легко обнаружить и можно использовать для определения температуры плавления. Порошки кристаллических веществ непрозрачны, тогда как их расплавы прозрачны. Этого кажущегося различия в оптических свойствах достаточно для определения температуры плавления путем измерения интенсивности света, проходящего через вещество в капилляре при нагревании печи.
Плавление твердого кристаллического вещества происходит в несколько этапов. При температуре фракции вещество остается в основном твердым и содержит небольшое количество расплава. Следующей стадией является температура образования мениска, при которой вещество в основном расплавлено, но все еще содержит некоторое количество твердой фазы. При температуре прозрачности вещество полностью расплавляется.


Капиллярный метод
Для измерения температуры плавления обычно используются тонкие стеклянные трубки (капиллярные трубки) с внутренним диаметром 1 мм и толщиной стенки 0,1-0,2 мм. Капилляр заполняют мелкозернистым веществом так, чтобы высота столбика составляла 2-3 мм, и помещают в нагревательное устройство (водяную баню или металлический блок) как можно ближе к точному термометру. Температура нагревателя повышается с постоянной скоростью, заданной пользователем. Температура плавления определяется визуально, наблюдая за плавлением вещества. В современных приборах, таких как Melting Point Excellence от METTLER TOLEDO, температура и диапазон плавления определяются автоматически с помощью видеокамеры. Капиллярный метод определения температуры плавления считается стандартным. Он описан во многих национальных фармакопеях.
На приборах МЕТТЛЕР ТОЛЕДО Melting Point Excellence можно одновременно разместить до шести капилляров.
Фармакопейные правила определения температуры плавления

Требования фармакопеи к определению температуры плавления относятся как к конструкции прибора, так и к процедуре измерения.
Краткий обзор требований:
- Используются капилляры с внешним диаметром 1,3–1,8 мм и толщиной стенок 0,1–0,2 мм.
- Постоянная скорость нагрева 1 °C в минуту.
- Если не указано иное, в большинстве Фармакопей требуется регистрировать температуру в точке C, когда твердая фаза отсутствует (соответствует температуре прозрачности).
- Регистрируемая температура — это температура нагревательной установки (масляной бани или металлического блока), в которой размещена термопара.
Более подробную информацию о международных нормах и стандартах см.
У какого металла самая высокая температура плавления

Твердый, огнеупорный, достаточно тяжелый материал светло-серого цвета с металлическим блеском. Сложность в обработке. При комнатной температуре он довольно хрупкий и ломается. Хрупкость металла обусловлена загрязнением углеродом и кислородом.
Технически чистый металл становится очень пластичным при температуре выше 400 °C. Он химически инертен и не вступает в реакцию с другими элементами. Он встречается в природе в виде сложных минералов: Гиобнерит, селит, ферберит и вольфрамит.
Вольфрам может быть извлечен в виде порошка из руды с помощью сложных химических процессов. Путем прессования и спекания он может быть переработан в детали и прутки правильной формы.
Вольфрам является чрезвычайно стойким элементом при любых температурах. По этой причине вольфрам не мог размягчиться в течение более ста лет. Не было печи, которая могла бы нагреть его до нескольких тысяч градусов по Цельсию. Ученые смогли доказать, что это самый стойкий металл. Хотя некоторые теории утверждают, что сибиллий более долговечен, это лишь предположение, поскольку он является радиоактивным элементом и имеет короткий срок жизни.
Зависимость температуры и теплоты плавления от давления. Точка плавления
Опыт показывает, что изменение внешнего давления на твердое тело влияет на температуру плавления этого твердого тела. Если при плавлении объем вещества увеличивается, то увеличение внешнего давления, которое тормозит процесс плавления, приводит к повышению температуры плавления. Если в процессе плавления объем вещества уменьшается, то увеличение внешнего давления приводит к снижению температуры плавления вещества, так как повышенное давление в этом случае способствует процессу плавления. Следует отметить, что только очень большое повышение давления существенно изменит температуру плавления вещества. Например, чтобы понизить температуру плавления льда на 1 Кельвин, необходимо повысить давление на 130 атмосфер.
Температура плавления вещества при нормальном атмосферном давлении называется температурой плавления вещества.
Оказывается, что удельная теплота плавления = 11,5. 10 3 Дж/кг, а для висмута. 10 3 Дж/кг, то при давлении 12. 10 3 атм. 103 Дж/кг и. 10 3 Дж/кг.
Уравнение теплового баланса при плавлении и кристаллизации
Многие расчеты процессов теплопередачи, включающих плавление и затвердевание, выполняются с использованием уравнения теплового баланса. В качестве примера рассмотрим, как выводится такое уравнение при определении удельной теплоты плавления льда с помощью калориметра.
Возьмите калориметр с массой при температуре льда и опустите в него кусок тающего льда с массой. Предположим, что когда весь лед растаял, температура в калориметре равна, т.е.
Калориметр и вода в нем выделяют тепло. Поэтому
С сайта
Из последнего уравнения, основываясь на результатах экспериментов, можно рассчитать удельную теплоту плавления льда. Она равна. 10 5 Дж/кг.
Растворы и сплавы. Охлаждающие смеси
Из практики известно, что различные соли и многие другие вещества, например, сахар, хорошо растворяются в воде. Показано, что эти вещества распадаются на отдельные молекулы, которые равномерно смешиваются с молекулами воды. Таким образом, раствор представляет собой равномерную смесь молекул растворителя и растворенного вещества.
Поваренная соль хорошо растворяется в воде, но можно добавить в воду столько соли, что она перестанет растворяться. То же самое справедливо и для большинства других решений. Раствор, в котором вещество больше не может растворяться, называется насыщенным раствором. Однако существуют также растворы, в которых молекулы двух веществ могут быть смешаны в любом соотношении, например, раствор этилового спирта в воде (или воды в спирте).
Когда твердые вещества растворяются в жидкостях, необходимо затратить энергию, называемую теплотой растворения. Поэтому такое растворение часто приводит к охлаждению раствора. Например, когда аммиак растворяется в воде, температура значительно снижается. Если между растворяемым веществом и растворителем происходит химическая реакция, раствор может нагреваться.
На растворение многих веществ влияет температура. (Например, при повышении температуры растворимость сахара резко увеличивается, а растворимость воздуха в воде уменьшается). Растворимость многих газов может резко увеличиваться при повышении давления. (Помните, что большое количество углекислого газа растворяется в вине или воде при повышении давления. При быстром всплытии с большой глубины водолаз может умереть от «болезни водолаза», потому что при резком падении давления высвобождаются газы, растворенные в крови, и кровь как будто закипает). Твердые, жидкие и газообразные вещества могут растворяться в жидком растворителе. Но не все вещества образуют растворы. Ртуть и парафин, например, не растворяются в воде.
Когда насыщенный раствор твердого вещества охлаждается или испаряется, можно наблюдать его кристаллизацию. Выращивание больших монокристаллов таким способом является практичным. Для этого небольшой кристалл растворителя взвешивается в насыщенном растворе, и раствор очень медленно испаряется.
Растворитель понижает температуру застывания растворителя и повышает его температуру кипения. Например, концентрированный раствор поваренной соли в воде замерзает пр и-21 °C, а раствор хлорида кальция замерзает пр и-55 °C. Поэтому в качестве охлаждающей жидкости иногда используется смесь снега и соли. Сначала в воде в такой смеси образуется небольшое количество соли, затем происходит дальнейшее растворение кристаллов в смеси, что вызывает значительное понижение температуры.
Расплавляя различные вещества и смешивая их в определенном соотношении, можно получить разнообразные сплавы. Иногда образуются твердые растворы. К ним относится сталь, которая представляет собой раствор углерода в железе. Атомы углерода в стали расположены в промежутках решетки железа, т.е. они встроены между атомами железа. В твердых растворах атомы одного металла могут замещать атомы другого металла в узлах решетки. Примером такого решения являются сплавы меди и золота.
В технике часто требуются материалы со свойствами, не встречающимися в природных материалах. Затем подбираются подходящие материалы путем создания новых сплавов с желаемыми свойствами. Некоторые сплавы обладают высокой пластичностью, другие — высокой механической прочностью и малым весом, третьи — очень низкой температурой плавления, четвертые — высокой жаропрочностью и т.д. Поэтому разработка новых сплавов и изучение их свойств является одной из важнейших задач современной науки и техники.
Открытый капиллярный метод
Используется стеклянный капилляр, открытый с обоих концов и длиной около 80 мм с внешним диаметром от 1,4 до 1,5 мм и внутренним диаметром от 1,0 до 1,2 мм.
Вещество, предварительно приготовленное, как описано в фармакопее, помещают в каждый из 5 капилляров в количестве, достаточном для образования столбика высотой около 10 мм в каждом капилляре. Оставьте капилляры при температуре, указанной в фармакопее, на определенное время.
Подсоедините один из капилляров к термометру с температурой 0,2 °C так, чтобы вещество находилось около шарика термометра.
Поместите термометр с капилляром в стакан так, чтобы расстояние между дном стакана и дном шарика термометра составляло 1 см. Наполните мензурку водой на высоту 5 см.
Повышайте температуру воды на 1 °C в минуту.
Температура плавления — это температура, при которой вещество начинает подниматься по капилляру. Если столбик вещества в капилляре не поднимается, то температура плавления — это температура, при которой столбик вещества в капилляре становится прозрачным.
Та же процедура повторяется еще с 4 капиллярами, и результат рассчитывается как среднее арифметическое из 5 значений. Разница между всеми значениями не должна превышать 1 °C.
Метод мгновенного плавления
Аппарат Аппарат должен состоять из металлического блока, изготовленного из материала с высокой теплопроводностью, который не взаимодействует с испытуемым веществом, например, из латуни. Верхняя часть блока должна быть плоской и тщательно отполированной. Блок должен быть равномерно нагрет по всей массе с помощью газовой горелки с микрорегулировкой или электрического нагревателя с точной настройкой. Блок должен иметь цилиндрическую полость, достаточно большую для размещения термометра, ртутный столбик которого должен находиться в одном и том же положении как для калибровки, так и для определения температуры плавления исследуемого вещества. Цилиндрическая полость должна быть расположена параллельно полированной верхней поверхности блока на расстоянии около 3 мм от нее.
Методология Блок быстро нагревают до температуры на 10 °C ниже ожидаемой температуры плавления, а затем нагревают со скоростью около 1 °C в минуту. Несколько частиц мелкозернистого вещества, высушенного в вакууме в течение 24 часов на безводном силикагеле, периодически опускаются на поверхность блока вблизи колбы термометра, поверхность очищается после каждого испытания. Температура t1Нагревание вещества, которое плавится сразу же при контакте с металлом. Отопление прерывается. Во время охлаждения несколько частиц вещества через равные промежутки времени падают на поверхность блока, который очищается после каждого испытания. Температура t2при котором вещество перестает плавиться при контакте с металлом.
Температура плавления (Tтемпература плавления) рассчитывается по следующей формуле:

t1— первое значение температуры
t2— второе значение температуры.
Метод каплепадения
Этот метод определяет температуру, при которой первая капля расплавленного испытуемого вещества падает из стакана при условиях, приведенных ниже.
Аппарат Аппарат состоит из двух металлических защитных трубок (A и B), соединенных резьбой. Термосенсор ( A ) прикреплен к ртутному термометру. Металлическая чашка (D) неплотно прилегает к нижней части защитной трубки (B) с помощью двух уплотнений (D). Точное положение чашки определяется зажимами длиной 2 мм (E), которые также используются для центрирования термометра. Отверстие (C) в стенке термокамеры (B) служит для выравнивания давления. Выходная поверхность чаши должна быть плоской, а края выходного отверстия должны быть перпендикулярны поверхности. Дно ртутного термометра должно иметь форму и размер, показанные на рисунке 2. Термометр имеет шкалу от 0 до 110 ºC, а расстояние на шкале в 1 мм соответствует разнице температур в 1 ºC. Ртутная сфера термометра имеет диаметр (3,5 ± 0,2) мм и высоту (6,0 ± 0,3) мм.
Устройство размещается вдоль оси пробирки длиной около 200 мм и внешним диаметром около 40 мм.
Прибор должен быть прикреплен к пробирке с помощью колпачка, в который вставляется термометр и который имеет прорезь сбоку. Отверстие стакана должно находиться на расстоянии около 15 мм от дна пробирки. Весь аппарат погружается в стакан емкостью около 1 литра, наполненный водой. Дно пробирки должно находиться на расстоянии около 25 мм от дна стакана. Уровень воды должен достигать верха стакана (A). Для равномерного распределения температуры в стакане используется мешалка.
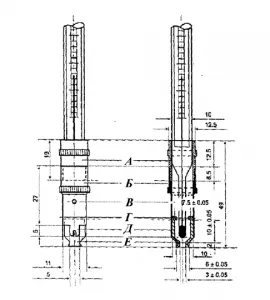
Устройство для определения точки падения
. Необходимые размеры в мм
Метод. Заполните стакан до краев нерасплавленной тестовой смесью, если иное не указано в фармакопее. Удалите излишки смеси с обеих сторон лопаточкой. После соединения втулок (A) и (B) вставьте чашку как можно дальше внутрь втулки (B). С помощью шпателя удалите вещество, отделившееся от термометра. Поместите устройство в водяную баню, как описано выше. Нагрейте водяную баню до температуры примерно на 10 °C ниже ожидаемой температуры плавления и выберите скорость нагрева примерно 1 °C в минуту. Обратите внимание на падение температуры первой капли. Проведите не менее трех определений, каждый раз с новым образцом вещества. Разница между измеренными значениями не должна превышать 3 °C. Вычислите среднее арифметическое полученных значений.