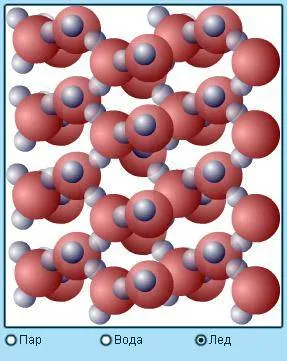
Поверхность жидкости, которая не соприкасается со стенками емкости, называется свободной поверхностью. Она образуется под действием силы тяжести на молекулы жидкости.
Подписи к слайдам:
Основные положения МКТ
Все тела состоят из маленьких частиц, между которыми есть промежутки. Частицы тел движутся непрерывно и беспорядочно. Частицы тел взаимодействуют друг с другом: они притягиваются и отталкиваются друг от друга.
Авторы атомной теории Джон Д. Дальтон Менделеев Амедео Эрнест Авогадро Резерфорд
Микропараметры материи характеризуют каждую отдельную частицу материи, в отличие от макропараметров, которые характеризуют материю в целом. К микропараметрам материи относятся: размер молекул, масса молекулы, количество вещества (так как оно отражает количество структурных единиц вещества), молекулярная масса и т.д. Макропараметры включают: Давление P, объем тела V, масса вещества m, температура T и т.д. При изучении структуры материи перед исследователями открылся новый мир — мир более мелких частиц, микромир. Любое тело, которое в механике рассматривается как единое целое, оказывается сложной системой, состоящей из огромного количества постоянно движущихся частиц. Микро- и макропараметры
Все вещества — жидкости, твердые тела и газы — состоят из мельчайших частиц: Молекулы, атомы, ионы. Молекулы и атомы являются электрически нейтральными частицами. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и становиться положительными или отрицательными ионами.
ВТОРОЕ ПРЕДПОЛОЖЕНИЕ Движение отдельных частиц Движение молекул газов Движение молекул твердых тел.
ТРЕТЬЕ ПРЕДПОЛОЖЕНИЕ Частицы взаимодействуют друг с другом посредством сил, которые по своей природе являются электрическими. Гравитационное взаимодействие между частицами пренебрежимо мало
ПРЕДЛОЖЕНИЕ I Предположение 1. разрушение вещества 2. испарение жидкостей 3. расширение тел при нагревании
ПРЕДЛОЖЕНИЕ II Теорема 1. Диффузия — смешивание молекул различных веществ. Броуновское движение — движение частиц, взвешенных в жидкости.
ЭКСПЕРИМЕНТ III Пункт Упругие силы Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение .
ОЦЕНКА РАЗМЕРА ЧАСТИЦ
Количество вещества В одной единице массы, 1 килограмме вещества, содержится разное количество структурных единиц — атомов, молекул. Количество частиц зависит от типа материи. А в единице массы вещества, 1 моль, содержится такое же количество частиц. 1 кг алюминия 1 кг золота 1 кг льда N=2,2 10 25 атомов N=3,3 10 25 атомов N=6 10 23 атомов N=6 10 23 молекул алюминий золото лед 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль 1 моль
В молекулярно-кинетической теории количество материи считается пропорциональным числу частиц. Единица количества вещества называется молекулой. Молекула — это количество вещества, которое содержит столько частиц (молекул), сколько атомов содержится в 0,012 кг углерода 12 C.
МОЛЯРНАЯ МАССА Молекула любого вещества содержит одинаковое количество частиц (молекул). Это число называется постоянной Авогадро N A : N A = 6-10 23 мол ь-1 Все газы являются двухатомными, за исключением благородных газов M( H 2 ) = 2 г/моль M( O 2 ) = 32 г/моль M( N 2 ) = 28 г/моль M( Ne ) = 4 г/моль
m 0 — масса молекулы M — молекулярная масса N A — число Авогадро
ЗАДАЧА A 1. Вычислите массу молекулы H 2 S O 4. Решение: М(H 2 S О 4 ) = 2-1 + 32 + 16-4 = 98 г/моль
2. сколько молекул содержится в 50 г A ℓ? Решение: M( Aℓ ) = 27г/моль N = ν N A ν = m/M ν = 50г:27г/моль = 1,85моль N = 1,85-6-10²³ = 11-10²³
Предварительный просмотр:
Основные положения МКТ
Молекулярно-кинетическая теория — это теория строения и свойств материи, основанная на идее о существовании атомов и молекул как мельчайших частиц химического вещества.
Молекулярно-кинетическая теория основана на трех основных положениях:
- Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
- Атомы и молекулы находятся в непрерывном хаотическом движении.
- Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.

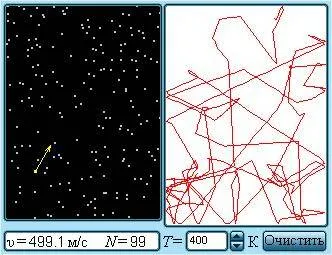
Траектория броуновской частицы.
Наиболее ярким экспериментальным подтверждением концепции молекулярно-кинетической теории неупорядоченного движения атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Его открыл английский ботаник Р. Браун (1827): броуновские частицы движутся под хаотическим воздействием молекул. Из-за хаотического теплового движения молекул эти аномалии никогда не уравновешиваются. В результате скорость броуновской частицы изменяется случайным образом как по степени, так и по направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис. 3.1.1). Теория броуновского движения была предложена А. Эйнштейном (1905) и экспериментально подтверждена опытами французского физика Ж. Перрена (1908-1911).
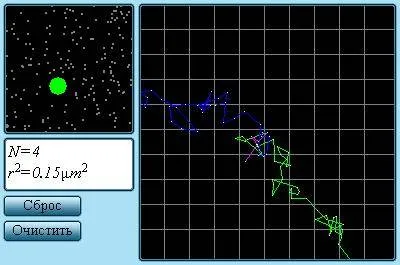
Модель. Броуновское движение.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы — это сложные пространственные структуры с положительными и отрицательными зарядами. Если расстояние между молекулами достаточно велико, то преобладают межмолекулярные притягательные силы. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и динамической энергии E p взаимодействия между молекулами от расстояния между их центрами качественно показаны на рис. На определенном расстоянии r = r 0 сила взаимодействия равна нулю. Это расстояние можно условно считать диаметром молекулы. Потенциальная энергия взаимодействия при r = r 0 минимальна. Чтобы переместить две молекулы на расстояние r 0 друг от друга, необходимо сообщить им дополнительную энергию E 0. Величина E 0 называется глубиной потенциальной ямы или энергией связи.
Основные положения молекулярно-кинетической теории

Одним из видов энергии в природе является внутренняя тепловая энергия. Природа этой энергии изучается в рамках теории, называемой молекулярно-кинетической теорией (FMD). Давайте ознакомимся с основными положениями молекулярно-кинетической теории.
Возникновение молекулярно-кинетической теории
Первые идеи о том, что тепло — это движение мельчайших неделимых частиц материи, были высказаны еще в глубокой древности. Согласно учениям Лейциппа и Демокрита, движение атомов было причиной всего сущего.

Однако древние взгляды были в основном домыслами, не основанными на исследованиях и экспериментах. Первые научные эксперименты, послужившие основой для будущей теории, были проведены в начале эпохи Возрождения, а окончательная научная форма МКТ сформировалась лишь в 18 веке.
Вначале была широко распространена идея о существовании особого «теплоносителя» — флюса или термоуглерода, содержащегося в топливе и выделяющегося при сгорании. Пламя рассматривалось как одна из составляющих материи. Были составлены специальные таблицы, описывающие движение огнемета. Тот факт, что масса вещества увеличивается при сгорании, был объяснен отрицательной массой пламегасителя.
Однако результаты исследований Г. Кавендиша, А. Лавуазье и М. Ломоносова полностью опровергли теорию пламени и заложили основу молекулярной теории тепла. Согласно М. Ломоносову, все вещества состоят из мельчайших частиц — молекул, а теплота — это вращательное движение этих частиц.
В результате исследований структуры материи основные положения молекулярно-кинетической теории в конце концов приобрели современную форму.Эти заявления выглядят следующим образом:

- вещество состоит из мельчайших частиц-молекул;
- молекулы находятся в хаотическом движении;
- тепловые явления — это результат взаимодействия молекул.
Доказательства положений МКТ
Первоначально экспериментальные обоснования утверждений о МКТ были косвенными. Например, тонкости распространения масла на поверхности воды позволяют оценить размер молекул, если известен объем капли масла и область максимального распространения.
Явления диффузии (спонтанное смешивание газов и жидкостей) также можно объяснить только тем, что частицы вещества находятся в постоянном движении и что это движение связано с температурой, поскольку диффузия ускоряется с повышением температуры.
Наконец, Д. Дальтоном был открыт закон постоянных пропорций, который гласит, что массовые соотношения элементов, участвующих в химических реакциях, всегда имеют целочисленные значения. Это также можно объяснить, только если предположить, что вещества состоят из молекул, каждая из которых содержит точно определенное количество атомов элементов.
Однако прямое доказательство существования МКТ было получено английским ботаником Р. Брауном в 1827 году. Он наблюдал под микроскопом суспензию пыльцы растений и обнаружил, что частицы находятся в постоянном хаотическом движении, зависящем от температуры.
Броуновское движение одновременно доказывает все три тезиса МКТ. Броуновское движение возможно только в том случае, если предположить, что броуновские частицы окружены более мелкими частицами жидкости, которые могут двигаться и взаимодействовать, передавая механический импульс броуновским частицам и друг другу. Поскольку броуновское движение увеличивается с ростом температуры, скорость частиц также зависит от температуры и может быть оценена с помощью специальных формул.
Взаимодействие частиц
Существование стабильных жидкостей и твердых тел объясняется силами межмолекулярного взаимодействия (взаимное притяжение и отталкивание). Те же причины объясняют низкую сжимаемость жидкостей и способность твердых тел сопротивляться сжимающим и растягивающим напряжениям.
Силы межмолекулярного взаимодействия имеют электромагнитную природу — это силы электрического происхождения. Причина этого заключается в том, что молекулы и атомы состоят из заряженных частиц с противоположными знаками заряда: Электроны и положительно заряженные атомные ядра. В целом, молекулы электрически нейтральны. По своим электрическим свойствам молекула может считаться электрическим диполем.
Предполагается, что притягивающая сила отрицательна, а отталкивающая — положительна, хотя это разделение условно.
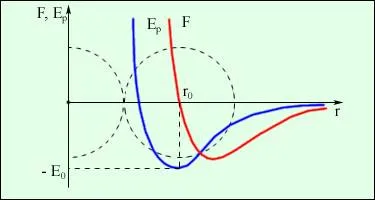
Сила взаимодействия между молекулами явно зависит от расстояния между молекулами. Эта зависимость показана на рисунке 1.1. Он показывает проекции сил взаимодействия на прямую линию, проходящую через центры молекул.
Рис. 1.1 Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видно, по мере уменьшения расстояния r между молекулами сила притяжения Fр прувеличивается (красная линия на рисунке). Как уже упоминалось, притягивающие силы предполагаются отрицательными, поэтому кривая наклоняется вниз с уменьшением расстояния, т.е. в отрицательную область диаграммы.
Притягательные силы действуют, когда два атома или молекулы приближаются друг к другу, пока расстояние r между молекулярными центрами составляет около 10-9 м (2-3 диаметра молекулы). Чем больше расстояние, тем слабее становятся силы притяжения. Притягивающие силы — это силы короткого действия.
где α — коэффициент, зависящий от типа притяжения и структуры взаимодействующих молекул.
По мере дальнейшего приближения атомов или молекул друг к другу силы отталкивания Fр из(синяя линия на рис. 1.1). Эти силы возникают из-за взаимного отталкивания положительно заряженных атомов в молекуле и уменьшаются даже быстрее, чем притягивающая сила, с увеличением расстояния r (как показано на графике — синяя линия стремится «круче» к нулю, чем красная).
где b — коэффициент, зависящий от природы отталкивающей силы и структуры взаимодействующих молекул.
На расстоянии r = r0(расстояние приблизительно равно сумме радиусов молекул) притягивающие силы уравновешивают отталкивающие силы, и проекция результирующей силы Fr= 0. Это состояние соответствует наиболее устойчивому расположению взаимодействующих молекул.
В общем случае конституирующая сила равна:
При r>r0притяжение молекул превышает отталкивание, при r
Зависимость силы взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм упругих сил в твердых телах.
Когда твердое тело растягивается, частицы удаляются друг от друга на расстояния, превышающие r0. Это создает притягательную силу между молекулами, которая возвращает частицы в исходное положение.
Когда твердое тело сжимается, частицы перемещаются ближе друг к другу на расстояния меньше r.0. Это приводит к увеличению отталкивающих сил, которые возвращают частицы в исходное положение и предотвращают дальнейшее сжатие.
Броуновское движение
Броуновское движение — это непрерывное хаотическое движение мелких частиц, взвешенных в жидкости или газе (при условии, что гравитация не влияет на их движение).
Впервые это явление наблюдал Роберт Браун (Brown, 1773 — 1858), когда с помощью микроскопа наблюдал за движением пыльцы, взвешенной в воде. Сегодня для таких наблюдений используются небольшие кусочки нерастворимого в воде пигмента камеди. В газах броуновское движение — это, например, взвешенная в воздухе частица пыли или дыма.
Броуновское движение частицы происходит потому, что молекулы жидкости или газа не уравновешивают друг друга. Молекулы среды (например, молекулы газа или жидкости) движутся хаотично, поэтому их столкновения приводят коричневую частицу в неупорядоченное движение: Коричневая частица быстро меняет свою скорость направление и размер.
Броуновское движение — это тепловое движение, интенсивность которого увеличивается с ростом температуры среды и которое продолжается неопределенно долго без видимых изменений. Интенсивность броуновского движения увеличивается с уменьшением размера и массы частиц и с уменьшением вязкости среды.
Броуновское движение является самым четким экспериментальным доказательством существования атомов (молекул) и их хаотического теплового движения. Полная молекулярно-кинетическая теория броуновского движения была создана в 1905-1906 годах немецким ученым Альбертом Эйнштейном (1879-1955) и польским физиком Марианом Смолуховским (1872-1917). В 1908-1911 годах французский ученый Жан Перрен (1870-1942) провел серию экспериментов по броуновскому движению и окончательно подтвердил законы этого движения, которые были предсказаны на основе молекулярно-кинетической теории.
Если определять положение частицы через небольшие регулярные промежутки времени, например, каждые 30 секунд, то траектория частицы, построенная таким образом, представляет собой пунктирную линию. На рисунке 1.2 показана траектория движения частицы цвета гумигута в воде (по Перрену). Радиус частицы составляет 0,52*1 0-6м, а расстояние между делениями сетки — 3,4*1 0-6м.
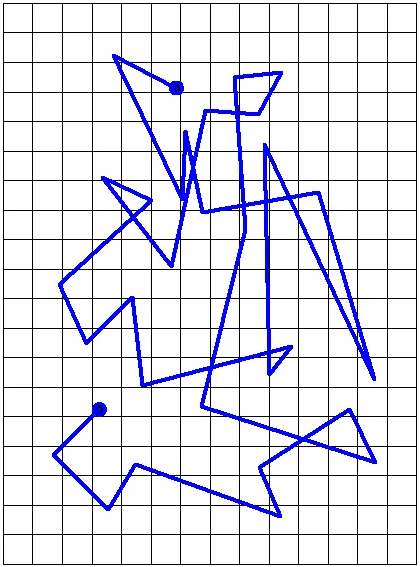
Рисунок 1.2: Орбита броуновской частицы (частица цвета жевательной резинки в воде по Перрену).
Броуновское движение, например, в метрологии, является основной причиной ограничения точности чувствительных измерительных приборов, поскольку тепловое движение атомов компонентов прибора и окружающей среды вызывает колебания индекса измерительного прибора.
Масса и размер молекул
Многие эксперименты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома может быть определен различными способами. Например, электронный микроскоп использовался для фотографирования некоторых крупных молекул, а ионный проектор (ионный микроскоп) можно использовать не только для изучения структуры кристаллов, но и для определения расстояния между отдельными атомами в молекуле.
С помощью современной экспериментальной техники удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*1 0-8 см.
Для характеристики атомов используется понятие атомного радиуса, которое позволяет оценить межатомное расстояние в молекулах, жидкостях или твердых телах, поскольку атомы не имеют определенных границ размеров. Атомный радиус — это сфера, которая содержит большую часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что его можно представить только в сравнении. Например, молекула воды меньше большого яблока в раз.
Насыщенные и ненасыщенные пары
Насыщенный пар
При испарении происходит обратный процесс одновременно с превращением молекул из жидкости в пар. При беспорядочном движении по поверхности жидкости некоторые молекулы, покинувшие жидкость, возвращаются в нее.
Когда испарение происходит в закрытом контейнере, количество молекул, выходящих из жидкости, изначально больше, чем количество молекул, возвращающихся в жидкость. Поэтому плотность пара в контейнере будет постепенно увеличиваться. По мере увеличения плотности пара, количество молекул, возвращающихся в жидкость, также увеличивается. Очень скоро количество молекул, выходящих из жидкости, сравняется с количеством молекул пара, возвращающихся в жидкость. С этого момента число молекул пара над жидкостью остается постоянным. Для воды при комнатной температуре это число составляет около $10^$ молекул на 400с^2$ площади поверхности. Создается так называемое динамическое равновесие между паром и жидкостью.
Пар, который находится в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Это означает, что определенный объем не может содержать больше пара при определенной температуре.
При динамическом равновесии масса жидкости в закрытом контейнере не меняется, хотя жидкость продолжает испаряться. Масса насыщенного пара над этой жидкостью также не изменяется, хотя пар продолжает конденсироваться.
Давление насыщенных паров. Когда насыщенный пар, температура которого поддерживается постоянной, сжимается, равновесие сначала нарушается: плотность пара увеличивается, и, следовательно, больше молекул переходит из газа в жидкость, чем из жидкости в газ; это продолжается до тех пор, пока концентрация пара в новом объеме не станет равной концентрации насыщенного пара при данной температуре (и равновесие восстановится). Это объясняется тем, что количество молекул, покидающих жидкость в единицу времени, зависит только от температуры.
Поэтому концентрация молекул насыщенного пара при постоянной температуре не зависит от их объема.
Поскольку давление газа пропорционально концентрации его молекул, давление насыщенного пара не зависит от занимаемого им объема. Давление $p_0$, при котором жидкость находится в равновесии со своими парами, называется давлением насыщенных паров.
При сжатии насыщенного пара большая его часть переходит в жидкое состояние. Жидкость занимает меньший объем, чем пар той же массы. В результате объем пара уменьшается, если его плотность остается неизменной.
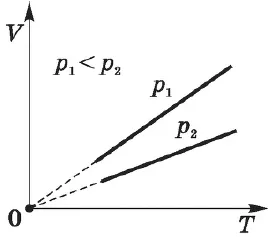
Зависимость давления насыщенных паров от температуры. Для идеального газа при постоянном объеме действует линейная зависимость давления от температуры. В случае насыщенного пара с давлением $p_0$ эта зависимость выражается равенством:
Поскольку давление насыщенного пара не зависит от объема, оно зависит только от температуры.
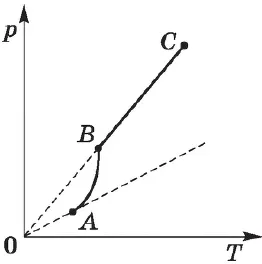
Экспериментально определенная зависимость $P_0(T)$ отличается от зависимости $p_0=nkT$ для идеального газа. С повышением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (часть кривой $AB$). Это особенно хорошо видно при построении изохорды через точку $A$ (пунктирная линия). Это происходит потому, что при нагревании жидкости часть ее превращается в пар, и плотность пара увеличивается.
Таким образом, согласно формуле $p_0=nkT$, давление насыщенного пара увеличивается не только за счет повышения температуры жидкости, но и за счет увеличения концентрации молекул (плотности) пара. Основное различие в поведении идеальных газов и насыщенных паров заключается в изменении массы пара с изменением температуры при постоянном объеме (в закрытом сосуде) или с изменением объема при постоянной температуре. Это невозможно в случае идеального газа (МКТ идеального газа не допускает фазового перехода из газа в жидкость).
Основные положения молекулярно-кинетической теории
В этом уроке мы узнаем, какие физические системы изучаются в молекулярной физике. Мы узнаем, чем отличаются друг от друга механические и тепловые явления. Мы познакомимся с основными понятиями молекулярно-кинетической теории материи. Мы также научимся определять размер и массу молекул.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам необходимо добавить его в свой личный кабинет.
2. Распределите видеоуроки по личным кабинетам ваших учеников.
3. Смотрите статистику просмотра видеоуроков учениками.
Конспект урока «Основные положения молекулярно-кинетической теории»
На уроках физики и химии в начальной школе вы узнали, что все вещества имеют определенную структуру, то есть состоят из очень-очень маленьких частиц — атомов, молекул и ионов. Атомы и молекулы взаимодействуют друг с другом и образуют разнообразные вещества. А если число частиц невелико (до нескольких десятков или сотен), то мы говорим о микросистеме. Однако мы живем в мире макромира, который состоит из макроскопических тел (так мы называем тела, состоящие из большого количества частиц). Краб и песчинка, море и маяк, луна и человек — все это примеры макроскопических тел.

В механике мы изучали движение макроскопических тел под действием сил. Но происхождение этих сил неясно. Например, мы знаем, что силы упругости возникают в теле при его сжатии или растяжении. Но почему они возникают? А почему возникают силы трения и силы сопротивления среды? В конце концов, механика просто не может объяснить, почему существуют состояния материи. Ответы на эти и другие вопросы можно найти в молекулярно-кинетической теории строения вещества (сокращенно МСТ), основы которой были заложены Даниилом Бернулли в 1738 году. В начале своего развития соматокинетическая теория тепла, которая была разработана в середине XVIII века. Она была сформулирована Михаилом Васильевичем Ломоносовым в середине XVIII века.
Современная молекулярно-кинетическая теория основана на трех важных и ключевых моментах. Во-первых, абсолютно все вещества состоят из мельчайших частиц, разделенных промежутками.

Частицы — это молекулы, атомы и ионы. Молекула — это наименьшая частица вещества, которая сохраняет свои химические, но не физические свойства.
Молекулы состоят из еще более мелких частиц, называемых атомами. Атом — это наименьшая частица химического элемента, которая сохраняет свои химические свойства.
Атомы, в свою очередь, также являются довольно сложными образованиями. В классической молекулярно-кинетической теории, однако, они рассматриваются как твердые, неделимые частицы сферической формы.
Второе утверждение МКТ гласит, что все частицы материи находятся в постоянном хаотическом движении.
И третье утверждение гласит, что частицы материи связаны друг с другом силами молекулярного взаимодействия, которые являются силами притяжения или отталкивания в зависимости от расстояния.

Первое утверждение МКТ косвенно подтверждается явлениями сжимаемости и растворимости веществ. Например, закон сохранения массы, сформулированный выдающимся русским ученым Михаилом Ломоносовым в 1755 году, закон простых объемных соотношений реагирующих газов, открытый французом Жозефом-Луи Ги-Лисаком в 1808 году, и закон множителей, сформулированный английским автодидактом Джоном Дальтоном в 1803 году. Кстати, последний закон может быть объяснен только представлениями о дискретной структуре материи.
Основные положения молекулярно-кинетической теории и их опытное обоснование
Молекулярно-кинетическая теория (МКТ) — это учение, объясняющее тепловые явления в макроскопических телах и внутренние свойства этих тел через движение и взаимодействие атомов, молекул и ионов, из которых состоят тела. На основе МКТ можно сделать три утверждения о структуре материи:
- Вещество состоит из частиц – молекул, атомов и ионов. В состав этих частиц входят более мелкие элементарные частицы. Молекула – наименьшая устойчивая частица данного вещества. Молекула обладает основными химическими свойствами вещества. Молекула является пределом деления вещества, то есть самой маленькой частью вещества, которая способна сохранять свойства этого вещества. Атом – это наименьшая частица данного химического элемента.
- Частицы, из которых состоит вещество, находятся в непрерывном хаотическом (беспорядочном) движении.
- Частицы вещества взаимодействуют друг с другом – притягиваются и отталкиваются.
Эти основные положения подтверждены экспериментально и теоретически.
Состав вещества
Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. С помощью электронного микроскопа или ионного проектора (микроскопа) можно получить изображения отдельных атомов и оценить их размер. Диаметр отдельных атомов составляет порядка d = 1 0-8 см (1 0-10 м). Размер молекул больше, чем размер атомов. Поскольку молекулы состоят из более чем одного атома, чем больше атомов содержит молекула, тем больше ее размер. Размер молекул составляет от 1 0-8 см (1 0-10 м) до 1 0-5 см (1 0-7 м).
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотическое движение означает, что у молекул нет предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления одинаково возможны.
Диффузия (от лат. diffusio) — это явление, при котором в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (когда вещества находятся в контакте).
Взаимное смешивание веществ происходит из-за непрерывного и неупорядоченного движения атомов или молекул (или других частиц) вещества. Со временем глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем выше скорость частиц вещества и тем быстрее диффузия.
Диффузия происходит во всех агрегатных состояниях — в газах, жидкостях и твердых телах. Примером диффузии в газах является диффузия запахов в воздух при отсутствии прямого смешивания. Диффузия в твердых телах позволяет металлам соединяться во время сварки, пайки, нанесения покрытий и т.д. Диффузия происходит гораздо быстрее в газах и жидкостях, чем в твердых телах.
Взаимодействие частиц
Существование стабильных жидкостей и твердых тел объясняется силами межмолекулярного взаимодействия (взаимное притяжение и отталкивание). Те же причины объясняют низкую сжимаемость жидкостей и способность твердых тел сопротивляться сжимающим и растягивающим напряжениям.
Силы межмолекулярного взаимодействия имеют электромагнитную природу — это силы электрического происхождения. Причина этого заключается в том, что молекулы и атомы состоят из заряженных частиц с противоположными знаками заряда: Электроны и положительно заряженные атомные ядра. В целом, молекулы электрически нейтральны. По своим электрическим свойствам молекула может считаться электрическим диполем.
Предполагается, что притягивающая сила отрицательна, а отталкивающая — положительна, хотя это разделение условно.
Сила взаимодействия между молекулами явно зависит от расстояния между молекулами. Эта зависимость показана на рисунке 1.1. Он показывает проекции сил взаимодействия на прямую линию, проходящую через центры молекул.
Рис. 1.1 Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видно, по мере уменьшения расстояния r между молекулами сила притяжения Fр прувеличивается (красная линия на рисунке). Как уже упоминалось, притягивающие силы предполагаются отрицательными, поэтому кривая наклоняется вниз с уменьшением расстояния, т.е. в отрицательную область диаграммы.
Притягательные силы действуют, когда два атома или молекулы приближаются друг к другу, пока расстояние r между молекулярными центрами составляет около 10-9 м (2-3 диаметра молекулы). Чем больше расстояние, тем слабее становятся силы притяжения. Притягивающие силы — это силы короткого действия.
где α — коэффициент, зависящий от типа притяжения и структуры взаимодействующих молекул.
По мере дальнейшего приближения атомов или молекул друг к другу силы отталкивания Fр из(синяя линия на рис. 1.1). Эти силы возникают из-за взаимного отталкивания положительно заряженных атомов в молекуле и уменьшаются даже быстрее, чем притягивающая сила, с увеличением расстояния r (как показано на графике — синяя линия стремится «круче» к нулю, чем красная).
где b — коэффициент, зависящий от природы отталкивающей силы и структуры взаимодействующих молекул.
На расстоянии r = r0(расстояние приблизительно равно сумме радиусов молекул) притягивающие силы уравновешивают отталкивающие силы, и проекция результирующей силы Fr= 0. Это состояние соответствует наиболее устойчивому расположению взаимодействующих молекул.
В общем случае конституирующая сила равна:
При r>r0притяжение молекул превышает отталкивание, при r
Зависимость силы взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм упругих сил в твердых телах.
Когда твердое тело растягивается, частицы удаляются друг от друга на расстояния, превышающие r0. Это создает притягательную силу между молекулами, которая возвращает частицы в исходное положение.
Когда твердое тело сжимается, частицы перемещаются ближе друг к другу на расстояния меньше r.0. Это приводит к увеличению отталкивающих сил, которые возвращают частицы в исходное положение и предотвращают дальнейшее сжатие.
Основные положения МКТ и агрегатные состояния вещества
Определение Молекулярно-кинетическая теория (МКМ) — это отрасль молекулярной физики, изучающая свойства вещества на основе представлений о его молекулярной структуре и определенных законах взаимодействия между атомами (молекулами), составляющими вещество.
? Вся материя состоит из молекул. Это было подтверждено фотографиями, сделанными с помощью электронного микроскопа.
О наличии пустот можно судить по разным объемам жидкостей до и после смешивания. Например, объем смеси воды и спирта меньше, чем сумма объемов воды и спирта до смешивания. При нагревании зазоры между молекулами увеличиваются, при охлаждении — уменьшаются. Исключение составляют вода и резина. В воде при охлаждении увеличиваются промежутки между молекулами. В резине зазоры между молекулами уменьшаются при нагревании. Движение молекул Движение молекул доказывает эффект диффузии. Определение Диффузия — это смешивание веществ без внешнего воздействия. Чем быстрее движутся молекулы, тем выше температура вещества. И наоборот. Поэтому скорость диффузии зависит от температуры вещества. Броуновское движение — это тепловое движение частиц под воздействием молекул вещества, в котором эти частицы находятся во взвешенном состоянии. Доказательством этого является соединение двух плоских стаканов, смоченных водой. На расстоянии, равном размеру молекул, притяжение наиболее выражено. Отталкивание более выражено на меньших расстояниях.
Свойства твердых, жидких и газообразных веществ
| Состояние материи | Экономия объема | Сохраняет свою форму | Особые свойства |
| Твердый | + | + | – |
| Жидкость | + | – | Жидкость |
| Газ | – | – | Волатильность |
| Твердый | Жидкость | Газ | |
| Структура | |||
| Расстояние между молекулами | Сопоставимы с размером молекул | Немного больше, чем в твердом состоянии | Во много раз больше размеров молекул |
| Природа движения | Осциллирующий | Прыжки | Хаотичный |
| Скорости частиц | Маленький | Довольно маленький | Огромный |
| Взаимодействие между молекулами | Выше | Ниже, чем твердые частицы | Самый маленький |
Важно! Химический состав молекул не зависит от агрегатного состояния.
Микроскопические параметры вещества
Микроскопические параметры вещества — это параметры отдельной частицы этого вещества.
Относительная атомная масса
Определение Относительная атомная масса — это значение массы атома, выраженное в атомных единицах массы (а.е.м.). Относительная атомная масса обозначается Ar. Это безразмерная величина, определяемая как отношение массы атома данного элемента к массе 1⁄12 нейтрального атома изотопа углерода 12 C: A r = m 0 1 12. m 0 C. m0— масса атома, m0С— масса атома углерода. Осторожно. Относительная атомная масса может быть взята из таблицы Менделеева. Пример 1: Определите относительную атомную массу хлора, используя таблицу Менделеева. В таблице Менделеева относительный атомный вес указан под названием химического элемента: Мы видим, что Ar= 35,453 а.е.м. При решении задач это значение обычно округляют в меньшую сторону до 35,5 а.е.м.
Относительная молекулярная масса
Определение Относительная молекулярная масса — это масса молекулы, выраженная в а.е.м. Относительная молекулярная масса обозначается M .r. Это безразмерная величина, равная сумме относительных весов атомов, составляющих молекулу: M r = ∑ A r Пример № 2: Определите относительный молекулярный вес озона. Молекула озона содержит 3 атома кислорода. Следовательно: M r = 3 A r = 16 — 3 = 48 ( a. e. m )
Количество вещества
Определение Количество вещества — это физическая величина, представляющая собой число молекул (атомов) вещества. Количество вещества обозначается n («ню»). Единицей измерения является моль. Молекула — это количество вещества, которое содержит столько же молекул (атомов), сколько 12 граммов углерода. Количество вещества определяется по следующей формуле: n = N N A. N — число молекул (атомов) вещества, NA— число частиц в молекуле вещества (постоянная Авогадро). Единица измерения постоянной Авогадро — 1/моль или моль-1. В 1 моле содержится 6∙10 23 частиц вещества. Это число атомов в 1 моль (или 12 г) углерода. Пример № 3: В цилиндре содержится 3∙10 25 молекул газа. Определите количество вещества в цилиндре. n = N N A. = 3 — 10 25 6 — 10 2 3. = 0,5 ∙ 10 2 = 50 ( m o l )
Молярная масса
Определение Молекулярная масса — это масса молекулы вещества. Она выражается в виде M. Единицей измерения является килограмм на молекулу (кг/моль, но можно использовать и грамм на молекулу!). Арифметически, молекулярная масса равна произведению относительной молекулярной массы на 10 — 3 (только для килограммов!): M = M r — 10 — 3 Пример № 4: Определите молекулярную массу озона. Относительная молярная масса озона составляет 48 а.е.м.. Следовательно: M = M r — 10 — 3 = 48 — 10 — 3 ( кг моль. .. )
Масса молекулы
Масса молекулы — это масса молекулы вещества, выраженная в килограммах (кг). Масса молекулы обозначается m0. Выраженное в числах, оно равно отношению между молекулярной массой вещества и числом частиц в молекуле (или отношению между массой вещества и числом частиц в нем): m 0 = M N A. = Отношение между числом молекул и постоянной Авогадро, следовательно, равно отношению между массой вещества и его молекулярной массой. Следовательно, количество вещества также можно определить по формуле n = m M. Пример №5. Определите массу молекулы озона. m 0 = M N A. = 48 6 — 10 23. = 8 — 10 — 23 ( k g )