Кристаллизация — это переход вещества из жидкого состояния в твердое путем образования кристаллической структуры. В природе все спонтанные превращения, кристаллизации и расплавы происходят потому, что новое состояние энергетически более стабильно в новых условиях и обладает меньшей энергией.
Проектная работа на тему: «кристаллы»
Большинство твердых веществ в окружающей нас среде — это вещества в кристаллическом состоянии.
Вы можете подумать, что кристалл — это редкий и красивый минерал или драгоценный камень. Отчасти вы правы. Изумруды и бриллианты — это кристаллы. Но не все кристаллы редки и красивы. Каждая крупинка соли или сахара — это тоже кристалл!
На уроке физики по теме «Концентрированные состояния вещества» я узнал, что кристаллы не только производятся в промышленности и быту, но и встречаются в природе. Например, снежинки, морозные узоры на оконных стеклах и иней, украшающий зимой голые ветви деревьев.
Многие кристаллы являются продуктами живых организмов. Некоторые виды моллюсков обладают способностью превращать инородные тела, застрявшие в их раковинах, в перламутр. Через 5-10 лет образуется жемчуг.
Кристаллы сделаны из бриллиантов, рубинов, сапфиров и других драгоценных камней. Кристаллы также могут быть изготовлены в лаборатории. Например, кристалл соли весом около 1 килограмма можно вырастить в лаборатории в течение одного дня. Эти эксперименты заставят вас задуматься о том, как получаются кристаллы и как они образуются, почему разные вещества имеют разную форму и почему некоторые кристаллы вообще не образуются, и что нужно делать, чтобы получить большие и красивые кристаллы. Я решил провести такой опыт — вырастить кристалл у себя дома.
Важность исследования заключается в том, что выращивание кристаллов — это увлекательное занятие, которое является самым простым, доступным и дешевым для большинства юных исследователей. Это объясняется интересом к образованию кристаллов различных форм и цветов в любое время года.
Цель проекта — изучить процесс роста кристаллов в природе, промышленности и в домашних условиях, а также научиться выращивать кристаллы соли, сахара и сульфата меди в домашних условиях.
Цель исследования:
— Узнайте о различных видах кристаллов и о том, как их выращивать,
— Узнать о значении кристаллов в жизни человека,
— Выберите доступное оборудование и сырье для выращивания кристаллов,
— Выращивание кристаллов соли, сахара и сульфата меди,
— Знать и применять необходимые меры безопасности и защиты при проведении экспериментов,
— изучить условия образования кристаллов, их форму и цвет,
— проанализировать полученные результаты.
Объект исследования :
— Соль и кристаллы соли,
— Сахар и сахарные кристаллы.
Объект исследования: Процесс кристаллизации.
Были использованы следующие методы исследования:
— Исследование (подбор материала в соответствии с темой проекта, использование научной литературы и интернет-источников),
— Анализ — обобщение результатов экспериментов.
Рост кристаллов — сложный технологический процесс, и чем дольше вы ждете, тем более впечатляющими будут результаты.
Практическая ценность исследования заключается в том, что его можно использовать на уроках физики, химии и географии, на внеклассных занятиях и в общественной жизни.
1 Теория кристаллов .
Кристалл — это твердое состояние вещества. Из-за расположения атомов он имеет определенную форму и определенное количество граней. Все кристаллы одного и того же вещества имеют одинаковую форму, даже если они отличаются по размеру.
В природе существуют сотни веществ, образующих кристаллы. Вода — один из самых распространенных из них. Вода при замерзании превращается в кристаллы льда или снежинки.
Наверняка вы замечали бесконечное разнообразие снежинок. В XVII веке знаменитый астроном Иоганн Кеплер написал трактат о шестиугольных снежинках, а три века спустя были изданы альбомы с коллекциями увеличенных фотографий тысяч снежинок, ни одна из которых не была идентична другой (рис. 1).
Рисунок 1 — Многообразие снежинок.
Кристаллы — это вещества, в которых мельчайшие частицы (атомы, ионы или молекулы) «упакованы» в определенном порядке. В результате по мере роста кристаллов на их поверхности спонтанно образуются плоские плоскости, а сами кристаллы приобретают разнообразные геометрические формы (рис. 2 и рис. 3):

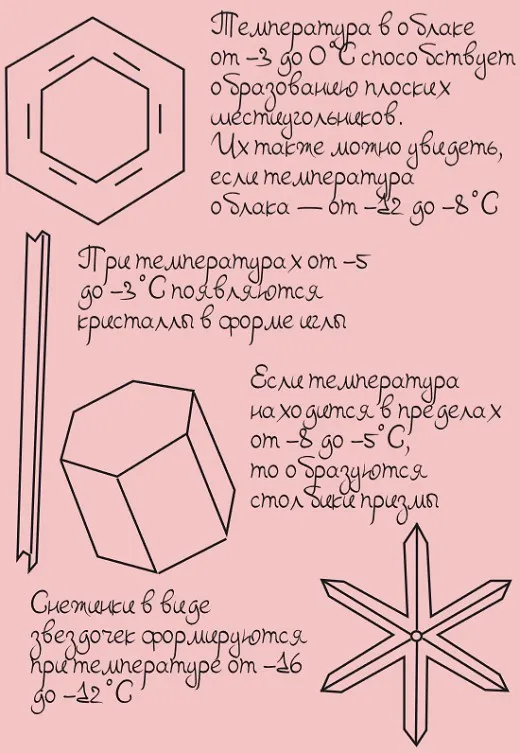
Рисунок 2 — Кристаллы пирита. Рисунок 3 — Кристаллы халькантита.
1.2 Формы кристаллов.
Кристаллы могут иметь самые разные формы. Все известные в мире кристаллы можно разделить на 32 типа, которые, в свою очередь, можно сгруппировать в шесть типов. Кристаллы могут иметь форму различных призм, основания которых могут быть правильными треугольниками, квадратами, параллелограммами и шестиугольниками (рис. 4).
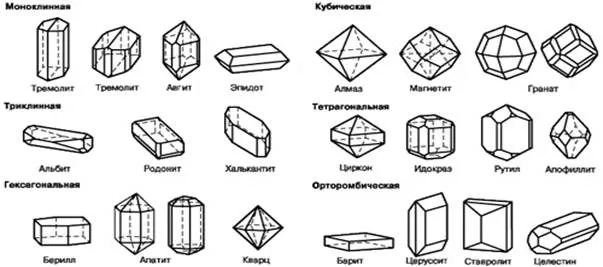
Рисунок 4 — Формы кристаллов.
Кристаллы могут иметь различные формы и размеры. Некоторые минералы образуют кристаллы, видимые только под микроскопом. Другие образуют кристаллы весом в несколько сотен килограммов.
Кристаллические минералы — это вещества, атомы которых регулярно расположены таким образом, что образуют регулярную трехмерную решетку, называемую кристаллической решеткой. Кристаллы ряда химических элементов и их соединений обладают замечательными механическими, электрическими, магнитными и оптическими свойствами.
Кристаллическая решетка металлов часто имеет форму гранецентрированного (медь, золото) или телоцентрированного куба (железо) или шестигранной призмы (цинк, магний). Вот несколько примеров кристаллической решетки:

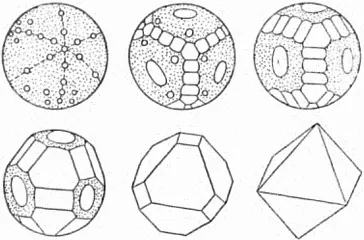
Рисунок 5 — Золотое (Au) тело Рисунок 7 — Железное (Fe) тело.
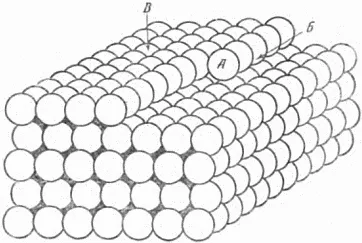

Рисунок 6 — Кристаллическая решетка меди (Cu) Рисунок 8 — Хлорид натрия (NaCl).
2 Образование кристаллов .
Огромные объемы горячей и расплавленной породы глубоко под землей на самом деле являются минеральными растворами. Когда эти жидкие или расплавленные горные массы выталкиваются на поверхность, они начинают остывать. Они остывают очень медленно. Минералы превращаются в кристаллы, когда они переходят из горячей жидкости в холодное твердое тело. Например, гранит содержит кристаллы таких минералов, как кварц, полевой шпат и слюда.
Селенит — это разновидность гипса, имеющая характерную параллельную волокнистую структуру. Своим названием селенит обязан красивому желтовато-серебристому свечению луны на его поверхности.
Кристаллизоваться может не только водяной пар, но и пары других веществ. Например: фумаролы образуют кристаллы газа.
Перекристаллизация связана с явлением метосаморфоза — превращением породы или минерала в другую породу или минерал в результате притока или оттока вещества. Перекристаллизация — это процесс, при котором структура определенных веществ разрушается и образуются новые кристаллы с другой структурой. Например, известняк превращается в мрамор под воздействием высоких температур и давления.
Почему у каждого кристалла своя форма?
Все кристаллы растут, но каждый кристалл растет со своей скоростью и в определенном направлении. По мере роста кристалла на его поверхности спонтанно образуются плоские поверхности, а сам кристалл приобретает геометрическую форму. Это означает, что грани кристалла растут в строго определенном направлении. Ученые неоднократно проверяли этот факт в ходе следующего эксперимента. Они срезали все углы типичного геометрического кристалла в виде сферы и поместили его в раствор или расплав того же вещества.
Через некоторое время на поверхности сферы начали образовываться ровные квадратные грани кристаллов. По мере того как граней становилось все больше и больше, они постепенно образовали неправильный многогранник. Чаще всего кристаллы вынуждены принимать такую форму. Это происходит потому, что некоторые лица растут быстрее других, мешая им свободно расти.

Правильный многогранник может образоваться только в том случае, если ничто не препятствует его росту. Когда кристалл сталкивается с другим кристаллом, он больше не может расти в направлении этого кристалла и поэтому меняет свое направление. В результате этого роста образуются полиэдры различной формы.
Как образуются кристаллы?
Внутри земли находится магма, которая медленно остывает и затвердевает, образуя кристаллы различных минералов с различной кристаллической структурой. Почему это так? Вы уже знаете, что у каждого вещества есть своя температура плавления, кристаллизации или застывания. По этой причине все вещества в магме застывают одно за другим, в зависимости от температуры, при которой они могут стать кристаллическими. Большинство этих кристаллов являются драгоценными камнями.

Кристаллы также могут образовываться из водяного пара. Например, пар, выдыхаемый из твердых ледников, превращается в маленькие белые хлопья. Во время первых осенних заморозков трава и ветви покалеченных кустарников могут быть покрыты удивительными кристаллами инея, которые исчезают при повышении температуры.
Испарение из раствора — еще один способ образования кристаллов. Например, когда вода испаряется из насыщенного раствора соли, кристаллы соли остаются на дне емкости. Подобные процессы происходят и в природе. Под жарким летним солнцем вода в морях и соленых озерах начинает испаряться. Кристаллы соли сначала плавают на поверхности воды, а затем опускаются на дно.
Так образуются природные соляные залежи.
В чем секрет уникальности кристаллов?
Уникальность кристаллов заключается в их особой форме и гранях, которые они образуют. Если вы внимательно посмотрите на кристаллы соли и сахара, вы сможете увидеть разницу даже без микроскопа.
Все кристаллические решетки имеют различные геометрические формы: Треугольники, прямоугольники, квадраты, ромбы и т.д., форма зависит от типа молекул и атомов рассматриваемого вещества.
ЗАБУДЬ! Процесс образования кристаллов называется кристаллизацией. В природе кристаллы часто образуются, когда жидкость охлаждается, а затем застывает: определенные молекулы жидкости соединяются в особую решетку, которая повторяется несколько раз.
Рост кристаллов
| Тема: | Биология и естественные науки |
| Посмотреть ниже | Биология и естественные науки (Биология и естественные науки) |
| Язык | Русский |
| Дата добавления | 05.04.2012 |
| Размер файла | 29,9 K |
Студенты, аспиранты и молодые ученые, которые используют базу знаний для своей учебы и работы, будут очень благодарны.
Опубликовано на http://www.allbest.ru/
Об отрасли «Концепции современного естествознания».
Студент первого курса
Дашко Мария Дмитриевна
Кристалл природы геологический
-
Введение
- 1Что такое кристаллы?
- 2.Образование кристаллов в природе
- 3.Причины и условия образования кристаллов4.Рост кристаллов5.Дефекты в кристаллахВыводы
- Ссылки
Введение
Кристаллы — одни из самых красивых и загадочных творений природы.
В древние времена кристаллы считались редкостью.
На самом деле, возникновение крупных однородных кристаллов в природе — редкое явление. Однако мелкие кристаллы встречаются очень часто. Например, почти все горные породы — гранит, песчаник, известняк — являются кристаллическими.
С совершенствованием методов исследования вещества, которые раньше считались аморфными, оказались кристаллическими. Теперь мы знаем, что даже некоторые части тела являются кристаллическими, например, роговица.
Кристаллы сегодня очень распространены в науке и технике благодаря своим особым свойствам. Такие области применения кристаллов, как полупроводники, сверхпроводники, пьезоэлектрики, сегнетоэлектрики, квантовая электроника и многие другие, требуют глубокого понимания зависимости физических свойств кристаллов от их химического состава и структуры.
В настоящее время известны методы искусственного выращивания кристаллов. Кристалл может быть выращен в обычной мензурке и требует только специального раствора и ухода за растущим кристаллом.
1. что такое кристалл?
Кристаллы обычно определяются как твердые тела, образованные в природе или в лаборатории, которые имеют многогранную форму, напоминающую строгие геометрические структуры. Поверхность этих фигур ограничена более или менее совершенными плоскостями, т.е. гранями, которые пересекаются по прямым линиям, т.е. ребрам. Пересечения ребер являются вершинами.
Это определение требует значительной коррекции. Возьмем, к примеру, хорошо известную горную породу, состоящую из зерен полевого шпата, слюды и кварца. Все эти зерна являются кристаллами, но их скрученные зерна не сохранили прежней прямой и плоской формы и поэтому не подходят под приведенное выше описание. Одновременный рост всех компонентов кристаллов, которые влияют друг на друга, привел к тому, что отдельные кристаллы не смогли принять характерную правильную многогранную форму.
Поэтому для образования правильно ограненных кристаллов необходимо, чтобы ничто не препятствовало свободному росту кристаллов, не сжимало их и не мешало их росту.
Кристаллы встречаются в природе в большом разнообразии, и существует столько же различных форм кристаллов. На самом деле, практически невозможно дать определение, подходящее для всех кристаллов. Именно здесь могут помочь результаты рентгеновского анализа кристаллов. Рентгеновское излучение позволяет обнаружить атомы внутри кристаллического тела и определить их пространственное положение. Установлено, что почти все кристаллы структурированы элементарными частицами, которые расположены в строгом порядке внутри кристаллического тела, т.е. ряд одинаковых атомов располагается в своеобразных узлах пространственной решетки. Регулярное расположение частиц отличает кристаллическое состояние от некристаллического, в котором степень регулярности частиц незначительна.
59 Как растут барханы в пустыне, или Про зыбучие пески
59 Как вырастить бочки в пустыне или в зыбучих песках Для эксперимента нам понадобится: несколько различных сухих сыпучих продуктов — манная крупа, соль, сахар, гречка, растворимый кофе. Не у всех есть возможность побывать в настоящей пустыне. Но все знают, что в песчаной пустыне дует ветер.
Кристаллы Многие люди думают о кристаллах как о красивых, редких камнях. Они бывают разных цветов, обычно прозрачные и, что самое красивое, имеют красивую правильную форму. Большинство кристаллов представляют собой многогранники, стороны (грани) которых являются
7- Перидот
Этот драгоценный камень, также называемый оливином, образуется в результате кристаллизации железа и магния. Она имеет зеленоватый цвет и обычно ромбовидную форму.
Силикаты — это материалы, образующиеся в результате кристаллизации кремния и других элементов (железа, алюминия, кальция, магния). Они присутствуют во всех горных породах.

9- Соль
Соль является наиболее распространенным примером кристаллизации. Она может быть образована как естественным путем (в виде морской соли), так и искусственным (как в случае с поваренной солью).
Сахар — один из самых распространенных кристаллов после соли. Этот кристалл образуется в результате ряда сложных промышленных процессов, в ходе которых сок сахарного тростника извлекается и подвергается искусственному процессу кристаллизации…..

11- Лед
Лед — это кристаллическое молекулярное твердое вещество, образующееся в результате процесса кристаллизации, аналогичного образованию снежинок.
Процесс образования льда может быть естественным (в районах с температурой ниже 0 °C) или искусственным (например, в морозильных камерах).

Возможные способы роста и образования
- Кристаллизация путем возгонки. Подобный метод кристаллизации подразумевает переход вещества из газообразного состояния к твердому, минуя жидкую фазу. Подобный процесс в природе имеет место в вулканических трещинах или кратерах, когда вещество быстро остывает. Однако простейший пример – образование зимой снежинок из воды.

Водяной кристалл — снежинка
- Первый – переход вещества из аморфного твердого тела в кристаллическое. Так, например, происходит кристаллизация стекла, в том числе кристаллизация вулканических пород, содержащих стекло.
- Второй – перекристаллизация вещества с разрушением старой структуры и образованием новой. Большинство горных пород образуются именно таким способом. Известные примеры перекристаллизации: переход известняка в мрамор, кварцевых песчаников в кварциты или глинистых пород в филлиты.

Рубин (корунд) монокристалл
Другие факты
- Имеет место такое явление как прорастание кристаллов. Это означает процесс, когда индивиды взаимно пересекаются и прорастают друг друга.
- Существуют так называемые ионные кристаллы, которые состоят в основном из ионов, связь которых образуется за счет электростатического притяжения. К таким телам относят фторид калия и натрия, хлорид и бромид калия и др.
- Существует 47 простых форм, из которых может состоять кристалл. Среди них: призма, пирамида, тетраедр, трапецоедр, ромбоедр и т.п.

Формы кристаллов
Динамика
Как уже упоминалось, кристалл формируется в соответствии с точно определенным рисунком или структурой, которая определяется силами, действующими на молекулярном уровне. Следовательно, в процессе формирования кристалл находится в среде, в которой концентрация растворителя достигает определенного критического значения, прежде чем состояние изменится. Образование твердого тела, которое невозможно ниже предела растворимости при данных условиях температуры и давления, может происходить при концентрации, превышающей теоретический уровень растворимости. Разница между фактическим значением концентрации растворенного вещества на границе кристаллизации и теоретическим (статическим) пределом растворимости называется пересыщением и является основным фактором кристаллизации.
Зарождение ядра
Осаждение — это начало фазового перехода в небольшой области, например, образование твердого кристалла из жидкого раствора. Это результат быстрых локальных флуктуаций на молекулярном уровне в однородной фазе, находящейся в метастабильном состоянии равновесия. Полная нуклеация — это объединенный результат двух категорий нуклеации, первичной и вторичной.
Первичное зародышеобразование
Первичное зарождение — это начальное образование кристалла, когда нет других кристаллов или когда, если кристаллы присутствуют в системе, они не оказывают влияния на процесс. Это может произойти при двух условиях. Первая — гомогенная нуклеация, т.е. нуклеация, на которую вообще не влияют твердые частицы. Эти твердые частицы включают стенки кристаллизационного сосуда и частицы посторонних веществ. Вторая категория — гетерогенная нуклеация. Это происходит, когда твердые частицы инородного вещества вызывают увеличение скорости зарождения, которое не наблюдалось бы без этих инородных частиц. Гомогенное зарождение редко встречается на практике, поскольку для зарождения требуется высокая энергия без твердой поверхности, катализирующей зарождение.
Первичное зарождение (гомогенное и гетерогенное) моделировалось следующим образом:
B — количество ядер, образующихся в единице объема в единицу времени; N — количество ядер в единице объема; kn — константа скорости; c — мгновенная концентрация растворителя; c — концентрация растворителя при насыщении, (c — c), также известная как пересыщение; n — эмпирическая экспонента, которая может быть до 10, но обычно составляет от 3 до 4.
Вторичное зародышеобразование
Вторичная нуклеация — это образование ядер, связанных с действием существующих микроскопических кристаллов в магме. Проще говоря, вторичная нуклеация — это когда рост кристаллов запускается при контакте с другими существующими кристаллами или путем «эмболизации». Первый тип известной вторичной нуклеации вызывается сдвигом жидкости, а второй — столкновениями существующих кристаллов с твердой поверхностью кристаллизатора или с самими другими кристаллами. Зарождение жидкости при сдвиге происходит, когда жидкость движется по кристаллу с высокой скоростью, увлекая за собой ядра, которые в противном случае были бы встроены в кристалл, так что увлеченные ядра превращаются в новые кристаллы. Контактная нуклеация оказалась наиболее эффективным и распространенным методом нуклеации. Преимущества заключаются в следующем:
Основные процессы кристаллизации
Некоторые из наиболее важных факторов, влияющих на растворимость:
- Концентрация
- Температура
- Состав смеси растворителей
- Полярность
- Ионная сила
Поэтому можно выделить два основных семейства процессов кристаллизации:
- Кристаллизация при охлаждении
- Испарительная кристаллизация
Это различие не совсем четкое, поскольку существуют гибридные системы, в которых охлаждение достигается за счет испарения, что одновременно концентрирует раствор.
Процесс кристаллизации, часто упоминаемый в химической инженерии, — это фракционная кристаллизация. Это не другой процесс, а конкретное применение одного (или обоих) из вышеперечисленных процессов.
Кристаллизация при охлаждении
Применение
Большинство химических соединений, растворяющихся в большинстве растворителей, обладают так называемой мгновенной растворимостью, т.е. предел растворимости увеличивается с повышением температуры.
Таким образом, при благоприятных условиях образование кристаллов происходит при простом охлаждении раствора. Охлаждение здесь — понятие относительное: кристаллы аустенита в стали образуются при температуре намного выше 1000 °C. Примером такого процесса кристаллизации является производство глауберовой соли — кристаллической формы сульфата натрия. Из диаграммы, на которой по оси x показана равновесная температура, а по оси y — равновесная концентрация (в массовых процентах растворенного вещества в насыщенном растворе), видно, что растворимость сульфата быстро уменьшается ниже 32,5 °C. Растворимость сульфата натрия быстро уменьшается ниже 32,5 °C. Если насыщенный раствор взять при 30°C и охладить до 0°C (это возможно из-за понижения точки замерзания), выпадает масса сульфата, что соответствует изменению растворимости с 29% (равновесное значение при 30°C) до примерно 4,5% (при 0°C) — фактически выпадает большая кристаллическая масса, поскольку сульфат связывает гидратацию воды, что имеет побочный эффект увеличения конечной концентрации.
Использование холодной кристаллизации связано с определенными ограничениями:
- Многие растворенные вещества осаждаются в гидратной форме при низких температурах: в предыдущем примере это приемлемо и даже полезно, но может быть вредным, когда, например,, масса воды гидратации для достижения стабильной формы кристаллизации гидрата больше, чем доступная вода: будет образован единый блок растворенного гидрата — это происходит в случае хлорида кальция );
- Будет иметь место максимальное перенасыщение в самых холодных точках. Это могут быть трубки теплообменника, чувствительные к образованию накипи, и теплообмен может быть значительно снижен или прекращен;
- Понижение температуры обычно означает увеличение вязкости решения. Слишком высокая вязкость может вызвать гидравлические проблемы, а создаваемый таким образом ламинарный поток может повлиять на динамику кристаллизации.
- Он не применим к соединениям, имеющим обратную растворимость, термин, обозначающий, что растворимость увеличивается с понижением температуры (пример имеет место с сульфатом натрия, где растворимость обратная выше 32,5 ° C).
Охлаждающие кристаллизаторы

См. Также
- Аномальный рост зерен
- Хиральное разрешение при кристаллизации
- Форма кристалла
- Кристаллическая структура
- Кристаллит
- Фракционная кристаллизация (химия)
- Магматическая дифференциация
- Рост пьедестала с лазерным нагревом
- Микроподтягивание вниз
- Кристаллизация белка
- Технология подачи льда с помощью насоса
- Квазикристалл
- Рекристаллизация (химия)
- Рекристаллизация (металлургия)
- Затравочный кристалл
- Монокристалл
- Симплектит
- Стеклование
- Рентгеновская кристаллография
- A. Mersmann, Справочник по технологии кристаллизации (2001) CRC; 2-е изд. ISBN0-8247-0528-9
- Tine Arkenbout-de Vroome, Технология кристаллизации из расплава (1995) CRC ISBN1 -56676-181-6
- «Кристаллизация малых молекул» (PDF ) на Иллинойсский технологический институт веб-сайт
- Glynn PD и Рирдон Э.Дж. (1990) «Равновесие твердого раствора водного раствора: термодинамическая теория и представление». Амер. J. Sci. 290, 164–201.
- Геанкоплис, К.Дж. (2003) «Процессы транспортировки и принципы процесса разделения». 4-е изд. Prentice-Hall Inc.
- С.Дж. Янчич, П.А.М. Grootscholten: «Промышленная кристаллизация», учебник, издательство Delft University Press и Reidel Publishing Company, Делфт, Нидерланды, 1984.