Накрыв кастрюлю крышкой, можно ускорить процесс нагрева и кипения воды, так как при этом в окружающую среду выделяется меньше тепла. Однако рекомендуется оставлять зазор, через который пар может выходить.
Фазовые переходы
Лед, вода и пар являются примерами трех состояний материи: твердого, жидкого и газообразного. В каком агрегатном состоянии находится вещество, зависит от температуры и других внешних условий, в которых оно находится.
При изменении внешних условий (например, при увеличении или уменьшении внутренней энергии тела вследствие нагревания или охлаждения) могут происходить фазовые переходы — изменения в агрегатном состоянии вещества тела. Нас будут интересовать следующие фазовые переходы.
— Плавление (твердое тело-жидкость) и кристаллизация (жидкость-твердое тело). — Испарение (жидкость-пар) и конденсация (жидкость-пар).
Плавление и кристаллизация
Большинство твердых веществ являются кристаллическими, то есть имеют кристаллическую решетку — строго определенное периодическое расположение частиц.
Частицы (атомы или молекулы) кристаллических твердых тел вибрируют в фиксированных положениях равновесия, т.е. в узлах кристаллической решетки.
Например, узлы кристаллической решетки поваренной соли являются угловыми точками кубических ячеек «трехмерной клеточной бумаги» (см. рис.). Рисунок 1, где большие сферы представляют собой атомы хлора (изображение с сайта en.wikipedia.org)); когда воде дают испариться из раствора соли, после нее остается кучка маленьких кубиков.
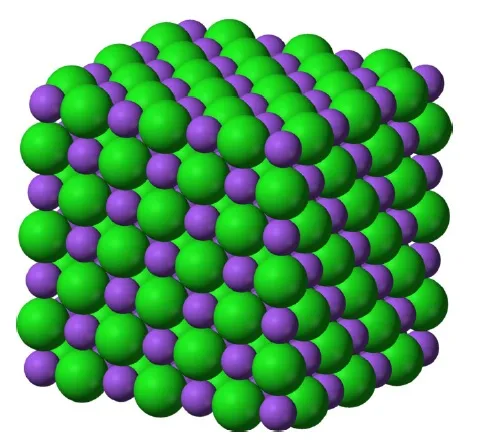
Рисунок 1. Кристаллическая решетка
Плавление — это превращение кристаллического твердого тела в жидкость. Любое тело можно расплавить, нагрев его до температуры плавления, которая зависит только от вещества тела, а не от его формы или размера. Температуру плавления того или иного вещества можно найти в таблицах.
С другой стороны, если жидкость охладить, то рано или поздно она превращается в твердое тело. Превращение жидкости в кристаллическое твердое вещество называется кристаллизацией или затвердеванием. Поэтому плавление и кристаллизация являются взаимными процессами.
Температура, при которой жидкость кристаллизуется, называется температурой кристаллизации. Оказывается, температура кристаллизации совпадает с температурой плавления: оба процесса могут происходить при этой температуре. Например, лед тает, а вода кристаллизуется; то, что происходит в каждом случае, зависит от внешних условий (например, от того, добавляется ли тепло к веществу или отводится от него).
Как происходит плавление и кристаллизация? Каков их механизм? Чтобы понять природу этих процессов, рассмотрим графики зависимости температуры тела от времени при нагревании и охлаждении — так называемые диаграммы плавления и кристаллизации.
График плавления
Начнем с диаграммы плавления (рис. 2). Предположим, что в начальный момент времени (точка на диаграмме) тело является кристаллическим и имеет определенную температуру.
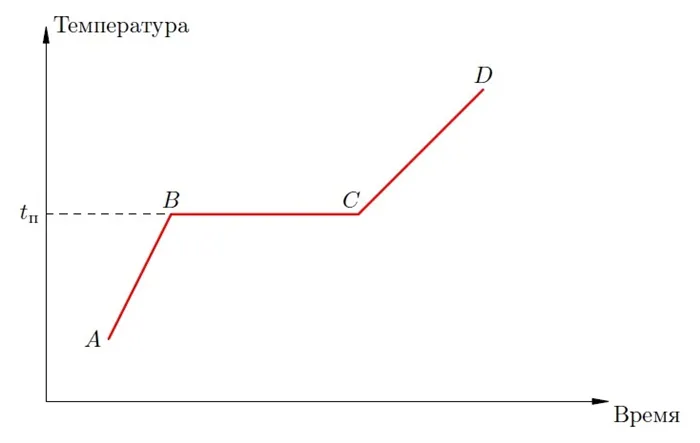
Рисунок 2. Диаграмма плавления
Затем к телу подводится тепло (например, тело помещается в плавильную печь), и температура тела повышается до значения — температуры плавления рассматриваемого вещества. Это график диаграммы.
В этот момент тело получает количество тепла
где — удельная теплоемкость твердого тела, — масса тела.
При достижении точки плавления (при ) ситуация качественно меняется. Хотя тепло продолжает поступать, температура тела остается неизменной. При температуре плавления тело постепенно переходит из твердого состояния в жидкое. В пределах диапазона существует смесь твердого и жидкого, и чем ближе к точке, тем меньше остается твердого и больше появляется жидкого. В этот момент от первоначального твердого тела ничего не остается: оно полностью превратилось в жидкость.
Эта точка соответствует дальнейшему нагреванию жидкости (или, как говорят, расплава). В этот момент жидкость поглощает определенное количество тепла
где — удельная теплоемкость жидкости.
Но сейчас нас больше всего интересует часть фазового перехода. Почему температура смеси не меняется в этот момент? Тепло обеспечено!
Давайте вернемся к началу процесса нагревания. Повышение температуры твердого тела на этой стадии является результатом увеличения интенсивности колебаний его частиц в узлах кристаллической решетки: подводимое тепло используется для увеличения кинетической энергии частиц тела (на самом деле, часть подводимого тепла используется для увеличения среднего расстояния между частицами — как мы знаем, тела расширяются при нагревании. Однако эта часть настолько мала, что ею можно пренебречь).
Кристаллическая решетка расслабляется все больше и больше, и в точке плавления колебательная дисперсия достигает предела, при котором силы притяжения между частицами еще способны поддерживать их упорядоченное расположение друг к другу. Твердое тело начинает «лопаться по швам», а нагрев продолжает разрушать кристаллическую решетку, после чего в области начинается плавление.
С этого момента все подводимое тепло используется для разрыва связей, удерживающих частицы в узлах кристаллической решетки, т.е. для увеличения потенциальной энергии частиц. Кинетическая энергия частиц остается неизменной, поэтому температура тела не меняется. В тот момент, когда кристаллическая структура полностью исчезает, разрушать уже нечего, и полученное тепло возвращается для увеличения кинетической энергии частиц — для нагрева расплава.
Кипение

Из уроков физики в 8 классе мы знаем, что при нормальных условиях вещества могут принимать три агрегатных состояния: твердое, жидкое и газообразное. Когда переход из жидкого состояния в газообразное происходит во всем объеме жидкости, этот переход называется кипением. Давайте рассмотрим эту тему более подробно и углубимся в механизм этого физического явления и его особенности.
Кипение жидкости
Основное различие между состояниями молекул в жидкостях и газах заключается в их различной кинетической энергии. Молекулы жидкости движутся с относительно низкой скоростью и расположены близко друг к другу. Молекулы газа движутся гораздо быстрее и находятся на больших расстояниях. Поэтому молекулы должны получить дополнительную тепловую энергию, чтобы перейти в газообразное состояние.
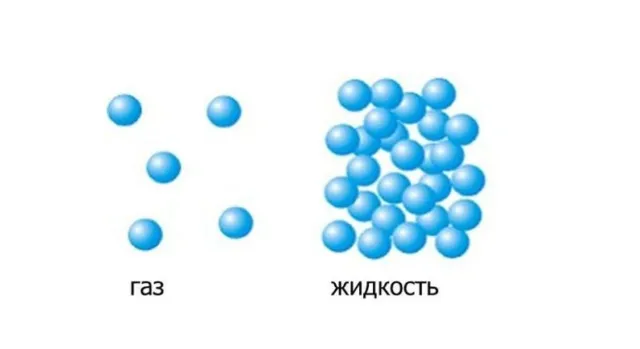
Чем выше температура жидкости, тем больше количество молекул, скорость которых достаточно высока, чтобы удаляться от других молекул и двигаться в сторону газа. При определенной температуре этих «быстрых» молекул становится так много, что они сближаются все больше и больше, и тогда энергии достаточно для образования пузырька насыщенного пара в слое жидкости. Пузырек становится «центром испарения».
По мере повышения температуры жидкости образуется все больше и больше пузырьков насыщенного пара, и при определенной температуре весь объем жидкости заполняется ими. По мере повышения температуры жидкости образуется все больше и больше пузырьков насыщенного пара, и при определенной температуре весь объем жидкости заполняется такими пузырьками.
Переход жидкости в пар, происходящий одновременно во всем объеме жидкости, называется кипением.

Свойства кипения
Таким образом, процесс кипения начинается, когда давление насыщенных паров становится равным давлению внутри жидкости. Из формулы уравнения Менделеева-Клапейрона следует, что это давление увеличивается с ростом температуры. Если внешнее давление увеличивается, давление насыщенного пара возрастает, так что процесс кипения прекращается. И наоборот, если внешнее давление уменьшается, жидкость также можно довести до кипения без добавления дополнительного тепла.
Другая особенность этого явления заключается в том, что оно возможно только тогда, когда температура жидкости достигает определенной точки, которая называется «точкой кипения». В этот момент температура воды больше не повышается, несмотря на ее нагрев. Это происходит потому, что все молекулы, получившие достаточно энергии, немедленно переходят в газ во всем объеме жидкости. В жидкости остаются только более медленные молекулы с более низкой температурой. Как только эти молекулы «нагреваются», они также покидают жидкость.
Оказывается, что в процессе кипения вся тепловая энергия, добавленная к жидкости, расходуется на образование пара, а не на нагрев жидкости. Для образования каждого килограмма пара требуется определенное количество тепловой энергии, и эта энергия называется удельной теплотой кипения или испарения. Для его определения используются справочные таблицы. Температура пара равна температуре жидкости (для воды при нормальных условиях это 100 °C).
Поэтому невозможно довести воду до кипения, нагревая ее «на водяной бане». Температура в кипящей водяной бане равна 100 °C и совпадает с температурой нагреваемой воды. Дополнительный ввод тепла в нагреваемую жидкость прекращается. А кипячение требует дополнительного нагрева. Поэтому нагревание на водяной бане используется в тех случаях, когда необходимо максимально приблизить жидкость к точке кипения, но не кипятить ее.

Фазы кипения
Самый простой пример кипячения — постепенное нагревание кастрюли с водой на плите. Вскоре вы заметите, что на поверхность поднимается множество мелких пузырьков. Они состоят из воздуха и газов, которые присутствуют в воде. Когда кастрюля накрыта крышкой, в ней образуется пар. Это означает, что жидкость нагревается — первая фаза (60-75℃).
Логично, что вода на дне кастрюли нагревается быстрее, поскольку она находится ближе к источнику тепла. Наступает функция конвекции: Нагретая жидкость поднимается вверх, а более холодная жидкость опускается вниз. Это перемешивает воду.
Интересно: Почему чайник издает звуки, прежде чем закипеть? Почему чайник издает звуки, когда закипает?
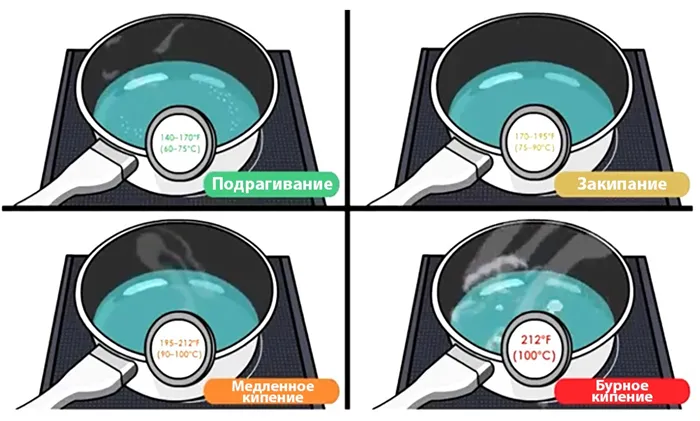
Затем нижний слой жидкости начинает медленно испаряться — вторая фаза (75-90℃). Этот процесс сопровождается характерными шумами, такими как гудение, прерывистое жужжание и т.д. Это звук пузырьков в водной массе, которые уже стали намного больше. Когда они поднимаются со дна кастрюли, они вступают в контакт с холодной водой, и пар в пузырьке конденсируется.
Если подача тепла не прерывается, вся вода имеет примерно одинаковую температуру, и начинается третья фаза. Теперь пузырьки больше не конденсируются и могут беспрепятственно достигать поверхности и взрываться там. До этого момента рев воды усиливается, а затем становится тише. Только теперь жидкость можно назвать кипящей (100℃).
Интересно, что в отечественных условиях достичь следующей фазы не удается. Температура кипения достигается, и вода просто испаряется. Но в лаборатории, например, можно еще больше повысить температуру с помощью горелки. Таким образом, количество пузырьков становится настолько большим, что они все вместе образуют столб пара.
В этом случае говорят о кипении пузырьков. Последующий нагрев вызывает переходное явление. Интересно, что чем больше повышается температура, тем медленнее происходит передача тепла воде. Это происходит потому, что на дне кастрюли образуется слой водяного пара, который медленнее передает тепло.
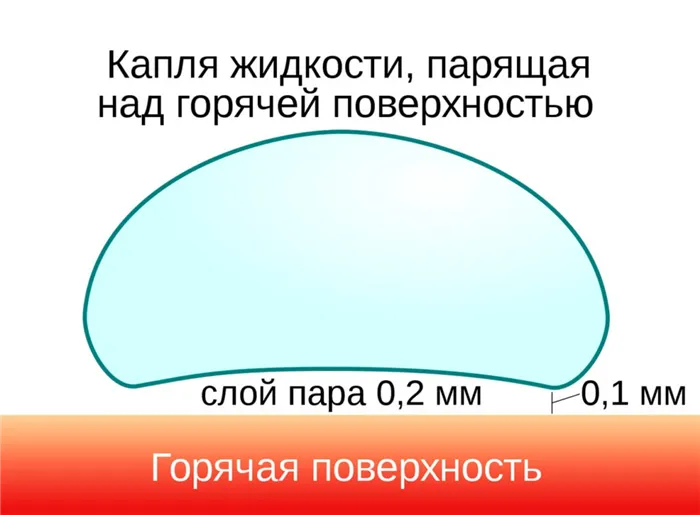
Постепенно она становится твердой. Это запускает фазу кипения пленки — вода над слоем пара поглощает тепло очень медленно. Типичный пример этого явления — капля воды, налитая на очень хорошо разогретую сковороду. Когда температура в кастрюле превышает точку кипения воды, капля не испаряется сразу, а формируется в шар и может сохраняться около минуты.
Интересно: Почему загрязнения в чашке собираются в верхней части жидкости?
Это явление было описано в 1756 году немецким ученым Иоганном Готлобом Лейденфростом, отсюда и название — эффект Лейденфроста, который сегодня известен как эффект Лейденфроста. Секрет этих капель на сковороде довольно прост. Когда нижняя часть капли попадает на нагретую поверхность, она немедленно испаряется и образует слой пара, который изолирует остальную жидкость на короткое время.
Почему в кипящей воде образуются пузыри?
Что вызывает образование пузырьков в кипящей воде? Контейнер имеет мелкие трещины и полости. Они служат центрами для образования пара. В этих аномальных точках водородные связи между молекулами разрываются.
Интересный факт: в отличие от воды, молоко начинает сильно «течь» при кипячении. Это происходит потому, что он содержит длинные полимерные молекулы, которые слипаются и образуют пленку на поверхности. Тем временем пузырьки, образовавшиеся в процессе кипения, поднимаются к верху, но не лопаются из-за пленки и скапливаются.

Определенное количество пара выходит наружу. Пузырь постепенно расширяется и отрывается от поверхности, но на его месте образуется новый. Если поверхность сосуда очень гладкая, воду можно нагреть до 100 ℃, но она никогда не достигнет точки кипения. Такая жидкость называется перегретой. Он может закипеть сразу же при нажатии на загрязнения или кипятильник.
Пузырьки в кипящей воде — это воздух, который в ней растворился. Его молекулы собираются в паровых центрах, т.е. микротрещинах на дне сосуда. Пузырьки постепенно увеличиваются в размерах, отделяются от дна и лопаются на поверхности, после чего образуются новые пузырьки.
Если вы видите ошибку, выделите текст и нажмите Ctrl+Enter .