Область физической химии, изучающая структуру вещества в явлениях, в которых происходит выделение или обмен тепла путем преобразования внутренней энергии растворов в тепло, называется химической термодинамикой.
Закон Гесса
В изобарических и изохорических условиях теплота является функцией состояния.
В 1840 году Х. Н. Гесс сформулировал закон: «Тепловой эффект химической реакции не зависит от промежуточных стадий, а только от начального и конечного состояний системы».
Современная формулировка закона Гесса гласит, что увеличение общей энергии при переходе от исходных веществ к продуктам реакции не зависит от промежуточных стадий, через которые прошла реакция.
Закон Гесса можно использовать только для расчета тепловых эффектов или прироста энтальпии при нормальных условиях (p = 1 атм = 10 5 Па, T = 273 K + 25 = 298 K).
Значения нагрева при нормальных условиях сведены в таблицу (руководство, опубликованное Нищенко). Для индивидуальных веществ: C, H2, Fe и т.д. — ? Н = 0.
Действие закона Гесса:
1) Энтальпия образования 1 моль соединения простых веществ не зависит от способа приготовления,
(2) Тепловые величины — «теплота реакции равна сумме теплот сгорания исходных материалов минус теплота сгорания продуктов реакции с учетом стехиометрических коэффициентов».

(3) Теплота образования — «теплота реакции равна разности между теплотой образования всех веществ, перечисленных в правой части уравнения (продукт реакции), и теплотой образования всех веществ, перечисленных в левой части уравнения».
где f — образование.
Пример 1. Рассчитайте тепловой результат реакции этерификации спирта.
Пример 2. Рассчитайте тепловой эффект реакции, протекающей согласно уравнению:
Данный текст является вводным.
Продолжить чтение на ЛитРес
Читайте также
Является ли красота законом природы? Теория суперструн дает нам убедительную формулировку теории Вселенной, но она не решает фундаментальную проблему: экспериментальная проверка теории невозможна при нынешнем состоянии техники. Теория предполагает, что можно
Закон всемирного тяготения Я хотел бы еще раз подчеркнуть, что описанные законы сохранения — это не настоящие «законы», а всего лишь обобщения. Путем различных измерений ученым каждый раз удавалось убедить себя в том, что импульс, угловой момент, масса и
Закон инерции
Закон инерции Из принципа относительности движения следует, что тело, на которое не действует внешняя сила, может не только находиться в состоянии покоя, но и двигаться прямолинейно и равномерно. Это положение известно в физике как закон
7 Закон Генри Летучесть растворенного вещества в разбавленном растворе не зависит от природы растворенного вещества и рассчитывается по закону Рауля, т.е.: поскольку летучесть жидкого или твердого раствора равна летучести насыщенного пара, то растворенное вещество в
Закон Гесса
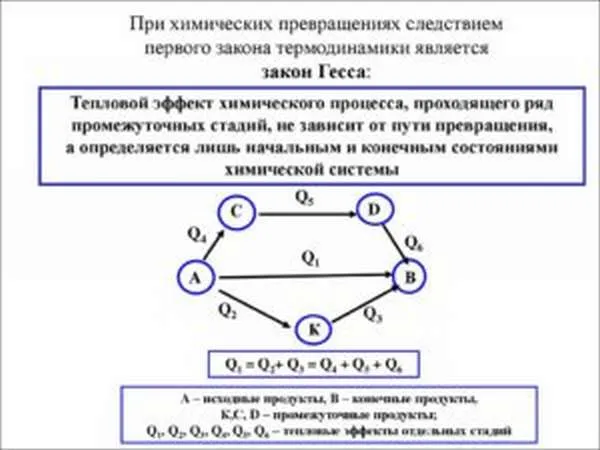
Закон Гесса является математическим следствием первого закона термодинамики, который формулируется следующим образом:
- Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания .
Другими словами, количество тепла, выделяемого или поглощаемого в процессе, всегда одинаково, независимо от того, происходит ли конкретное химическое превращение в один или несколько этапов (при условии, что температура, давление и суммарное состояние веществ одинаковы). Например, окисление глюкозы в организме происходит по очень сложному, многоступенчатому механизму, но суммарный тепловой эффект всех этапов этого процесса равен теплоте сгорания глюкозы.


На рисунке показано схематическое изображение обобщенного процесса химического преобразования исходных материалов A1, А2… к продуктам реакции B1, В2… который может осуществляться различными способами в один, два или три этапа, каждый из которых связан с тепловым эффектом ΔH.i. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон был открыт в 1840 году русским химиком Г. И. Гессом; он является частным случаем первого закона термодинамики, примененного к химическим реакциям. Практическое значение закона Гесса заключается в том, что он позволяет рассчитывать тепловые эффекты различных химических процессов; для этой цели часто используются некоторые его следствия.
Следствия из закона Гесса
- Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
- Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
^o )_ — \sum<(\nu>_i \Delta H_^o )_» width=»» height=»» />
- Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
^o )_ — \sum<(\nu>_i \Delta H_^o )_» width=»» height=»» />
Используя упорядоченные значения теплоты образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к экспериментам. Табличные значения теплоты образования и сгорания веществ обычно относятся к так называемым стандартным условиям. Другие законы термохимии, такие как закон Кирхгофа, который описывает зависимость теплоты реакции от температуры, также должны использоваться для расчета теплоты процесса, протекающего при различных условиях.
- Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Литература
- Карапетьянц М. Х. Введение в теорию химических процессов. — М.: Высшая школа, 1981. 304 с.
- Стромберг А. Г., Семченко Д. П. Физическая химия — М.: Высшая школа, 1999. 527 с.
- Даниэльс Ф., Олберти Р. Физическая химия — М.: Мир, 1978. 645 с.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур. — М.: Мир, 2002. 461 с.
- Борисов И. М. Основы электрохимии: учеб. пособие. -Уфа: Изд-во БГПУ, 2009.- 115 с.
- Химическая термодинамика
- Химические законы и уравнения
Фонд Викимедиа. 2010 .
Закон Гесса
Этот закон по праву считается самым важным законом в термохимии. Формулировка закона Гесса выглядит следующим образом:
Численные значения тепловых явлений в химических реакциях не зависят от того, как протекают сами процессы.
Основной закон термохимии гласит, что если существует множество различных способов осуществления одной и той же химической реакции, то тепловые процессы во всех случаях одинаковы.
Конечно, это верно только в том случае, если условия для всех реакций одинаковы — давление и температура одинаковы. Это научное утверждение интуитивно правдоподобно, но отнюдь не просто для понимания. Давайте проанализируем его формулировку.
Если процесс протекает в абсолютно одинаковых условиях, т.е. давление или температура постоянны, то тепловая энергия (производимая или потребляемая) одинакова, независимо от количества этапов реакции.
Важно. Один из самых простых примеров этого закона: переваривание сахара в человеческом организме. Переваривание глюкозы в нашем организме происходит в результате очень сложных органических реакций, разделенных на множество органических этапов. Однако энергия, выделяемая при распаде, в некотором смысле такая же, как и энергия, образующаяся при простом сжигании глюкозы.
Попробуем выразить закон Гесса в математической форме. Для этого представим себе реакцию между веществами A1, A2, A3 и т.д. Это может быть любое вещество — вода, углекислый газ, кислоты, щелочи и т.д. Сама реакция может быть любой — окисление, восстановление, дегидратация и т.д. Наша задача — получить вещества B1, B2 и т.д. из ряда веществ A1, A2 и т.д. Например, реакция окисления, где окислителем является ион водорода:
В этой реакции исходными веществами являются железо и соляная кислота примеры наших гипотетических A1, A2, а конечными веществами — хлорид железа и водород — примеры B1, B2.
Конечно, это не единственная реакция, в которой также можно получить водород. Его можно получить, например, с помощью меди:
Таким образом, мы видим, что существует множество различных способов получить B1, B2 из A1, A2. В ходе реакций выделяется определенное количество тепла, которое мы выражаем как .
Например, если реакция протекает простым, традиционным способом в один этап, выделяется тепло. Если реакцию можно провести и другим способом (за один шаг), то выделяется другое количество тепла, например, если реакция проводится за два шага, то сначала выделяется тепло, а затем, но сумма тепла составляет .
Исходя из этих обозначений, закон Гесса довольно легко представить в математической форме. Если в результате реакции выделяется энергия, но в разных путях тепловые эффекты, ,, , и ту же реакцию можно продолжить двумя другими путями с выделением эффектов, то формула закона Гесса имеет следующий вид:
Благодаря этому термохимическому утверждению можно вывести и численно рассчитать энергию термодинамических явлений, что крайне сложно и энергоемко экспериментальным путем. Другими словами: Если известно численное значение внутренней энергии в реакции, которая уже была продемонстрирована, можно рассчитать влияние тепла в более сложном процессе.
Следствия закона Гесса
Рассмотрим два следствия из закона термохимии.

Энтальпия — это энергия, доступная в теоретической, потенциальной форме для преобразования в тепло в изобарном процессе. Напомним, что изобарический процесс — это процесс при постоянном давлении.
Префик с-iso означает стабильность. Таким образом, изохорный и изотермический процессы означают постоянную температуру и постоянный объем соответственно.
Привести пример очень просто. Если цилиндр с газом находится под прессом, то энтальпия равна сумме потенциальной энергии пресса (mgh, где m — масса пресса, а h — высота, на которую он поднят) и энергии самого газа. Проще говоря, энтальпия — это энергия, которая могла бы выделиться и выделилась бы, если бы вы дали процессу протекать.
Пример: вы сидите под яблоней. Прямо над вашей головой висит яблоко. Теоретически, он может упасть. Если вы будете продолжать сидеть под яблоней, она так или иначе упадет и заденет его. Энтальпия в данном случае — это потенциальная энергия яблока. Энтальпия обозначается через ., если это энтальпия продуктов химической реакции (левая часть формулы). Если это энтальпия реактантов (правая часть), то она обозначается через. Буква n означает количество вещества, т.е. фактор, который обычно предшествует веществу в химической реакции. Например:
Суммы реакции
Диаграммы могут быть очень сложными для интерпретации, особенно когда необходимо рассмотреть множество реакций. По этой причине используется сумма реакций. Этот метод облегчает расчет энтальпий и ускоряет понимание закона Гесса.
Например, предположим, что мы хотим определить ΔHºrxn следующей реакции:
И у нас есть еще две реакции:
Интересно, что A + B + C находятся в левой части (реактивы), а ABC — в правой (продукты). Затем мы просто добавляем две последние реакции:
A + AV + C → AVS + AV
Поскольку AB находится по обе стороны, она исключается. Итак, мы имеем:
Добавление реакций устраняет необходимость в диаграмме.
Применение закона Гесса
Закон Гесса можно использовать для нахождения энтальпий для различных реакций или химических явлений без проведения экспериментов. Некоторые из них перечислены ниже:
-энтальпии образования нестабильных соединений или промежуточных продуктов, распространенных в органической химии.
-Энтальпии фазовых переходов в исследовании кристаллических твердых тел.
-Энтальпии аллотропных переходов, например, между графитом и алмазом.
Аналогично, закон Гесса используется для определения энергии решетки твердого тела и электронного сродства определенных атомов.
Упорядочивание уравнений
Сначала мы должны добавить такие реакции, чтобы HCl и F2находятся в левой части, а HF и Cl2с правой стороны. Прежде всего, отметим, что оба H2а также H2Или они не входят в уравнение интересов. Следовательно, мы должны сократить их вместе и получить согласование стехиометрических коэффициентов путем умножения:
2HCl (г) + 1 / 2O2(d) → H2O (l) + Cl2(г) (ΔH = -202,4 кДж/моль) * (1/2)
Это уравнение было умножено на 1/2, чтобы получить 2HCl вместо 4HCl.
ЧАС2(d) + F2(г) → 2HF (л) (ΔH = -600,0 кДж/моль) * (2)
Это уравнение было умножено на 2, чтобы получить F2вместо 1 / 2F2
Последнее с тех пор умножается н а-1, чтобы его можно было «перевернуть». Таким образом, уравнения сортируются и могут быть добавлены.
Характерные особенности закона Гесса

Этот раздел является основополагающим для всей термохимии. В химических реакциях численные значения тепловых явлений совершенно не зависят от лежащих в их основе процессов.
Важнейший закон термохимии гласит, что если имеется реальная возможность провести одну и ту же химическую реакцию разными способами, то возникающие при этом тепловые процессы во всех случаях одинаковы. Однако такой результат возможен только в том случае, если условия одинаковы для всех участвующих реакций. Несмотря на интуитивную очевидность этого научного утверждения, трудно понять все его нюансы. Поэтому необходимо изучить формулировку.
Производимая или используемая тепловая энергия оптимально эффективна только в том случае, если давление и температура остаются постоянными независимо от других условий реакции. Этот закон можно понять на элементарном примере переваривания сахара в человеческом организме. Для переработки глюкозы требуется несколько сложных органических реакций.
Человеческий организм переваривает сахар только после того, как этот компонент пройдет через несколько фаз распада. Однако при этом процессе высвобождается та же энергия, что и при сжигании глюкозы. Синтез АТФ (эндогенная реакция) происходит за счет энергии Гиббса, образующейся при окислении глюкозы (экзергетическая реакция).
Чтобы лучше понять все тонкости закона, необходимо представить его в математической форме. Сначала рассмотрим реакцию между веществами S1, S2, S3 (вода, кислота, углекислый газ). Реакция может быть любой: восстановление, окисление, дегидратация. Основная задача — получить компоненты T1, T2, T3 из веществ S1, S2, S3. Типичным примером является реакция окисления, где основным действующим веществом является водород: Fe + 2 HCL = FeCL 2 + H 2. Соляная кислота и железо представляют собой S1 и S2, упомянутые выше. Конечным веществом является водород и хлорид железа — пример T1, T2.
Базовые понятия из термохимии
Энергия, имеющаяся в потенциальной и теоретической форме для преобразования тепла в изобарном процессе, называется энтальпией. Следует также помнить, что изобарический процесс — это процесс, в котором значения давления не изменяются. В термохимии префикс «изо» используется для обозначения стабильности. Например: Изотермические и изохорические процессы обозначают стабильные температуры.
Чтобы научить студентов, эксперты всегда начинают с простой ситуации. В обычном цилиндре с газом при постоянном давлении энтальпия является суммой динамической энергии давления и собственной энергии газа. Именно энтальпия представляет собой энергию, которая высвобождается, как только топливо вытекает из бака.

Не менее интересный пример: человек сидит под грушевым деревом, над его головой висит спелый плод. Теоретически, он может упасть в любой момент. Если человек продолжает сидеть под деревом, рано или поздно груша упадет. Потенциальная энергия плода — это энтальпия, которая обычно обозначается формулой DH 0/ f. Для энтальпии продуктов химической реакции вступают в силу некоторые поправки — DH 0/ f prol.
Для определения реактивов эксперты придумали дополнительную формулу DH 0/ f реактивов. Чтобы указать точное количество вещества, необходимо использовать букву n — своего рода коэффициент, который необходимо перевести в химическую реакцию перед основным компонентом. Например: Fe +2 HCL = FeC L 2 + H₂. Следует отметить, что число n — это цифра «2» перед соляной кислотой.
Первое и второе следствие

Классический тепловой результат представляет собой сумму всех энтальпий продуктов этой реакции. Только сумма всех энтальпий исходных материалов включается в категорию исключения. Это следствие можно представить довольно просто в виде формулы: DH 0 x.p. = n продукт. * DH 0/ f продукт — n ex. * DH 0/ f реактивов. Это логическое следствие закона позволяет максимально быстро и правильно рассчитать тепловой эффект реакции.
Второе следствие используется только в контексте органических соединений. Если природные вещества используются в тепловых эффектах химических реакций, то конечным результатом является сумма энергии сгорания первичного компонента. Это утверждение не относится к энергии, получаемой при сгорании продуктов реакции. Согласно второму закону, специалисты разработали универсальную формулу для стандартных условий: ΔH 0 реактивный = Σ v k ΔH 0 об, k — Σ H V H ΔH 0 об, n .








