Существует два класса соединений с составом CnН2 nэто алкены и циклоалканы. Например, два соединения имеют формулу C3H6два соединения имеют формулу C:
Гомологический ряд алкенов
Ненасыщенные органические углеводородные соединения отличаются от насыщенных наличием многочисленных химических связей между атомами углерода в их молекулах. Ациклические ненасыщенные углеводороды образуют гомологический ряд, среди которых алкены, гомологи этилена, характеризуются простой молекулярной структурой. Они обладают комплексом свойств, выраженных серией характерных химических процессов.
Общая формула гомологического ряда углеводородов, относящихся к алкенам, имеет следующий вид.
Электронная конфигурация
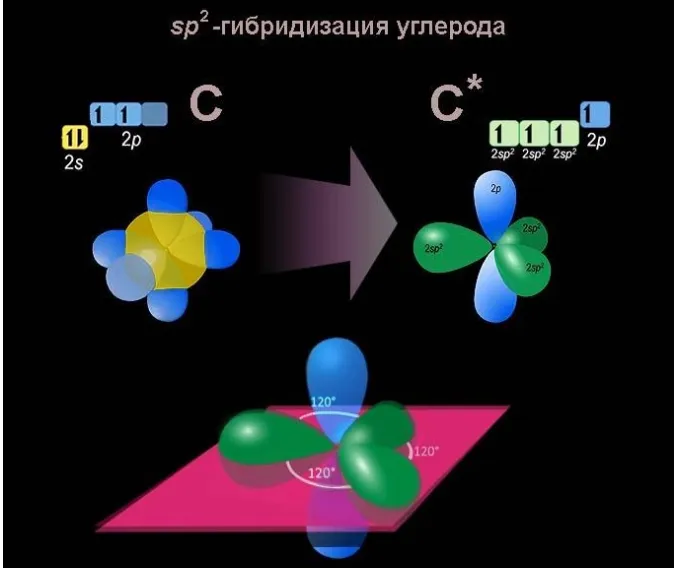
В основном состоянии электронные оболочки атома углерода имеют конформацию, поскольку возможен перенос 2s-электрона на свободный 2p-подуровень. В этом случае все четыре электрона внешнего уровня становятся валентными электронами.
Алкены характеризуются sp2 гибридизацией. Три гибридные орбитали, оси которых лежат в плоскости, разделены углом 120°, потому что отрицательно заряженные электроны отталкиваются друг от друга электростатически. Эта плоскость перпендикулярна негибридной p-орбитали.
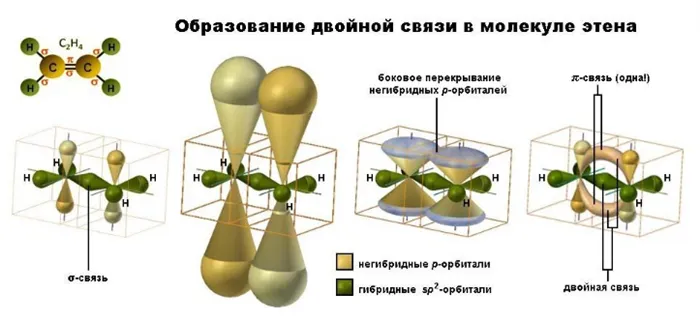
Двойная связь
Гибридные и негибридные орбитали участвуют во взаимодействии двух sp2 гибридизированных атомов углерода:
- По одной гибридной орбитали каждого атома, перекрываясь по линии оси, образуют σ-связь. Остальные гибридные орбитали вступают в σ-связь с атомами водорода.
- Негибридные орбитали путем бокового перекрывания образуют π-связь. Она располагается перпендикулярно плоскости гибридных орбиталей, вне оси, по которой расположены центры атомов и поэтому слабее σ-связи и легче поддается разрыву.
Структура этения, затем пропена и т.д. Двойная линия в структурных формулах указывает на кратную связь, образованную совместно σ- и π-связями: .
Изомерия и номенклатура углеводородов ряда алкенов
Все алкены, кроме самого простого из ряда, этилена, обладают свойством изомерии, т.е. при одинаковом атомном составе их молекулы могут иметь различное строение, что обуславливает различие в свойствах. В случае алкенов существует множество изомеров, поскольку наличие двойной связи допускает значительное число структурных вариаций. Бутен, например, уже имеет шесть изомеров. Количество изомеров увеличивается с ростом числа атомов углерода в цепи.
Структурная изомерия
Для алкенов характерны следующие изомеры:
- Изомерия углеродного скелета связана с ветвлением молекулы и начинается с бутена:
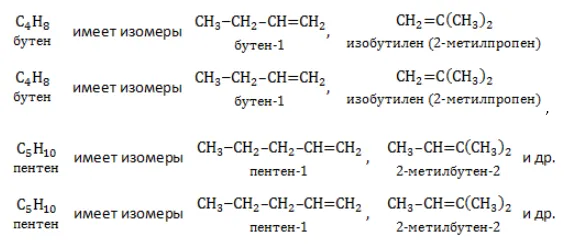
- Изомерия положения кратной (двойной) связи в молекуле также появляется у бутена:
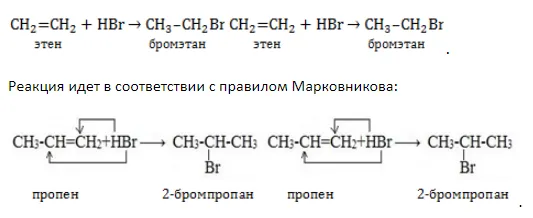
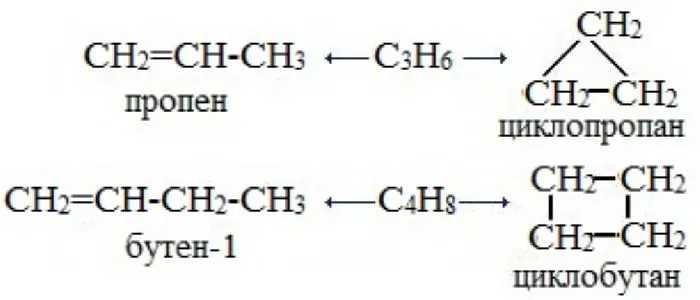
- Межклассовая изомерия у алкенов возникает с предельными циклическими углеводородами – циклоалканами. Она начинается с пропена, который изомерен циклопропану:
Бутен имеет следующие циклические изомеры:
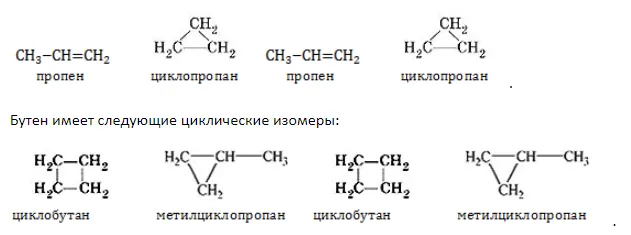
Далее по гомологическому ряду увеличивается структурное разнообразие молекул и число изомеров.
Пространственная изомерия
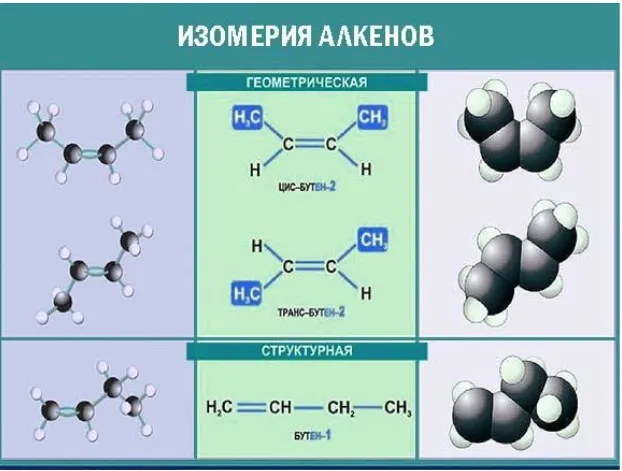
В алкенах наличие p-связи означает, что они не могут вращаться без разрыва двойной связи. Если атомы углерода, связанные через p-связь, имеют различные заместители, образуются геометрические изомеры, которые отличаются порядком расположения заместителей по отношению к p-связи.
В цис-изомерах (лат. cis «эта сторона») подобные радикалы расположены по одну сторону от плоскости р-п связи, в транс-изомерах (лат. trans «через») — по разные стороны:
Номенклатура алкенов
Согласно правилам, названия заканчиваются суффиксом «-en» и основываются на греческих цифрах, начиная с четвертого звена цепи и далее, указывающих на количество атомов углерода в цепи. Некоторые алкены имеют тривиальные названия, которые фигурируют в таблице гомологичных алкеновых серий:
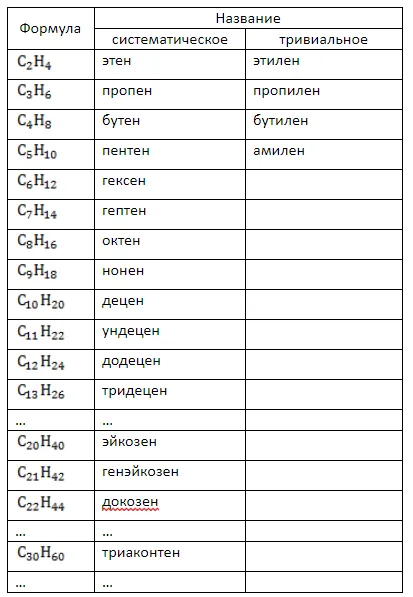
Имена составляются в соответствии со следующими правилами:
- Найти в молекуле самую протяженную цепь, включающую связь σ – π;
- Нумерацию вести с ближайшего к двойной связи конца;
- Указать место двойной связи после наименования;
- Положение радикалов указывается в начале названия по порядку нумерации атомов углерода аналогично номенклатуре алканов.

Если связь C=C находится в середине молекулы, нумерация ведется от конца, ближайшего к корню:
Физические свойства алкенов
Температуры плавления и кипения углеводородов алкенового ряда увеличиваются с ростом длины молекулы и увеличением молекулярной массы.
Концентрационные состояния алкенов при нормальных условиях:
Алкены не образуют водных растворов из-за низкой полярности ковалентных связей, но легко растворимы в органических неполярных растворителях.
Структурная
Алкены характеризуются тремя типами структурной изомерии. Подробное описание типов с примерами приведено в таблице.
Имя
Описание
Примеры
Изменения в структуре углеродного скелета характерны для алкеновых связей, начиная с бутена. Метильная группа присоединяется к любому атому углерода в цепи и образует изомеры.
Когда групп а-CH- переносится2ко второму атому бутеновой цепи с образованием 2-метилпропена.
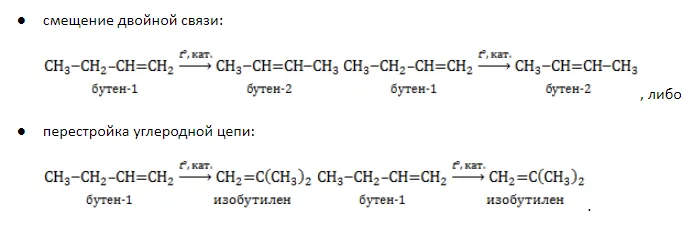
Положения двойной связи
Измените положение двойной связи в углеродной цепи. Это характерно для гомологов с четырьмя и более атомами углерода. Номер атома углерода, на котором находится двойная связь, пишется после названия изомера.
Двойная связь расположена у первого атома углерода молекулы бутена-1 и у второго атома углерода молекулы бутена-2.
Алкены, начиная с пропена, образуют изомеры с циклоалканами путем разрыва двойной связи.
Пропен становится циклопропаном в цикле, бутен-1 — циклобутаном, а гексен-1 — циклогексаном.
В номенклатуре по международной номенклатуре атомы неразветвленной цепи нумеруются, начиная с конца, ближайшего к двойной связи. В разветвленной цепи нумерация начинается с разветвленного конца.
Пространственная
С алкенами возможен один тип пространственной изомерии, а именно цис-транс-изомерия. Атомы углерода, соединенные двойной связью, лежат в плоскости, которая обычно делит молекулу пополам. Одни и те же радикалы, присоединенные к атомам углерода, могут находиться на одной стороне плоскости или на двух разных сторонах. В первом случае это цис-изомер, во втором — транс-изомер.
Аналогично, цис-транс-изомерия характерна для циклоалканов, соединенных с алкенами. Плоскость проходит через кольцевые атомы углерода.

Примерами изомерии алкенов являются цис-бутен-2 и транс-бутен-2. В молекуле цис-бутена-2, -CH3заместители находятся по одну сторону от атомов углерода (теоретически сверху). В молекуле трансбутена-2, -CH3заместители находятся на противоположных сторонах атомов углерода (сверху и снизу).
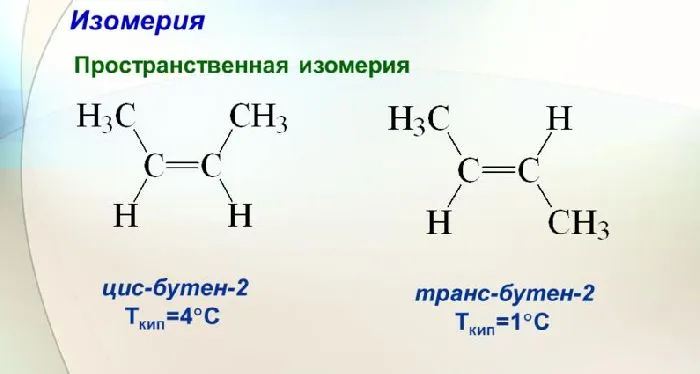
Цис- и транс-изомеры не могут быть превращены друг в друга без разрыва π-связи и затрат энергии. Таким образом, цис- и транс-изомеры — это разные вещества с разными физическими и химическими свойствами.
Гомология
Поскольку общая формула алкенов — CnH2n, они демонстрируют определенную гомологию. Гомологический ряд алкенов начинается с этилена или этилена. При нормальных условиях это вещество находится в газообразном состоянии и содержит два атома углерода и четыре атома водорода (C2H4). После этилена гомологический ряд алкенов продолжается пропеном и бутеном. Это следующие типы: «C3H6» и «C4H8». В нормальных условиях они также тяжелее воздуха, поэтому их нужно собирать в пробирку вверх дном.

Используя общую формулу алкенов, вы можете рассчитать следующего представителя этого класса, который имеет в своей структурной цепи не менее пяти атомов углерода. Это пентен с формулой «C5H10».
По физическим свойствам вышеуказанное вещество относится к жидкостям, как и следующие двенадцать соединений гомологического ряда.
Алкены с вышеуказанными свойствами включают твердые вещества, начинающиеся с формулы C18H36. Жидкие и твердые этиленовые углеводороды не растворимы в воде, но реагируют с органическими растворителями.
Читайте также: Виды отстойников, условия образования и распространения, интересные факты.
В общей формуле, описанной для алкенов, предыдущий суффикс «an» заменяется на «en». Это закреплено в правилах ИЮПАК. Какого бы представителя этого класса соединений мы ни взяли, все они имеют описанный суффикс.
Название соединений этилена всегда содержит конкретное число, которое указывает на положение двойной связи в формуле. Примерами этого являются: «бутен-1» или «пентен-2». Нумерация атомов начинается с конца, где находится двойная конфигурация. Это правило неизменно во всех случаях.
Изомерия
В зависимости от типа гибридизации алкенов существует несколько типов изомерии, каждый из которых имеет свои характеристики и структуры. Рассмотрим основные типы изомерии алкенов.
Структурного типа
Структурные изомеры делятся на основные изомеры:
- углеродному скелету,
- расположению двойной связи.
Структурные изомеры углеродного скелета образуются при возникновении радикалов (ответвлений от основной цепи).
Алкеновыми изомерами вышеуказанных изомеров являются:
Показанные соединения имеют общее число атомов углерода и водорода (C4H8), но разную углеводородную структуру. Они являются структурными изомерами, но не обладают одинаковыми свойствами. Бутен-1 (бутилен) обладает характерным запахом, а также наркотическими и раздражающими дыхательные пути свойствами. 2-Метилпропилен-1 не обладает этими свойствами.
В данном случае этилен (C2H4) не имеет изомеров, поскольку состоит только из двух атомов углерода, остатки которых не могут быть замещены.
Совет. Радикалы могут располагаться у среднего и предпоследнего атома углерода, но не у внешних заместителей. Это правило применяется ко всем ненасыщенным углеводородам.
Изомеры различаются по положению двойной связи:
CH2=CH CH2 CH2 CH2-CH3.
CH3-CN = CH CH2-CH3.
Общая формула приведенных алкенов — C5H10, но положение одной из двойных связей отличается. Свойства вышеуказанных соединений будут разными. Это и есть структурная изомерия.

Изомерия
Пространственного типа
Пространственные изомеры алкенов связаны с тем, как расположены углеводородные заместители.
Исходя из этого, различают изомеры:
«Транс-изомеры» и «цис-изомеры» в одном и том же соединении могут быть образованы общим типом алкенов. Проведите ночь в компании роскошной, индивидуальной леди из Тольятти. Посетите наш сайт, и вы найдете подборку самых способных девушек в вашем районе. Откройте для себя все возможности, и мы поможем вам выбрать подходящего партнера! Возьмем, к примеру, бутилен (бутен). Для этого можно создавать пространственные изомеры с иным расположением заместителей, чем в двойной связи. Пример: изомеризация алкенов может выглядеть следующим образом:
Читайте также: Где и какими полезными ископаемыми богата Россия.

Из приведенного выше примера следует, что «цис-изомеры» имеют два одинаковых корня, расположенных по одну сторону от плоскости двойной связи. Это правило не применяется к «трансизомерам», поскольку они имеют два разных заместителя по отношению к углеродной цепи «C=C». На основе этой закономерности можно построить «цис-» и «транс-» изомеры для различных ациклических этиленовых углеводородов.
Представленные «цис»- и «транс»-изомеры бутена-2 не могут быть превращены друг в друга, так как требуется вращение вокруг существующей углеродной двойной цепи (C=C). Для достижения этого вращения требуется определенное количество энергии, чтобы разорвать существующую «p-связь».
Межклассовые
Изомерия между классами алкеновых углеводородов широко распространена. Причиной этого является сходство общей формулы представителей этого класса с формулой циклопарафинов (циклоалканов). Эти классы имеют одинаковое число атомов углерода и водорода в своих формулах, кратное (CnH2n).
Изомеры между классами будут иметь следующий вид:
Оказалось, что формуле C3H6 соответствуют два соединения: пропен-1 и циклопропан. Структурное расположение показывает различное расположение углерода по отношению друг к другу. Свойства этих соединений также различны. Пропен-1 (пропилен) — это газообразное соединение с низкой температурой кипения. Циклопропан характеризуется газообразным состоянием с сильным запахом и едким вкусом. Химические свойства этих веществ также различны, но их состав идентичен. В органической химии этот тип изомера называется диацетатом.
Алкены. Изомеры алкенов. Органическая химия.
Структура, номенклатура и изомеры алкенов.
Дегидрирование алканов
Среди лабораторных методов производства
следующие:
1. отделение галогеноводорода от галоалкилена
действием спиртового раствора щелочи:


2. гидрогенизация ацетилена
Гидрогенизация ацетилена в присутствии катализатора (Pd):
3. дегидратация спиртов (удаление воды).
Кислоты (сульфат или фосфат) или Al2O3:
В этих реакциях
Водород выделяется из менее гидрогенизированного атома углерода (правило Зайцева):

Физические свойства
Физические свойства некоторых алкенов приведены в таблице ниже. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) являются газами, начиная с C5H10 (амилен или пентен-1) являются жидкостями, а от C18Н36— твердые вещества. Точки плавления и кипения увеличиваются с ростом молекулярного веса. Алкены с нормальной структурой кипят при более высоких температурах, чем их изомеры. Температура кипения цис-изомеров выше, чем у транс-изомеров, а температура плавления — наоборот.
Алкены плохо растворимы в воде (хотя и лучше, чем их алканы), но хорошо растворимы в органических растворителях. Этилен и пропилен горят коптящим пламенем.
Физические свойства некоторых алкенов
Алкены имеют низкую полярность, но легко поляризуются.
Алкены очень реакционноспособны. Их химические свойства в основном определяются наличием двойной связи углерод-углерод.
π-связь, которая является наименее прочной и наиболее доступной, разрывается при действии реагента, а освободившаяся валентность атомов углерода используется для присоединения атомов, составляющих молекулу реагента. Это можно показать в виде диаграммы:

Таким образом, в реакциях присоединения двойная связь не удваивается (s-связь сохраняется).
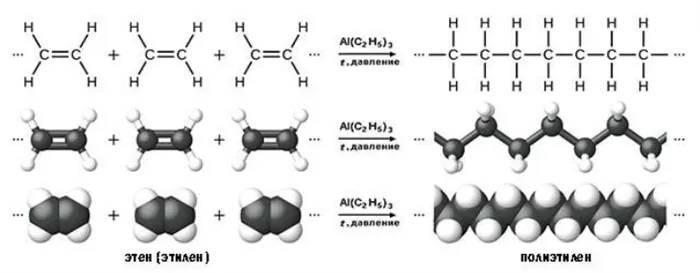
Помимо присоединения, для алкенов характерны реакции окисления и полимеризации.
Применение алкенов
Алкены используются в химической промышленности в качестве реагентов для получения пластмасс, спиртов, альдегидов и других соединений, которые будут рассмотрены в последующих уроках.
Алкены также используются в сельском хозяйстве в качестве веществ, ускоряющих созревание овощей.
Некоторые алкены используются для сварки металлических изделий, как показано на рисунке 7.

Рисунок 7 — Газовая сварка с использованием этилена.








