pH нейтрализованного раствора зависит от константы кислотной диссоциации основания, pK a, или константы связывания основания, pK b.
Урок 17. Реакция нейтрализации
В уроке 17 «Реакция нейтрализации» курса «Химия для чайников» мы рассмотрим процесс нейтрализации и понятия химического эквивалента и эквивалента в граммах; мы также научимся рассчитывать нормальную концентрацию раствора. Термины «кислота» и «основание» тесно связаны с реакцией нейтрализации, поэтому я рекомендую вам подробно изучить урок 16, «Кислоты и основания».

Нейтрализация
Важным свойством кислот и оснований является их способность образовывать ионы H+ и OH- в растворе, где они могут атаковать другие молекулы и вызывать химические превращения, которые затруднены или замедлены в их отсутствие. Когда кислоты и основания реагируют друг с другом, ионы H+ и OH- соединяются, образуя молекулы воды. Этот процесс называется нейтрализацией:
С реакцией нейтрализации тесно связано кислотно-основное титрование. В целом, титрование — это метод определения количества кислоты или основания, присутствующих в растворе, путем измерения количества основания или кислоты данной концентрации, необходимого для полной нейтрализации присутствующего реагента. Термин химический эквивалент используется в титровании.
Химический эквивалент кислоты — это количество кислоты, которое высвобождает 1 моль ионов H+ при нейтрализации основания.
Химический эквивалент основания — это количество основания, при нейтрализации которого выделяется 1 моль ионов OH-.
Полная нейтрализация происходит, когда в реакцию вступают равные количества эквивалентов кислоты и основания.
Эквивалент в граммах — это масса кислоты (или основания) в граммах, которая производит 1 моль ионов H + (или OH — ).
Для кислот, способных выделять 1 ион H+ на молекулу, таких как HCl или HNO.3Химический эквивалент — это такое же количество вещества, как одна молекула, а 1 грамм эквивалента равен одному молекулярному весу. Однако, поскольку H2SO4способен выделять два иона H+ на молекулу, 1 моль H2SO4равен двум эквивалентам, поэтому в реакциях кислотно-основной нейтрализации эквивалент одного грамма серной кислоты равен половине ее молекулярного веса. Эквивалент одного грамма фосфорной кислоты H3PO4т.е. ее масса в граммах, образующая 1 моль ионов Н+, равна 1/3 молекулярной массы этой кислоты. Аналогично для NaOH, KOH и NH3молекулярные веса совпадают с грамм-эквивалентами этих веществ, но грамм-эквивалент Ca(OH)2составляет половину его молекулярного веса.
Полезность использования терминов химический эквивалент и грамм-эквивалент становится понятной, когда вы рассматриваете нейтрализацию фосфорной кислоты гидроксидом магния:

Подумайте, как решить конкретную проблему, используя химические эквиваленты и грамм-эквиваленты:
Пример 1: Используя метод эквивалентности, определите количество граммов HNO.3Используя исчисление бесконечно малых, определите количество граммов воды, необходимое для нейтрализации 100,0 г Ba(OH)2.
Сначала запишите молекулярные веса и грамм-эквиваленты для HNO 3 и Ba(OH)2:
| Реагент | Молекулярная масса, г/моль | г/моль Граммовый эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Идеально! Теперь узнайте, сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
В начале урока мы говорили, что полная нейтрализация достигается, когда в реакцию вступают равные количества химических эквивалентов кислоты и основания. Для нейтрализации 1,167 экв. Ba(OH)2Требуется 1,167 экв. HNO3:
Общее описание
Суть нейтрализации заключается в том, что кислота и основание нейтрализуют друг друга путем обмена активными участками. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и очевидным примером реакции нейтрализации является взаимодействие между соляной кислотой и гидроксидом натрия:
Если окунуть литиевую бумажку в раствор соляной кислоты и гидроксида натрия, она станет фиолетовой, т.е. покажет нейтральную реакцию (красная — кислотную, синяя — щелочную).
Раствор двух активных веществ был превращен в воду путем обмена натрия и хлора, поэтому ионное уравнение для этой реакции выглядит следующим образом.
После нагревания полученного раствора вода испаряется, а соль, NaCl, остается в пробирке.
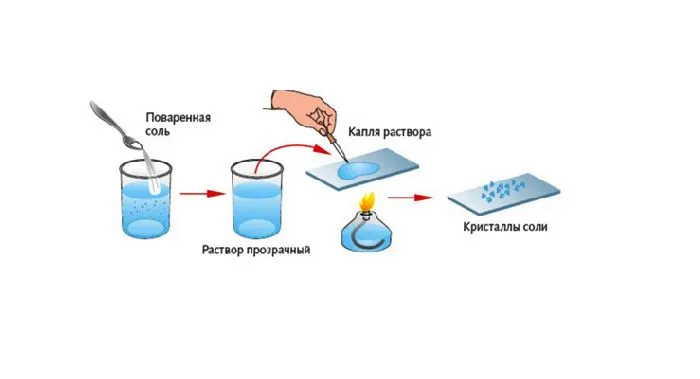
В этих реакциях вода является обязательным продуктом.
Примеры
Реакции нейтрализации могут происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
- необратимые реакции – образованная соль не распадается на составляющие вещества – кислоту и щёлочь (протекают в одну сторону);
- обратимые реакции – образованные соединения способны распадаться на изначальные вещества и вновь взаимодействовать (протекают в обе стороны).
Примером первого типа реакции является взаимодействие сильной кислоты с сильным основанием:
Обратные реакции происходят, когда слабая кислота нейтрализуется сильным основанием, а слабое основание нейтрализуется слабой кислотой:
Слабо нерастворимые или слабо растворимые основания (Fe(OH))3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроксид меди нерастворим в воде, но реагирует с азотной кислотой с образованием соли (нитрата меди) и воды:

Реакции нейтрализации являются экзотермическими и выделяют тепло.
Использование
Реакции нейтрализации составляют основу титрационного анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочной жидкости, и в фармакологии.

Практическое применение нейтрализации в лаборатории также важно: если пролита кислота, ее можно нейтрализовать щелочью.
Реакция нейтрализации в неорганической химии
Реакции нейтрализации являются одной из основ неорганической химии. Нейтрализация относится к типу реакций обмена. В результате реакции образуются соль и вода. Для реакции используются кислоты и основания. Реакции нейтрализации могут быть как обратимыми, так и необратимыми.
Обратимость реакции зависит от степени разложения компонентов. Если используются два сильных соединения, реакция нейтрализации не может вернуться к исходным веществам. Это можно наблюдать, например, в реакции гидроксида калия с азотной кислотой: KOH + HNO3 — KNO3 + H2O,
В определенном случае реакция нейтрализации превращается в реакцию гидролиза соли.
В ионном виде реакция выглядит так: Н(+) + OН(-)>H2O,
Из этого можно сделать вывод, что в реакции сильной кислоты с сильным основанием не может быть обратимости.
Обратимые реакции
Если реакция протекает между слабым основанием и сильной кислотой или между слабой кислотой и сильным основанием или между слабой кислотой и слабым основанием, то процесс обратим.
Обратимость возникает в результате смещения равновесия системы вправо. Обратимость реакции становится очевидной, если в качестве исходных веществ используются, например, уксусная или синильная кислота и аммиак.
— Слабая кислота и сильное основание: HCN+KOH=KCN+H2O,
В ионной форме: HCN+OH(-)=CN(-)+H2O.
— Слабое основание и сильная кислота: HCl+NH3-H2O=Nh4Cl+H2O,
В ионной форме: H(+)+NH3-H2O=NH4(+)+H2O.
— Слабая соль и слабое основание: CH3COOH+NH3-H2O=CH3COONH4+H2O,
В ионной форме: CH3COOH+NH3-H2O=CH3COO(-)+NH4(+)+H2O.
- Раствор серной кислоты и его свойства
- Что такое соляная кислота: химические и физические свойства
- Как получить ацетат натрия
- Как получить хлорид
- Что такое оксиды, гидроксиды и соли
- Как определить химическое равновесие
- Как происходит гидролиз солей и какова его функция
- Как вычислить степень диссоциации
- Как распознать аммиак
- Как определить формальдегид
- Свойства хлороводородной кислоты
- Имеет ли запах щелочь
- Как получить хлорид меди
- От чего зависят кислотно-основные свойства
- Как составить уравнения реакций по химии
- Как доказать амфотерность
- Как классифицировать соли
- Как получить сульфат натрия
- Что такое микробиология
- Как определить ацетат натрия
- Как распознать формальдегид
- Как подчинить себе скорпиона








