Кристаллы вольфрама имеют кубическую решетку с объемным центром. Кристаллы холодного вольфрама характеризуются низкой пластичностью, поэтому их основная форма и размеры мало изменяются при уплотнении порошка, а уплотнение порошка происходит в основном за счет относительного движения частиц.
Вольфрам

Тугоплавкий карбид, цветная или белая сталь
Вольфрам/вольфрам (W), 74
Xe 4f 14 5d 4 6s 2
2,3 (шкала Полинга)
W ← W 3+ 0,11 C W ← W 6+ 0,68 C
19300 кг/м³ 19,3 г/см³
191 кДж/кг 35 кДж/моль
4482 кДж/кг 824 кДж/моль
Вольфрам — это химический элемент с атомным номером 74 в периодической таблице, обозначаемый символом W (лат.: tungsten) и представляющий собой твердый серый переходный металл.
Вольфрам — самый жаропрочный металл (элемент) среди физических элементов. При нормальных условиях он химически устойчив.
Название вольфрамит происходит от минерала вольфрамита, известного как «spuma lupi» на латыни и «волчьи сливки» на немецком языке, которое датируется XVI в. Название было связано с тем, что вольфрам, сопровождающий оловянные руды, препятствовал плавлению олова, превращая его в шлаковую пену («пожирающий олово, как волк пожирает овец»).
Сегодня термин «вольфрам» (шведское tung sten — «тяжелый камень») используется для обозначения вольфрама в США, Великобритании и Франции.
В 1781 году знаменитый шведский химик Шееле обработал минерал шеелит азотной кислотой и получил желтый «тяжелый камень». В 1783 году испанские химики, братья Элюар, сообщили об образовании нового растворимого в аммиаке оксида желтого металла из саксонского минерала вольфрамита. Один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не утверждал, что открытие вольфрама принадлежит ему, а братья Элюар не настаивали на его приоритете.


Процесс добычи вольфрама проходит через WO3из рудных концентратов с последующим восстановлением до металлического порошка водородом при температуре около 700 °C. 700 °C. Из-за высокой температуры плавления вольфрама для получения твердой формы используются процессы порошковой металлургии: Полученный порошок сжимают, спекают в атмосфере водорода при температуре 1200-1300 °C и затем помещают под электрический ток. Металл нагревается до 3000 °C, агломерируется в монолитный материал. Полосовая плавка используется для последующей очистки и формирования монокристаллической формы.
СТРУКТУРА
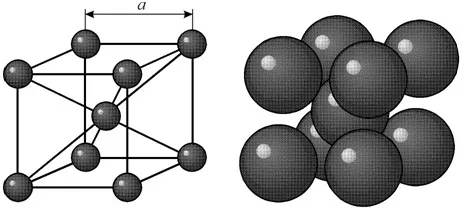
Кристаллы вольфрама имеют кубическую решетку с объемным центром. Кристаллы холодного вольфрама характеризуются низкой пластичностью, поэтому их основная форма и размеры мало изменяются при уплотнении порошка, а уплотнение порошка происходит в основном за счет относительного движения частиц.
В вольфрамовой ячейке с кубическим объемом атомы расположены на концах и в центре ячейки, т.е. на одну ячейку приходится два атома. Структура OCC не состоит из плотного расположения атомов. Коэффициент сжатия составляет 0,68. Пространственная группировка вольфрама — Im3m.
СВОЙСТВА

Вольфрам — блестящий, светло-серый металл с самыми высокими зарегистрированными точками плавления и кипения (говорят, что сиборг еще более тугоплавкий, но мы пока не можем быть уверены — у сиборга очень короткий срок службы). Температура плавления — 3695 К (3422 °C), температура кипения — 5828 К (5555 °C). Плотность чистого вольфрама составляет 19,25 г/см³. Он парамагнитен (магнитная восприимчивость 0,32-10-9). Твердость по Бринеллю составляет 488 кг/мм², удельное электрическое сопротивление 55-10-9-9 Ом-м при 20 °C и 904-10-9 Ом-м при 2700 °C. Скорость звука в отожженном вольфраме составляет 4290 м/с. Он является парамагнитным.
Вольфрам — один из самых тяжелых, твердых и жаропрочных металлов. В чистом виде это серебристо-белый, похожий на платину металл, который можно ковать и вытягивать в тонкие нити при температуре около 1600 °C.

Вольфрам встречается в природе в основном в виде окисленных комплексных соединений, состоящих из триоксида вольфрама WO3с оксидами железа и марганца или кальция, иногда также со свинцом, медью, торием и редкими землями. Промышленное значение имеет тунгстат (вольфрамовое железо и марганец nFeWO4* mMnWO4— ферберит или гибернит) и селенит (вольфрамово-кальциевый CaWO4Минералы вольфрама обычно залегают в гранитных породах, поэтому средняя концентрация вольфрама составляет 1-2 %.
Самые крупные месторождения находятся в Казахстане, Китае, Канаде и США; также известны месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49-50 тысяч тонн в год, из которых 41 приходится на Китай, 3,5 — на Россию, 0,7 — на Казахстан и 0,5 — на Австрию. Основные экспортеры вольфрама: Китай, Южная Корея, Австрия. Основные импортеры: США, Япония, Германия, Великобритания. Месторождения вольфрама есть также в Армении и других странах.

Преломляющая способность и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в оптических прицелах и других вакуумных трубках. Благодаря своей высокой плотности вольфрам является основой тяжелых сплавов, используемых для изготовления противовесов, сердечников бронебойных субкультур и лопастей стреловидных орудий, сердечников бронебойных пуль и сверхбыстрых гиророторов для стабилизации полета баллистических ракет (до 180 тысяч оборотов в минуту).
Вольфрам используется в качестве электрода для аргонодуговой сварки. Сплавы, содержащие вольфрам, устойчивы к жаре, кислоте, твердости и истиранию. Они используются в производстве хирургических инструментов (амальгама), брони, корпусов торпед и ракет, крупных деталей самолетов и двигателей, а также контейнеров для хранения радиоактивных материалов. Вольфрам является важным компонентом лучших инструментальных сталей. Вольфрам используется в высокотемпературных вакуумных печах сопротивления в качестве нагревательного элемента. В качестве термопары в таких печах используется сплав вольфрама и рения.
Сплавы и композиты на основе карбида вольфрама широко используются для обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурении и горнодобывающей промышленности (например. бобедит, состоящий из кристаллов WC в кобальтовой матрице), широко применяемые в России марки WC2, WC4, WC6, WC8, WC15, WC25, T5C10, T15C6, T30C4), а также смеси карбида вольфрама и карбида титана, карбида тантала (марка TT для особо тяжелых условий обработки, например, долбления и строгания поковок из жаропрочной стали и ударного сверления твердых материалов). Он часто используется в качестве легирующего элемента (часто в сочетании с молибденом) в сталях и сплавах на основе железа. Высоколегированные стали, называемые «быстрорежущими» и обозначаемые буквой P, почти всегда содержат карбид вольфрама. (P18, P6M5 от Fast, Speed).
Сульфид вольфрама WS2используется в качестве высокотемпературного смазочного материала (до 500 °C). Некоторые соединения вольфрама используются в качестве катализаторов и пигментов. Монокристаллы вольфрама (свинца, кадмия, кальция) используются в качестве сцинтилляционных детекторов рентгеновских лучей и других ионизирующих излучений в ядерной физике и ядерной медицине.
Свойства

Вольфрам классифицируется как переходный металл. Имеет серебристо-серый цвет. В периодической таблице Менделеева он относится к VI группе и имеет атомный номер 74.
Физические свойства металла:
- плотность 19,25 г/см3;
- кристаллическая структура объемноцентрированная, кубическая;
- парамагнитен;
- температура плавления 3422 °C;
- цвет искры — желтый, дает пучок коротких прерывистых искр;
- число стабильных изотопов 4.
Некоторые свойства вольфрама уникальны. Вольфрам обладает некоторыми свойствами. Некоторые из его свойств уникальны. Преломление света является отличительной чертой вольфрама и отличает его от других металлов.
| Свойства атома | |
|---|---|
| Имя, символ, номер. | Вольфрам / Вольфрамий (W), 74 |
| Атомный вес (молекулярная масса) | 183,84(1)1 а.о. (г/моль) |
| Электронная конфигурация | Xe 4f14 5d4 6s2 |
| Атомный радиус | 141 стр. |
| Химические свойства | |
| Ковалентный радиус | 170 стр. |
| Ионный радиус | (+6e) 62 (+4e) 70 мк.м. |
| Электромагнетизм | 2,3 (по шкале Паулинга) |
| Электродный потенциал | W ← W3+ 0,11 C W ← W6+ 0,68 C. |
| Состояния окисления | 6, 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (в н.у.м.) | 19,252 г/см³ |
| Температура плавления | 3695 К (3422 °C, 6192 °F)2 |
| Температура кипения | 5828 К (5555 °C, 10031 °F)2 |
| Удельная теплота плавления | 285,3 кДж/кг 52,3134 кДж/моль |
| Удельная теплота парообразования | 4482 кДж/кг 824 кДж/моль |
| Молекулярная теплоемкость | 24,275 Дж/(К-моль) |
| Молекулярный объем | 9,53 см³/моль |
| Кристаллическая решетка одного вещества | |
| Решетчатая структура | кубически-объемно-центрический |
| Параметр решетки | 3,160 Å |
| Температура Дебая | 310 K |
| Другие характеристики | |
| Теплопроводность | (300 К) 162,86 Вт/(м-К) |
| номер CAS | 7440-33-7 |
Рекомендуется.
Не доказано: Было высказано предположение, что сиборий (изотоп нестабилен, период его полураспада составляет всего 0,01 секунды) более устойчив.
Месторождения и добыча
Вольфрамит (губернит, ферберит) и селит пригодны для промышленного производства.
- штокверковый вольфрамитовый;
- штокверковый шеелитовый;
- жильный вольфрамитовый;
- скарново-шеелитовый.
Крупнейшими месторождениями вольфрамовых руд являются:
Российские запасы вольфрамовой руды поступают из первичных месторождений.
Получение
Промышленному извлечению металлов из руд предшествует обогащение. Первичная добыча руд основана на извлечении первичных руд путем дробления, измельчения и флотации. Затем WO3 извлекается из концентрата и восстанавливается до металла водородом при температуре около 700 °C.
Твердый вольфрам производится путем:
- Методом порошковой металлургии. Достоинство метода — возможность равномерного введения присадок.
- Электронно-лучевая плавка, или плавка в электро-дуговых печах. Достоинство метода — возможность получать крупные (до 3 тонн) заготовки металла.

Только алмазы тверже карбида вольфрама
Чистый вольфрам не очень твердый — его можно резать ножовкой — но когда вольфрам соединяют с небольшим количеством углерода, получается карбид вольфрама, одно из самых твердых и прочных веществ на земле.
Добавление в вольфрам небольшого количества углерода или других металлов стабилизирует его структуру и предотвращает легкое деформирование.

Карбид вольфрама настолько твердый, что его можно резать только алмазами, и даже тогда алмазы работают только в том случае, если карбид вольфрама не полностью закален. Карбид вольфрама в три раза тверже стали, выдерживает в 100 раз большее трение, чем сталь, и имеет самую высокую прочность на сжатие среди всех кованых металлов, что означает, что он не вмят и не деформируется при сжатии с огромной силой.

Наиболее распространенное применение карбида вольфрама — и конечный пункт назначения большей части добываемого на Земле вольфрама — это изготовление специальных инструментов, особенно сверл. Сверло для резки металла или твердых пород должно выдерживать высокие абразивные нагрузки, не тупясь и не ломаясь. Тверже карбида вольфрама только алмазные сверла, но они также намного дороже.
Другие полезные применения вольфрама
Твердость, плотность и жаропрочность вольфрама делают его идеальным для различных специальных применений:
- Электронные микроскопы выстреливают поток электронов из специального наконечника эмиттера, сделанного из вольфрама.
- Большинство сварных швов между металлом и стеклом сделано из вольфрама, потому что вольфрам расширяется и сжимается с той же скоростью, что и боросиликатное стекло, наиболее распространенный вид стекла.
- Шипы на гусеницах снегохода изготовлены из вольфрамовых сплавов.
- Дротики профессионального уровня изготавливаются из вольфрама («Wolfram Infinity» на 97 процентов состоит из вольфрама ).
- В шариковых ручках шарик часто изготавливается из карбида вольфрама.
- Ювелирная промышленность изготавливает кольца из карбида вольфрама.

Фальшивомонетчики давно обнаружили, что вольфрам имеет почти такую же плотность, как золото, и иногда пытаются выдать позолоченные вольфрамовые слитки за чистое золото.
Город федерального значения Москва — история и факты
Целый ряд металлических мероприятий
Алюминий металлический или неметаллический
Окисление и валентность
Типы химических связей
На чем основан термометр
Химические свойства
Он имеет валентность от 2 до 6. 6-валентный вольфрам является самым стабильным. Соединения 3- и 2-валентного вольфрама нестабильны и не имеют практического значения.
Вольфрам обладает высокой коррозионной стойкостью: при комнатной температуре он не изменяется на воздухе, при горячих температурах медленно окисляется до оксида вольфрама (VI). Вольфрам находится сразу после водорода в порядке склонности и почти нерастворим в соляной кислоте, разбавленной серной кислоте и плавиковой кислоте. На поверхности он окисляется до азотной кислоты и акварегии. Он растворим в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот:
Реагирует с расплавленными щелочами в присутствии окислителей:
Сначала эти реакции идут медленно, но когда вы достигаете 400°C (500°C для реакции с кислородом), вольфрам начинает нагреваться, и реакция протекает довольно быстро, выделяя много тепла.
Он растворяется в смеси азотной и плавиковой кислот с образованием гексафторотунгстовой кислоты H2WF6. Среди соединений вольфрама наиболее важными являются: триоксид или ангидрид вольфрама, тунгстаты, пероксидные соединения с общей формулой Me2WOXи соединения с галогеном, серой и углеродом. Вольфрам склонен к образованию полимерных анионов, включая гетерополимерные соединения с другими переходными металлами.
Вольфрам не играет важной биологической роли. Некоторые архебактерии и бактерии имеют ферменты, содержащие вольфрам в своем активном сайте. Существуют облигатные вольфрамозависимые формы архебактерий-гипертермофилов, которые живут вблизи гидротермальных источников в глубоком море. Присутствие вольфрама в ферментах можно рассматривать как физиологический остаток ранних архей — есть предположение, что вольфрам играл определенную роль на ранних этапах зарождения жизни.
Вольфрамовая пыль, как и большинство других металлических пылей, является раздражителем дыхательных путей.
Известны изотопы вольфрама с массовыми числами от 158 до 192 (число протонов 74, число нейтронов от 84 до 118) и более 10 ядерных изомеров.
Природный вольфрам состоит из смеси пяти изотопов (180 W — 0,12(1)%, 182 W — 26,50(16)%, 183 W — 14,31(4)%, 184 W — 30,64(2)% и 186 W — 28,43(19)%). В 2003 году была обнаружена чрезвычайно слабая радиоактивность природного вольфрама (около двух распадов на грамм элемента в год) за счет альфа-активности 180 Вт, период полураспада которой составляет 1,8⋅10 18 лет.
- Вольфрам (W)
- Арсенид вольфрама (WAs2) Вольфрам мышьяковистый
- Борид вольфрама (WB) Вольфрам бористый
- Борид дивольфрама (W2B) Бористый вольфрам
- Бромид вольфрама II (WBr2) Вольфрам бромистый
- Бромид вольфрама III (WBr3)
- Бромид вольфрама IV (WBr4) Бромистый вольфрам
- Бромид вольфрама 5 (WBr5)
- Бромид вольфрама VI (WBr6)
- Вольфрамит ((FeMn)WO4)
- Вольфрамовая кислота (H2WO4) Ортовольфрамовая кислота
- Гексакарбонилвольфрам (W(CO)6)
- Диборид вольфрама (WB2)
- Динитрид вольфрама (WN2)
- Диоксидибромид вольфрама (WO2Br2) Бромистый вольфрамил
- Диоксидихлорид вольфрама (WO2Cl2) Хлористый вольфрамил
- Дисилицид вольфрама (WSi2) Кремнистый вольфрам
- Дисульфид вольфрама (WS2) Сернистый вольфрам
- Дифосфид вольфрама (WP2) Фосфористый вольфрам
- Дифосфид тетравольфрама (W4P2)
- Йодид вольфрама II (WI2) Вольфрам йодистый
- Йодид вольфрама III (WI3)
- Йодид вольфрама IV (WI4) Йодистый вольфрам
- Карбид вольфрама (WC) Вольфрам углеродистый
- Карбид дивольфрама (W2C) Углеродистый вольфрам
- Нитрид дивольфрама (W2N) Вольфрам азотистый
- Оксид вольфрама IV (WO2) Окись вольфрама
- Оксид вольфрама VI (WO3) Вольфрам окись
- Окситетрабромид вольфрама VI (WOBr4) Бромокись вольфрама
- Окситетрафторид вольфрама VI (WOF4) Фторокись вольфрама
- Окситетрахлорид вольфрама VI (WOCl4) Хлорокись вольфрама
- Пентаборид дивольфрама (W2B5)
- Селенид вольфрама IV (WSe2) Вольфрам селенистый
- Селенид вольфрама VI (WSe3) Селенистый вольфрам
- Силицид вольфрама (W2Si3) Вольфрам кремнистый
- Теллурид вольфрама IV (WTe2) Вольфрам теллуристый
- Тринитрид дивольфрама (W2N3) Азотистый вольфрам
- Трисульфид вольфрама (WS3) Вольфрам сернистый
- Фенолят вольфрама (WC36H30O6)
- Фосфид вольфрама (WP) Вольфрам фосфористый
- Фторид вольфрама IV (WF4) Вольфрам фтористый
- Фторид вольфрама 5 (WF5)
- Фторид вольфрама VI (WF6) Фтористый вольфрам
- Фтороксивольфраматы
- Хлорид вольфрама II (WCl2) Вольфрам хлористый
- Хлорид вольфрама III (WCl3)
- Хлорид вольфрама IV (WCl4)
- Хлорид вольфрама 5 (WCl5)
- Хлорид вольфрама VI (WCl6) Хлористый вольфрам
- Шеелит (CaWO4)
Месторождения, добыча
Месторождения вольфрамовых руд не являются редкостью на Земле, их запасы оцениваются в миллионы тонн.
Крупнейшие месторождения находятся в Китае, Казахстане, Канаде и США. Россия, Португалия, Узбекистан и другие страны имеют меньше ресурсов.
Мировое производство составляет 48-51 тыс. тонн вольфрама в год. Китай является бесспорным лидером (80%).
Добыча ведется закрытым или открытым способом.
Технология получения
Вольфрамовые руды из разных районов добычи содержат 0,3-2,5 % оксида металла. Поэтому промышленное извлечение продукта из руды начинается на обогатительных фабриках.
Это многоступенчатый процесс:
- Дробление руды.
- Шлифовка.
- Флотация.
- Обжиг.
Содержание полезных компонентов увеличивается до 60 %:
- Чистоту концентрата повышают, расщепляя примеси гидроксидом натрия и задействуя метод ионообменной экстракции.
- До порошка восстанавливают при 650-700°C в водородистой среде.
Тугоплавкость оказалась недостатком и исключает классическую плавку.
Твердые формы производятся методом порошковой металлургии:

- Порошок спрессовывают.
- Спекание проводят при 1250-1300°C в водороде.
- Воздействуют электричеством.
- Нагревают до 3000°C, добиваясь монолитного спекания.
Кроме того, металл рафинируется путем зонной плавки.
Номенклатура марок металла
Металлурги сплавляют десятки названий и сортов продукции на основе или с содержанием вольфрама.
Наиболее распространенными являются чистый вольфрам (PM) и сплавы рения (ER).
Классификация марок вольфрама основана на составе добавок:
| Название класса | Тип добавки |
| ВА | Алюминиевая щелочь + кремний |
| ВМ | Алюминий Алюминий Торий + кремний Щелочь |
| ВИ | Оксид иттрия |
| ВТ | Оксид тория |
| ВЛ | Оксид лантана |








