Оксиды вездесущи в природе, и, честно говоря, трудно представить нашу планету без двух веществ — воды H2O и песок SiO2.
Оксиды. классификация, свойства, получение, применение
1. взаимодействие простых веществ (кроме благородных газов, золота и платины) с кислородом:
При горении щелочных металлов (кроме лития), а также стронция и бария в кислороде образуются пероксиды и перекиси:
2. горение или сгорание бинарных соединений в кислороде:
3. термическое разложение солей:
4. термическое разложение оснований или кислот:
5. окисление низших оксидов до высших оксидов и восстановление высших оксидов до низших оксидов:
6. взаимодействие некоторых металлов с водой при высоких температурах:
7. взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
8. взаимодействие металлов с окислительными кислотами:
9. в действии дегидратирующих веществ на кислоты и соли:
10. взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
Химические свойства оснований
Все базы делятся на:
Следует помнить, что бериллий и магний не являются щелочноземельными металлами.
Щелочи не только растворимы в воде, но и очень растворимы в водных растворах, в то время как нерастворимые основания имеют низкую степень разложения.
Эта разница в растворимости и разлагаемости щелочей и нерастворимых гидроксидов в свою очередь приводит к существенным различиям в их химических свойствах. Щелочи, в частности, являются более химически реактивными соединениями и часто могут реагировать так, как не могут нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, включая очень слабые и нерастворимые кислоты. Например:
Нерастворимые основания реагируют почти со всеми растворимыми кислотами; они не реагируют с нерастворимым кремнеземом:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2могут образовывать основные соли, если, например, не хватает кислоты:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами с образованием солей и часто воды:
Нерастворимые основания могут реагировать со всеми высшими кислотными оксидами с образованием стабильных кислот, например, P2O5, SO3, N2O5с образованием промежуточных солей:
Нерастворимые основания, такие как Me(OH)2реагируют в присутствии воды исключительно с углекислым газом с образованием основных солей. Например:
Только самые сильные основания, щелочи, реагируют с кремнеземом, поскольку они чрезвычайно инертны. Самыми сильными щелочами являются щелочные металлы. Нерастворимые основания не вступают с ним в реакцию. Например:



Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакция происходит путем сплавления амфотерного оксида или гидроксида с твердой щелочью, эта реакция приводит к образованию безводных солей:
При использовании водных растворов щелочей образуются гидроксокомплексные соли:
В случае алюминия избыток концентрированной щелочи образует NaAl(OH) вместо NaAl(OH).4NaАлюминиевая соль образует соль Na3Al(OH)6:
Взаимодействие оснований с солями
Основание реагирует с солью только при двух условиях одновременно:
1) Растворимость исходных соединений,
2) наличие осадка или газа между продуктами реакции.
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2термостойки и плавятся, не разлагаясь.
Номенклатура
Согласно номенклатуре ИЮПАК, оксиды обозначаются словом «оксид», за которым в общем случае следует название химического элемента, например, Na2O — оксид натрия, Al2O3— Оксид алюминия. Если элемент имеет переменную степень окисления, в названии оксида указывается степень окисления в скобках сразу после названия (без пробела). Например, Cu2O — оксид меди (I), CuO — оксид меди (II), FeO — оксид железа (II), Fe2О3— оксид железа (III), Cl2O7— оксид хлора (VII).
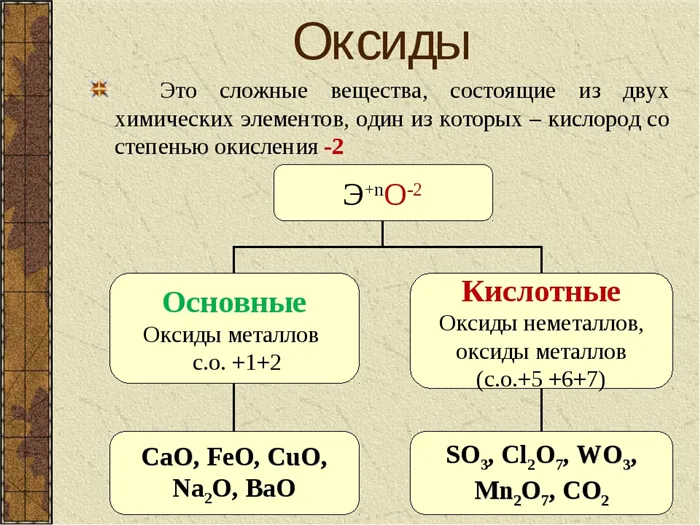







Очень часто другие оксиды называют монооксид или монооксид, если оксид содержит только один атом кислорода, диоксид или диоксиген, если он содержит два, триоксид или триоксид, если он содержит три и т.д. Например: монооксид углерода CO, диоксид углерода CO2Триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, монооксид углерода CO, сернистый ангидрид SO3и т.д.
В начале XIX века и ранее тугоплавкие, почти нерастворимые в воде оксиды химики называли «землями».
Традиционная номенклатура
Оксиды с более низкой степенью окисления (субоксиды) иногда называли оксидом и субоксидом (например, оксид углерода (II), CO — оксид углерода; треххлористый углерод, C3O2— двуокись углерода; закись азота (I), N2O — монооксид азота; оксид меди (I), Cu2O — оксид меди).
Оксиды с более высокой степенью окисления (например, оксид железа (III), Fe2O3) называются оксидами по этой номенклатуре, а двойные оксиды (т.е. с разной степенью окисления) — оксид-оксидами (Fe3O4= FeO-Fe2O3— оксид железа, уран(VI)-диоран(V) оксид, U3O8— оксид урана).
Однако эта номенклатура не является единой, поэтому эти названия, вероятно, следует считать традиционными.
Урок 31. Оксиды
В уроке 31 «Оксиды» из курса «Химия для чайников» мы познакомимся с классификацией оксидов и узнаем, где они встречаются в природе.

Все минералы делятся на несколько классов, наиболее важными из которых являются оксиды, кислоты, основания и соли. Вы уже получили представление об этих веществах. Теперь вам предстоит познакомиться с ними поближе и систематизировать свои знания.
Вы уже знаете, что кислород — самый распространенный элемент на Земле. Его атомы соединяются с атомами других элементов, образуя разнообразные сложные неорганические вещества, среди которых важное место занимают оксиды.
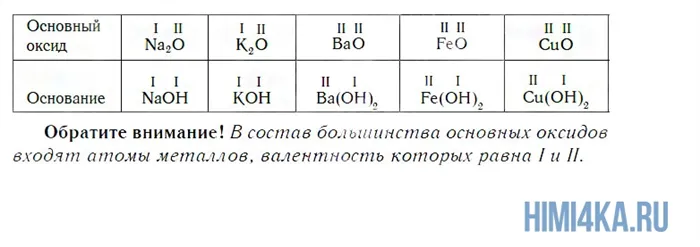
Состав оксидов
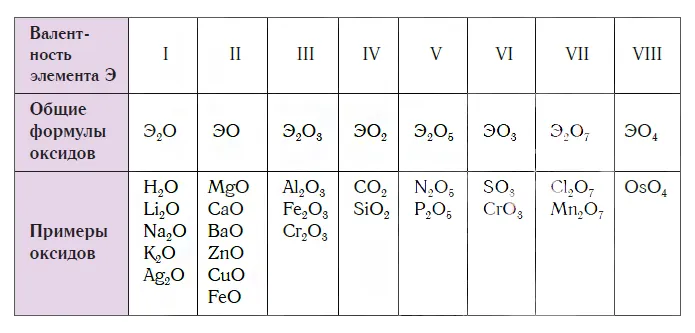
Каждый оксид состоит из атомов двух химических элементов, одним из которых является, например, кислород: H2O, Al2O3, Р2О5O, CuO, Cl2O7. В общей сложности существует около 300 различных оксидов. Их общая химическая формула — E x O, где E означает символ химического элемента, образующего оксид, O — кислород, а буквы x и y — индексы, обозначающие количество атомов в молекулах или единицах формулы оксида.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
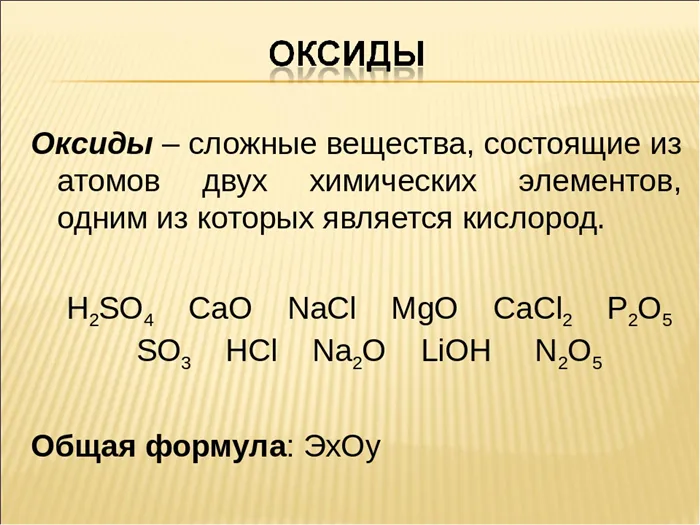
Классификация оксидов
Поскольку известно так много оксидов, необходимо классифицировать эти вещества в соответствии с их химическими свойствами, т.е. способностью превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой и образовывать два типа соединений: Кислоты и основания. Например, оксид фосфора (V) P2O5который при соединении с водой превращается в кислоту H3PO4:
а оксид кальция CaO превращается в основание Ca(OH) при соединении с водой.2:

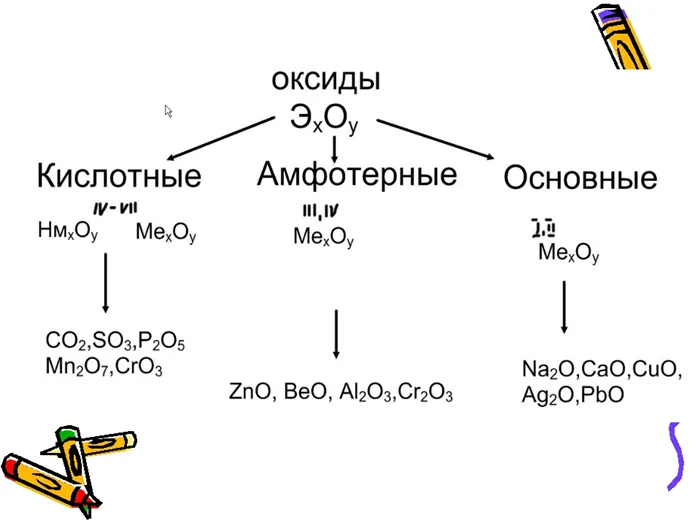
Другими словами, для оксида фосфора это кислота, а для оксида кальция — основание. Исходя из этого, оксиды можно разделить на две большие группы: Кислотные оксиды и основные оксиды.
Кислотные оксиды — это те, которым соответствуют кислоты. Помимо P2О5СО2SiO2, SO2, N2O5, SO3и некоторые другие. Все они соответствуют кислотам.
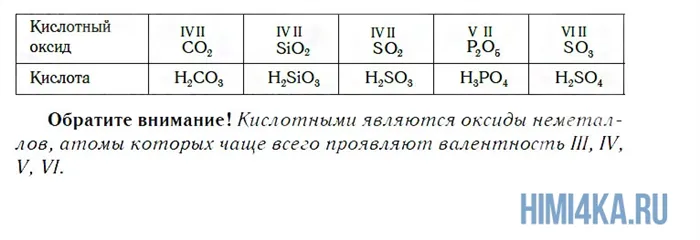
Основные оксиды соответствуют основаниям. Помимо CaO, наиболее важными оксидами являются Na2O, K2O, BaO, FeO, CuO и многие другие. Эти оксиды называются основаниями.
Оксиды
Оксиды — это соединения, состоящие из атомов двух элементов, один из которых — кислород в состоянии окисления ( -2 ).
К оксидам относятся все соединения элементов с кислородом, например, Fe2O3, P4O10за исключением соединений, содержащих атомы кислорода, химически связанные друг с другом:
- пероксиды ( Na2O2);
- надпероксиды ( KO2);
- озониды ( KO2).

и соединения фтора с кислородом (OF2, O2F2), которые следует называть не оксидами фтора, а оксидами фтора, поскольку степень окисления кислорода в них положительная.
Физические свойства оксидов
Температуры плавления и кипения оксидов изменяются в очень широком диапазоне. При комнатной температуре они могут находиться в различных агрегатных состояниях в зависимости от типа кристаллической решетки. Это зависит от типа химической связи в оксидах, которые могут быть ионными или ковалентно полярными.
В газообразном и жидком состояниях при комнатной температуре существуют оксиды, образующие молекулярные кристаллические решетки. Температуры плавления и кипения увеличиваются с ростом полярности молекул (Таблица 1).
Таблица 1: Температуры плавления и кипения некоторых оксидов (при давлении 101,3 кПа)
| CO2 | CO | SO2 | ClO2 | SO2 | Cl2O7 | H2O | |
| TТемпература плавления,⁰C | -78 (TСублимация) | -205 | -75,46 | -59 | -16,8 | -93,4 | 0 |
| TТемпература кипения, ⁰C | -191,5 | -10,1 | 9,7 | 44,8 | 87 | 100 |
Оксиды, образующие ионные кристаллические решетки, например, CaO, BaO и другие являются твердыми веществами, имеющими очень высокие температуры плавления (>1000⁰C )/
В некоторых оксидах используются ковалентные полярные связи. Они образуют кристаллические решетки, в которых атомы соединены множеством «мостиковых» атомов кислорода, образуя бесконечную трехмерную сеть, например, Al2O3SiO2, TiO2BeO и эти оксиды также имеют очень высокие температуры плавления.
Увеличение степени окисления и уменьшение радиуса его иона (за счет уменьшения эффективного отрицательного заряда атома кислород а-δ0) делают оксид более кислотным. Это объясняет регулярное изменение свойств оксидов от основных к амфотерным, а затем к кислотным.

(A) В периоде с увеличением атомного номера кислотные свойства оксидов возрастают, и сила соответствующих им кислот увеличивается.
Таблица 2: Зависимость кислотно-основных свойств оксидов от эффективного заряда на атоме кислорода
| Оксид | Na2O | MgO | Аль2O3 | SiO2 | P4O1023 | SO3 | Cl2O7 |
| Эффективный заряд δ0 | -0,81 | -0,42 | -0,31 | -0,23 | -0,13 | -0,06 | -0,01 |
| Кислотно-основные свойства оксида | Основной | Основной | Амфотерный | Кислотный | |||
B)В главных подгруппах периодической таблицы наблюдается увеличение свойств основных оксидов по мере перехода от одного элемента к другому сверху вниз:
C)По мере увеличения степени окисления элемента кислотные свойства оксидов увеличиваются, а основные свойства уменьшаются:
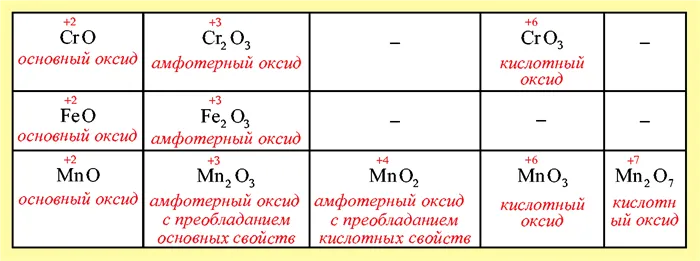
Таблица 3: Зависимость кислотно-основных свойств от степени окисления металлов.
Свойства
Свойства оксидов зависят от их природы. Оксиды могут быть ионными (E N+ O 2- ), как CaO (Ca 2+ O 2- ), или ковалентными, как SO2, O = S = O.
Исходя из этого факта и склонности элементов реагировать с кислотами или основаниями, для каждого оксида составлены определенные свойства.
Кроме того, они отражаются в физических свойствах, таких как температура плавления и температура кипения. Ионные оксиды склонны к образованию кристаллических структур, которые очень термостойки, поэтому их температуры плавления высоки (более 1000ºC), в то время как ковалентные продукты плавятся при низких температурах или даже в газах или жидкостях.
Как они были сформированы?

Оксиды образуются, когда элементы реагируют с кислородом. Эта реакция может происходить просто при контакте с богатой кислородом атмосферой или при нагревании (например, пламенем зажигалки). То есть, когда объект горит, он вступает в реакцию с кислородом (если он присутствует в воздухе).
Например, если поместить кусочек фосфора в пламя, он сгорит и образует соответствующий оксид:
В этом процессе некоторые твердые вещества, такие как кальций, могут гореть ярким, светящимся пламенем.
Другим примером является сжигание древесины или других органических веществ, содержащих углерод:
Однако в отсутствие кислорода вместо СО образуется СО.2:
Обратите внимание, как соотношение C/O используется для описания различных оксидов.
Примеры оксидов

Приведенный выше рисунок соответствует структуре ковалентного оксида I2О5наиболее стабильная форма йода. Обратите внимание на его одинарные и двойные связи, а также на I и кислородные заряды по бокам.
Оксиды галогенов характеризуются тем, что они ковалентны и очень реакционноспособны, как в случае с O2F2(F-O-O-F) и OF2(P-O-P): диоксид хлора, ClO2например, является единственным оксидом хлора, который синтезируется в промышленных масштабах.
Поскольку галогены образуют ковалентные оксиды, их «гипотетические» значения рассчитываются одинаково в соответствии с принципом электрической нейтральности.
Оксиды переходных металлов
Помимо оксидов галогенов, существуют также оксиды переходных металлов:
CoO: оксид кобальта(II), оксид кобальта, оксид кобальта.
-HgO: оксид ртути(II); оксид ртути; оксид ртути.
-Аг .2O: оксид серебра, оксид серебра или двойной оксид.
-Au .2О3Оксид золота(III); оксид золота или триоксид золота.
Дополнительные примеры
-В2О3Оксид бора; оксид борной кислоты; оксид борной кислоты; или триоксид бора.
-Cl2О7: оксид хлора (VII), оксид хлора, дихлоргектоксид.
-NO : Монооксид азота (II), монооксид азота, монооксид азота.
Соли
С представителями этого класса веществ вы сталкиваетесь каждый день на кухне, дома, на улице, в школе и в сельском хозяйстве.

Общей чертой всех этих веществ является то, что они содержат атомы металла и кислотный остаток. Именно в этом смысле мы определяем этот класс.
Средние соли являются продуктом полного обмена между веществами, содержащими атомы металла, и кислотным остатком (KO) (помните, что это часть чего-то, что не может существовать отдельно).
Выше мы рассмотрели 3 класса соединений. Теперь попробуем подобрать комбинации для производства соли в зависимости от типа реакции обмена.

Чтобы составить название солей, нужно дать название кислотного остатка и в общем случае добавить название металла.
Ca(NO3)2— Нитрат кальция (Ti), CuSO4— сульфат меди(II).
Я уверен, что многие из вас что-то собирали: машины, куклы, фантики, чтобы получить недостающую модель, которую вы обменяли у кого-то другого. Давайте применим этот принцип и к приобретению солей. Например, для получения сульфата натрия необходимо 2 моль щелочи и 1 моль кислоты. Если предположить, что в наличии имеется только 1 моль NaOH, как будет протекать реакция? Один атом водорода занимает место натрия, а второй H лишен Na. То есть, неполный обмен между кислотой и основанием приводит к образованию кислых солей. Их название не отличается от обычного, добавляется только префикс hydro.

Однако бывают случаи, когда атомов водорода не хватает для связывания групп OH. Результатом этого дефицита являются основные соли. Предположим, что реакция происходит между Ba(OH)2и HCl. Для связи двух гидроксильных групп необходимы два гидрогена, но предположим, что их мало, т.е. 1. Реакция протекает по этой схеме.

Комплексные соли с их неупорядоченным внешним видом, т.е. квадратными скобками, представляют особый интерес и вызывают некоторые трудности:K3Fe(CN)6или Ag(NH(NH)3)2Кл. Но, как говорится, волк не так плох, как его выставляют. Соли состоят из катионов (+) и анионов (-), что справедливо и для комплексных солей.
Комплексный ион образуется элементом, образующим комплекс, обычно атомом металла, окруженным лигандами.

Источник
Теперь дело за тем, чтобы дать название этому виду соли.

Мы постараемся использовать имя K3Fe(CN)6. Существует основной принцип: чтение идет справа налево. Число лигандов и их роль, которую играют цианогруппы CN — равно 6 — приставка гекса. Комплексообразующим агентом являются ионы железа. Поэтому вещество называется гексацианоферрат (III) (был) калия.








