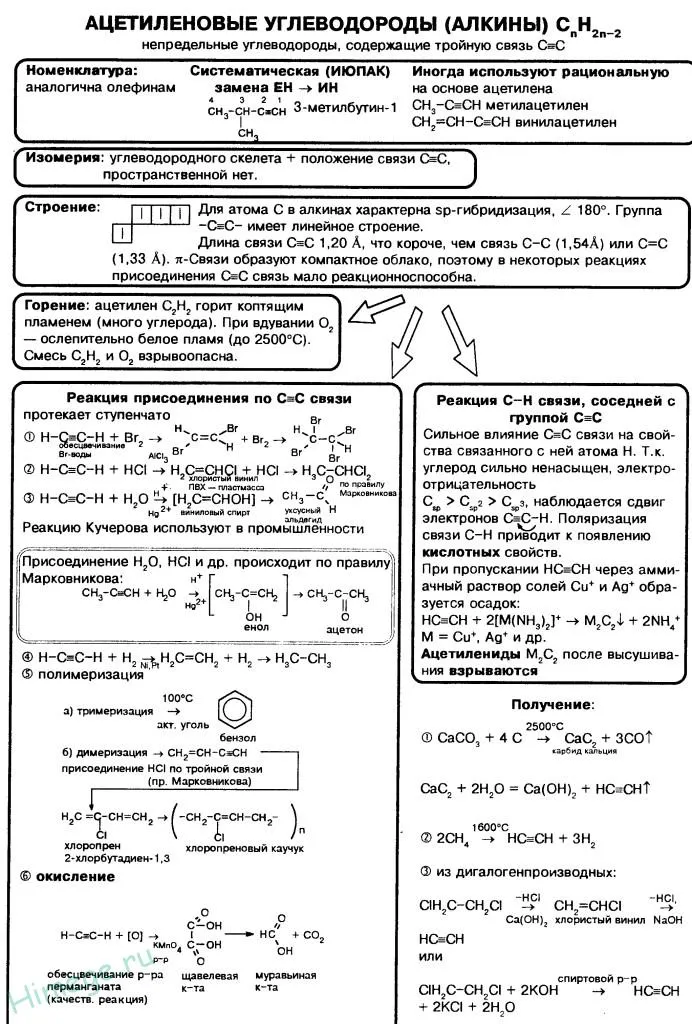
Реакция протекает в тех же условиях, что и для алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов образуются сначала алкены, а затем алканы:
Гомологический ряд алкинов
Все алкины имеют общие или сходные физические и химические свойства. Аналогичные алкины, которые отличаются по структуре одним или нескольким и-CH2— группы, называются гомологами. Эти алкины образуют гомологический ряд.
Первым членом гомологического ряда алкенов является этилен (ацетилен) C2H2или CH≡CH.
Можно образовать гомологический ряд путем последовательного добавлени я-CH2— группа в углеводородной цепи.
| Название алкина | Тип Алкин |
| Этин (ацетилен) | C2H2 |
| Пропилен | C3H4 |
| Butyne | C4H6 |
| Pentyne | C5H8 |
| Хексинь | C6H10 |
| Хептина | C7H12 |
Общая формула гомологического ряда C-алкиновnH2n-2.
Первые три члена гомологического ряда алкинов являются газами, начиная с C5Н8к16Н30— жидкости, начиная с C17Н32— твердые вещества.
Алкины плохо растворимы в воде и хорошо растворимы в органических растворителях.
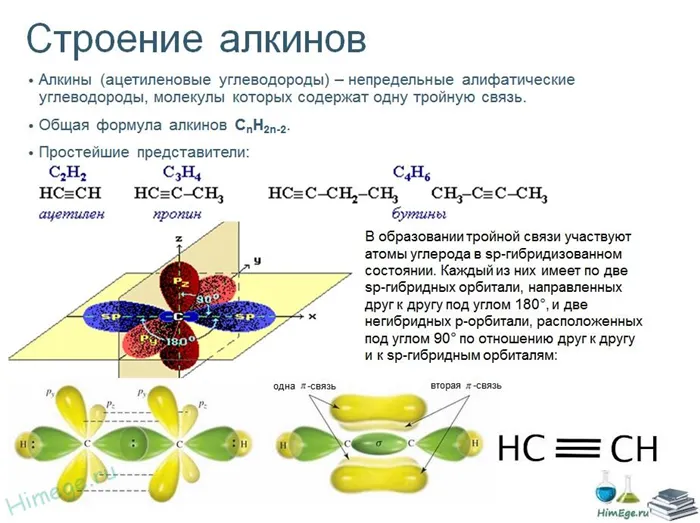
Строение алкинов
Рассмотрим особенности строения алкинов на примере ацетилена.
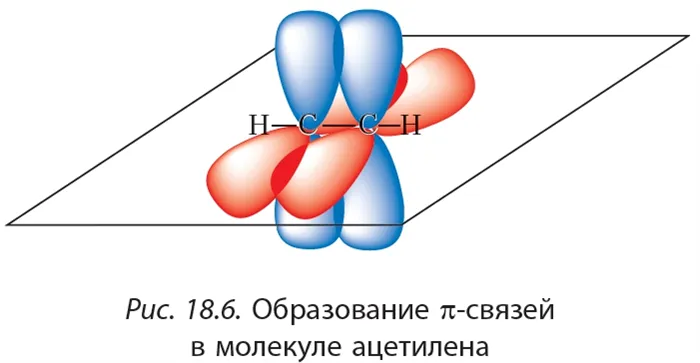
Молекула ацетилена содержит химические связи C-H и C≡C.
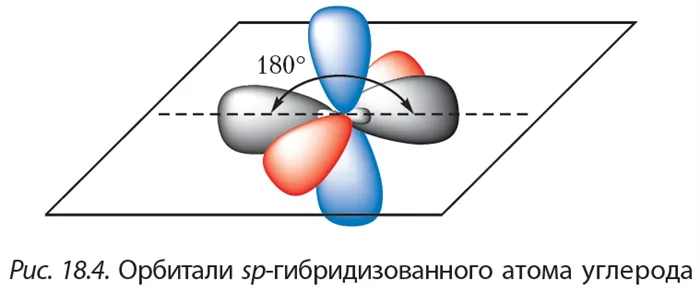
Связь C-H представляет собой ковалентную слабополярную одинарную σ-связь. Связь C≡C — это тройная, ковалентная, неполярная связь, одна из σ-связей, две другие — p-связи. Атомы углерода в тройной связи образуют по две σ-связи и две p-связи. Таким образом, гибридизация атомов углерода в тройной связи в молекулах алкинов является sp:

Когда между атомами углерода образуется σ-связь, гибридные орбитали sp атомов углерода перекрываются:

Когда между атомами углерода образуется π-связь, негибридные орбитали атомов углерода перекрываются:
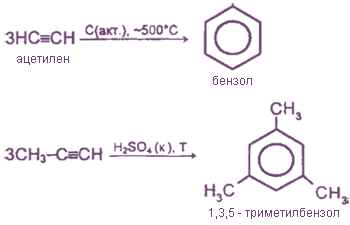
Две гибридные орбитали sp атома углерода отталкиваются друг от друга и расположены в пространстве так, чтобы угол между орбиталями был как можно больше.
Поэтому две гибридные орбитали атомов углерода в тройной связи в алкинах ориентированы в пространстве под углом 180° друг к другу:
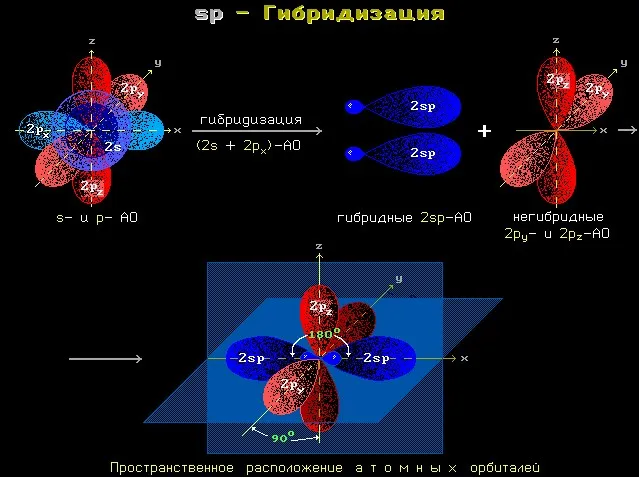
Изображение с сайта orgchem.ru
Это соответствует линейной структуре молекулы.
| Например, молекула ацетилена C2H2соответствует линейной структуре. |
Изображение с сайта orgchem.ru
Молекулы алкинов с большим числом атомов углерода соответствуют пространственной структуре.
| Например, молекула пропина содержит атом углерода в sp 3-гибридном состоянии как часть метильного фрагмента CH3. Этот фрагмент имеет тетраэдрическую структуру. |
Изомерия алкинов
Алкины характеризуются структурными и пространственными изомерами.
Алкины характеризуются изомерией углеродного скелета, изомерией с кратными связями и изомерией между классами.
Структурные изомеры — это соединения одного состава, которые отличаются порядком расположения атомов в молекуле, т.е. структурой молекулы.
Изомеры углеродного скелета различаются по структуре углеродного скелета.
Межклассовые изомеры — это вещества разных классов с разной структурой, но одинаковым составом. Алкины являются изомерами промежуточного класса алкадиенов. Общая формула для алкинов и алкадиенов — CnH2n-2.
Изомеры с различным положением тройной связи отличаются положением тройной связи в углеродном скелете.
Строение молекул
Каждая молекула алкина содержит тройную связь, поэтому особенности свойств этих соединений связаны с особенностями тройной связи. Это сложное, гетерогенное соединение. Он состоит из одной σ-связи и двух π-связей.
Вопрос. Какая из этих связей легче всего разрывается в химических реакциях? Почему?
Поэтому, как и в случае с алкенами, в химических реакциях сначала разрушается более слабая p-связь. Алкины также любят участвовать в химических реакциях, но в отличие от алкенов, большинство реакций проходит в два этапа за счет p-связи: Сначала разрывается одна p-связка, а затем вторая p-связка. Типичной реакцией является реакция сложения, хотя возможны и другие типы реакций.

Свойства алкинов
Физические свойства
По своим физическим свойствам алкины не сильно отличаются от алкенов и алканов. Например, простейший алкин, ацетилен, представляет собой газ без запаха и вкуса, мало растворимый в воде. Гомологи ацетилена включают как жидкие, так и твердые вещества: чем выше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Эти реакции протекают в две фазы:
Вопрос. Возможна ли реакция сложения для полученного соединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
Вопрос. Возможна ли реакция сложения для полученного соединения? Почему?
Таким образом, и этилен, и этан могут быть получены из ацетилена с помощью реакции гидрирования. Все зависит от условий процесса и соотношения исходных материалов. Например, реакцию добавления хлористого водорода к ацетилену часто останавливают на первой стадии:

Причина в том, что хлорвинил используется для производства полимера полихлорвинила.
Задание 20.3: Составьте уравнения реакции полимеризации хлорвинила.
Продукты полихлорвинила (-CNCl-CH2–)nиспользуются различными способами.
Например, полихлорированный винил (ПХВ или ПВХ) является основой для искусственной кожи, различных одноразовых изделий, пластиковых контейнеров, футеровки, отделочных материалов и т.д. Многие пластиковые изделия, которыми мы пользуемся каждый день — обивка автомобилей, вагонов, самолетов — сделаны из ПВХ. Он также используется для изоляции кабелей.
Аналогичным образом происходят и другие реакции адгезии. Например, ацетилен, как и этилен, обесцвечивает бромированную воду. Он также обесцвечивает раствор перманганата калия, т.е. участвует в реакциях окисления.
Задание 20.4: Составьте уравнения для реакции ацетилена с бромом.
Таким образом, ацетилен также приводит к качественным реакциям в p-связи. Поэтому правильнее сказать, что реакции отбеливания воды бромом и перманганатом калия являются качественными реакциями по кратной связи. Другими словами, эти реакции могут быть использованы для обнаружения ненасыщенных соединений с кратной связью, содержащей p-связь.
Большое практическое значение имеет реакция добавления воды к ацетилену — гидратация ацетилена. Поскольку эта реакция была открыта и изучена русским ученым М.Г. Кучеровым*, ее называют «реакцией Кучерова»:
* Кучеров, Михаил Григорьевич (3.06.1850-26.06.1911) — русский химик-органик. Он открыл (1881) каталитическую гидратацию ацетиленовых углеводородов с образованием карбонильных соединений.
Ацетат альдегида используется для получения уксусной кислоты. Ожоги ацетиленом.
Задание 20.5: Напишите уравнение реакции горения ацетилена.
Газообразные углеводороды различают по типу пламени. Так, метан горит бесцветным пламенем, этилен — ярким пламенем, а ацетилен — дымным пламенем, т.е. углерод окисляется не полностью и частично выделяется в виде простого вещества (сажи). В потоке кислорода ацетилен горит ослепительным синим пламенем и выделяет большое количество тепла (температура пламени составляет более 3000 °C!). По этой причине данная реакция используется при газовой сварке и резке металлов.
Получение и применение ацетилена
Ацетилен в небольших количествах входит в состав природных газов. Он образуется при разложении метана:
В небольших количествах, например, для сварки металлов и в лабораторных условиях, его получают из карбида кальция:
Ацетилен, получаемый карбидным методом, используется для сварки и резки металлов, поскольку температура пламени автогенного газа (сгорание ацетилена в кислороде) достигает 3000°C.
Ацетилен и его производные используются в производстве пластмасс, резины, уксусной кислоты и растворителей.

Атомы водорода в ацетилене могут быть замещены металлами (реакция минерализации). В результате образуются металлические производные ацетилена — ацетилены. Эту способность ацетилена можно объяснить следующим образом. Известно, что атомы углерода ацетилена, находящиеся в состоянии гибридизации sp, обладают повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Это немного смещает электронную плотность связи C-H в сторону углерода и придает атому водорода некоторую подвижность:
Образуются нерастворимые соли — ацетилениды. Это возможно только для алкинов, содержащих этинильную групп у-C=CH (так называемые терминальные алкины).
HC ≡ CH + 2CuCl → Cu — C ≡ C — Cu↓ + HCl
Этин → ацетилен двухвалентной меди(I)
CH3— C ≡ CH + CuCl → CH3— C ≡ C- Cu↓ + HCl
Пропен → метилацетилен Медь(I)
Образование темно-красного осадка ацетиленидов меди является качественной реакцией на этинильную группу, позволяющей отличить терминальные алкины от других ненасыщенных углеводородов.

С ацетиленидами в сухом виде следует обращаться очень осторожно: Они очень взрывоопасны.
Реакция изомеризации
Ацетиленовые углеводороды, такие как алканы и алкены, могут изомеризоваться по тройной связи:

Винилацетилен превращается в хлоропрен путем добавления HCl, который полимеризуется в хлоропреновый каучук:
Неполное окисление под действием КМnО4(образуются карбоновые кислоты)
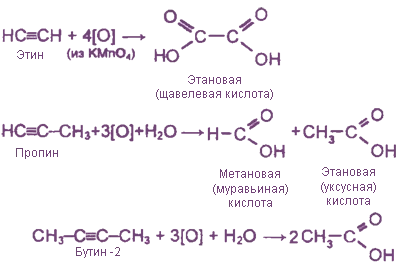
Ацетилены легко окисляются. Ацетилены легко окисляются, так что молекула разрушается по тройной связи. Когда ацетилен пропускают через окислительную среду (водный раствор перманганата калия), раствор быстро обесцвечивается.
Эта реакция является качественной для кратных связей (двойных и тройных):
Химические свойства алкинов.
Химические свойства алкинов объясняются наличием тройной связи в молекуле алкиния. Типичной реакцией для алкинов является реакция присоединения, которая протекает в 2 этапа. На первом этапе происходит присоединение и образование двойной связи, а на втором этапе — присоединение к двойной связи. Реакция алкинов протекает медленнее, чем алкенов, потому что электронная плотность тройной связи более компактна, чем у алкенов, и поэтому менее доступна для реагентов.
1. галогенирование. Галогены присоединяются к алкинам в два этапа. Например,
Алкины также обесцвечивают бром как алкены, поэтому эта реакция также качественна для алкинов.
2. гидрогалогенирование. Галогенированные углеводороды связываются с тройной связью несколько труднее, чем с двойной. Для ускорения этого процесса используется сильная кислота Льюиса AlCl.3. В этих условиях из ацетилена можно получить винилхлорид, который используется для получения полимера поливинилхлорида, имеющего наибольшее промышленное значение:
.
Если галогеноводород присутствует в избытке, реакция (особенно с асимметричными алкинами) протекает по правилу Марковникова:
3. гидратация (добавление воды). Реакция протекает только в присутствии солей ртути(II) в качестве катализатора:
На этапе 1 образуется ненасыщенный спирт, в котором гидроксильная группа расположена у атома углерода, образующего двойную связь. Эти спирты называются виниловыми спиртами или фенолами.
Характерной особенностью этих спиртов является их нестабильность. Они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны) путем переноса протонов от группы OH к углероду двойной связи. В этом случае π-связь (между атомами углерода) разрывается и образуется новая π-связь между атомами углерода и атомом кислорода. Эта изомеризация происходит из-за более высокой плотности двойной связи C=O по сравнению с двойной связью C=C.
Только ацетилен превращается в альдегиды, в то время как его гомологи превращаются в кетоны. Реакция следует правилу Марковникова:
Эта реакция называется реакцией Кучерова.
4. алкины, которые имеют терминальную тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи.
Эта поляризация вызвана сильной электроотрицательностью атома углерода при sp-гидрировании, поэтому алкины могут образовывать соли — ацетилениды:
Ацетиленоиды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через раствор оксида серебра-аммиака или хлорида меди-аммиака). Эти реакции являются качественными для тройной связи на конце:








