Устойчивое состояние определяется дефокусировкой свободной частицы, пространственным фактором и модальным фактором. К основным радикалам относятся: Метил, этил, пропил и изобутилен. Вторичные радикалы — изопропил, изобутилен и третичные радикалы — трет-бутил. Стабилизация увеличивается от первичной к третичной стадии.
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из книги «Химия для чайников» мы узнаем о типах химических реакций; мы подробно рассмотрим каждый тип и научимся их различать.

Мир химических реакций очень разнообразен. В природе постоянно происходит большое количество химических реакций, и люди также осуществляют их. Можно ли классифицировать химические реакции? На каком основании производится классификация? Суть каждой химической реакции заключается в превращении веществ: Исходные вещества разрушаются, образуются продукты реакции, изменяется количество и состав исходных веществ и продуктов реакции. Характер этих изменений является основой для классификации химических реакций.
Реакции соединения
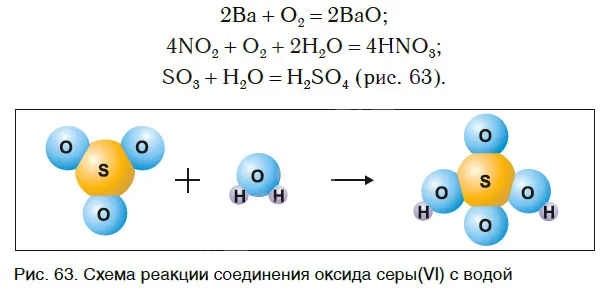
Рассмотрим уравнения следующих реакций (рис. 62):
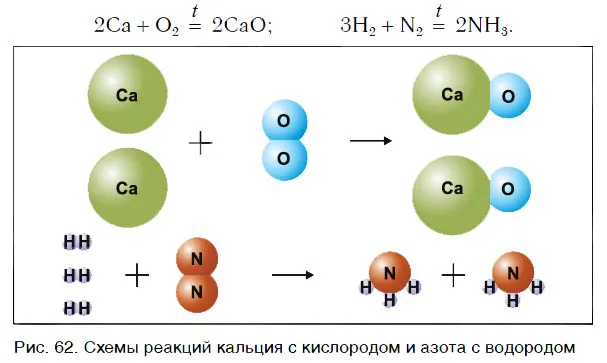
Чем похожи эти реакции? Это происходит потому, что взаимодействие двух веществ приводит к образованию единого вещества. Эти реакции называются реакциями сопряжения.
Сложные реакции — это реакции, в которых два или более веществ соединяются с образованием нового, сложного вещества.
В некоторых случаях два простых вещества объединяются в одно соединение, в то время как в других случаях объединяются два или более простых или сложных веществ:
Реакции разложения
Рассмотрим уравнения следующих реакций:
Обратите внимание, что из одного составного вещества можно получить два или более новых веществ. Если соединение может состоять из двух или более соединений, то могут протекать две или более реакций. В этих реакциях могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в которых из одного сложного вещества образуется несколько новых веществ.
Чтобы привести в движение реакцию разложения, исходные вещества обычно нагревают. CaO известь, например, образуется при нагревании CaCO3известняка, реакция разложения происходит при температуре около 1000 °C. Этот тип реакции представляет собой реакцию разложения метана CH4(рис. 64), компонент природного газа, является одной из таких реакций:

В реакциях нуклеофильного замещения атакующая частица является нуклеофилом, то есть отрицательно заряженной частицей или частицей со свободной электронной парой. Уходящая группа называется нуклеофилом.
Реакции нуклеофильного замещения особенно характерны для алифатических систем.
Общее рассмотрение реакций нуклеофильного замещения:
» width=»» height=»» />
Реакции нуклеофильного замещения обозначаются символом «SN«В целом, различают алифатические (SN) и ароматические (SNAr ) реакции нуклеофильного замещения.
Наиболее распространены два типа реакций нуклеофильного замещения 3:
- SN1 — мономолекулярное нуклеофильное замещение: двухстадийный процесс — на первой (медленной) стадии образуется промежуточный карбкатион, который на второй (быстрой) стадии реагирует с нуклеофилом.
- SN2 — бимолекулярное нуклеофильное замещение: одностадийный процесс без образования интермедиата.
Гидролиз алкилгалогенидов является примером реакции нуклеофильного замещения:
» width=»» height=»» />
Наиболее распространенные нуклеофильные группы 4 :
Реакции электрофильного замещения
В реакции электрофильного замещения атакующая частица является электрофилом, т.е. положительно заряженной или электронодефицитной частицей. Ускользающая частица называется электрофильной.
Реакции электрофильного замещения особенно характерны для ароматических систем.
Общий обзор реакций электрофильного замещения:
» width=»» height=»» />
Реакции электрофильного замещения обозначаются буквой «S».E» .
Для ароматических систем существует только один (основной) механизм электрофильного замещения SEAr, в котором образуется положительно заряженный промежуточный продукт, в котором уходящая группа 3 отщепляется на втором этапе.
В алифатических соединениях оба SE1, а также SE2, аналогично SN1 и SN2 .
Пример реакции электрофильного замещения:
Наиболее распространенные электрофильные группы:
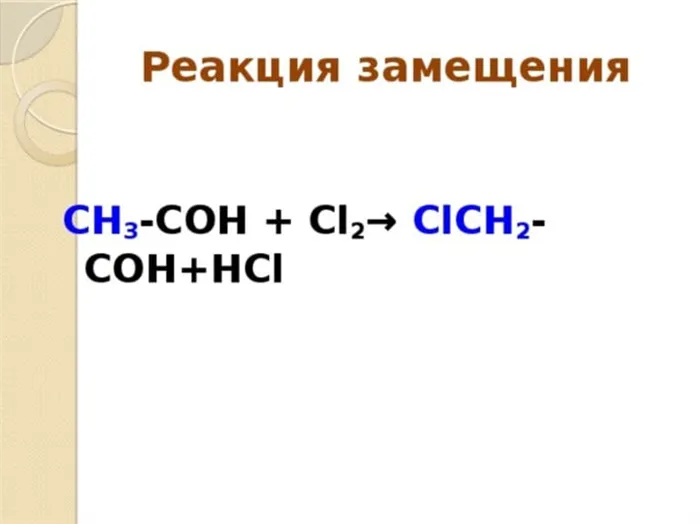
Реакции радикального замещения
В реакции радикального замещения атакующими частицами являются свободные радикалы.
Общий обзор реакций радикального замещения:
\cdot» width=»» height=»» />
Реакции радикального замещения обозначаются буквой «S».R» .
Реакция хлорирования метана, упомянутая выше, является примером реакции радикального замещения.
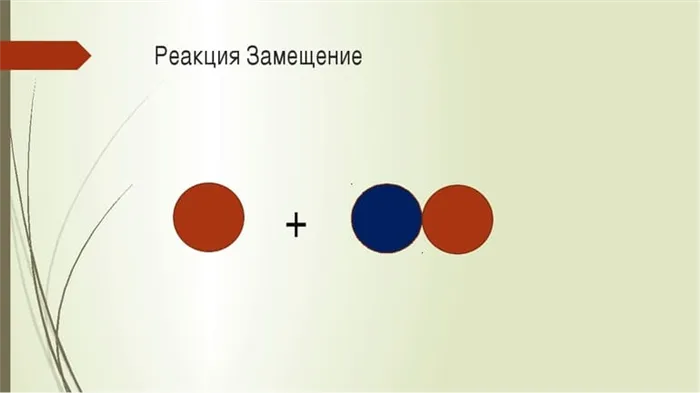
Реакции замещения
Когда атомы простого реактива занимают место одного из химических элементов соединения в физико-химическом взаимодействии веществ, реакция называется реакцией замещения. В результате образуется не одно, а два вещества.
Примером реакции замещения может служить следующий опыт:
- В раствор медного купороса опускают хорошо очищенный кусочек железа – кнопку, гвоздик.
- Извлекают через 2–3 минуты железо.
- На нём образовался налёт меди красного цвета.
Атомы железа были заменены атомами меди.
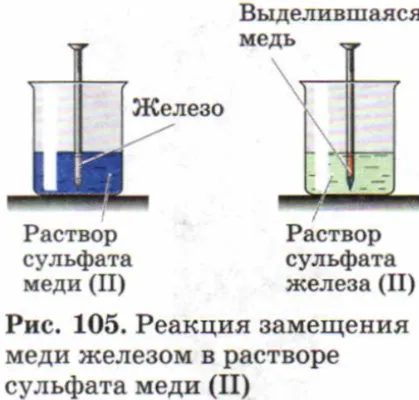
В химической реакции участвуют простое вещество, железо, и сложное вещество, сульфат меди или сульфат меди. Молекулы железа заменили медь. В результате реакции образовались сульфат меди и сульфат железа.
Они делят реакцию замещения на три типа, принимая во внимание состав частиц, участвующих во взаимодействии.
Электрофильные и нуклеофильные реакции
Электрофилы — это частицы, которые имеют недостаточную электронную плотность. Примерами электрофильных частиц являются молекулы хлора и бензола. Поскольку им не хватает электронов, они атакуют молекулу соединения, с которым взаимодействуют.
Примером такой реакции является взаимодействие брома с углеродом. Новая связь образуется за счет свободной пары электронов, освобожденных реагентом. Реагент обязательно имеет положительный заряд. Нуклеофильная реакция характеризуется разрушением углеродной связи. Электронная пара отсоединяется, и образуется положительно заряженный ион углерода.
В нуклеофильной реакции электронная пара, предоставленная реагентом, обобществляется. В этом случае субстрат имеет дефицит положительно заряженных электронов, а реагент — отрицательно заряженных электронов.
Особенностью реакций замещения является то, что они характеризуют свойства простых химических веществ. Из механизмов замещения можно вывести следующее:
-
Щелочные и щелочноземельные металлы активно взаимодействуют с водой, вытесняя молекулу водорода. Некоторые щелочные металлы могут воспламеняться или даже взрываться во время механизма замещения.
Реакции замещения характерны для алкенов, молекулы которых содержат двойную связь. Галогенирование, гидратация и гидрогалогенирование считаются реакциями замещения. Поскольку в реакциях участвуют вещества с двойными и тройными связями, здесь наблюдается как замещение с образованием свободного радикала, так и присоединение водорода к гидрированному атому углерода.
Эти процессы происходят как экзотермически, т.е. с выделением тепла, так и эндотермически, т.е. с поглощением тепла.
Реакции замещения

Этот видеофрагмент объясняет учащимся природу реакций замещения, знакомит их с рядом действий металлов и предсказывает ход реакций между металлами и кислотами, металлами и солями. Урок включает несколько демонстраций, которые помогут учащимся описать лабораторный эксперимент по данной теме.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам необходимо добавить его в свой личный кабинет.

2. распространить видеоуроки в ваших личных кабинетах среди ваших учеников.
3. Смотрите статистику просмотра видеоуроков учениками.
Конспект урока «Реакции замещения»
Проведем эксперимент английского химика Г. Кавендиша: Наполните пробирку раствором соляной кислоты и положите в нее несколько цинковых шариков. Мы можем наблюдать выделение пузырьков газа. Мы собираем этот газ, вытесняя воздух, потому что выделяющийся газ, водород, легче воздуха. Когда накопится достаточное количество газа, подносим пробирку с газообразным водородом к пламени зажигалки, после чего происходит взрыв, сопровождаемый «лающим» звуком. Этот взрыв происходит из-за смешивания водорода и воздуха.

Смесь из 2 объемов водорода и 1 объема кислорода называется «топливный газ». Если собрать чистый водород и поднести пробирку к горелке, вы услышите легкий хлопающий звук, вызванный сгоранием чистого водорода. Откуда берется водород в реакции и какие еще продукты образуются?
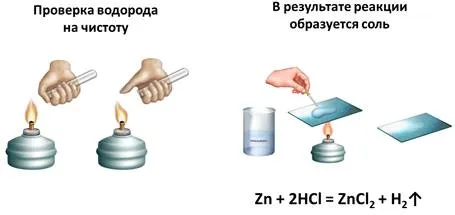
В результате этой реакции — между цинком и соляной кислотой — образуется соль (хлорид цинка). Это можно продемонстрировать, поместив немного этого раствора на предметное стекло и выпарив его. В результате вода испаряется, и на предметном стекле образуются кристаллы соли. Давайте теперь составим уравнение для этой реакции: Цинк и соляная кислота реагируют и образуют соль под названием хлорид цинка с выделением водорода.
Zn + 2 HCl = ZnCl2+ H2↑
Давайте проведем эксперимент с дугой. Налейте раствор соляной кислоты в четыре пробирки. В первую пробирку положите кальций, во вторую — магний, в третью — цинк, в четвертую — медь. Если наблюдать за процессом, то во всех ли случаях выделяется водород, потому что металл и соляная кислота реагируют друг с другом? Наиболее интенсивное выделение водорода наблюдается в первой пробирке, где металлом был кальций, во второй пробирке — с металлом магнием — менее интенсивное, с цинком еще менее интенсивное, а с медью реакция не происходит, так как не наблюдается выделение водорода.
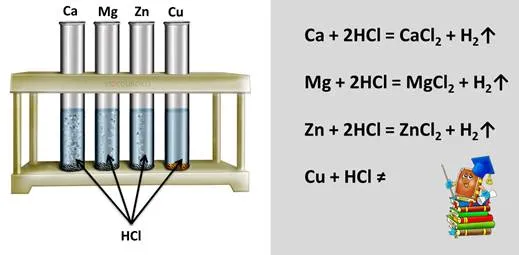
Поэтому, чтобы предсказать реакцию между металлом и кислотой, необходимо использовать ряд активности металла или ряд напряжения металла. Как видите, в этом ряду есть и водород, который не является металлом. Металлы в ряду металлов перед водородом способны вытеснять его из кислых растворов, в то время как металлы после водорода такой способностью не обладают.
Наиболее активные металлы находятся в начале ряда, а наименее активные — в конце. Поскольку кальций более активен, выделение водорода в кислом растворе более выражено, чем у магния или цинка. Медь не вытесняет водород из кислого раствора, потому что этот металл находится в конце ряда. Вы убедились в этом на собственном опыте.
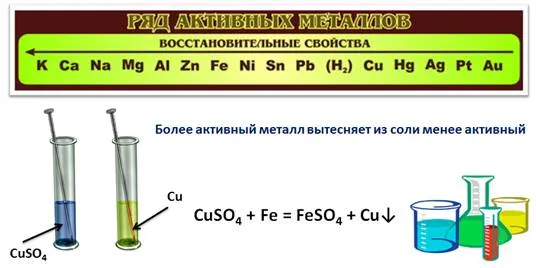
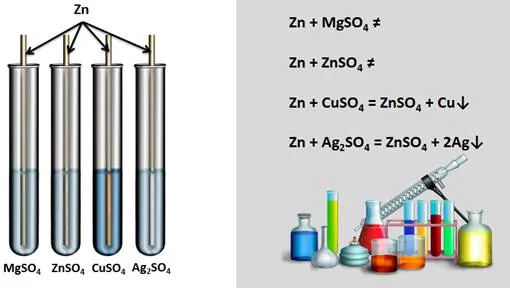
Ряд активности металлов также используется для прогнозирования реакций между металлом и раствором соли. Для этого нужно знать, что более активный металл вытесняет менее активный из солевого раствора.
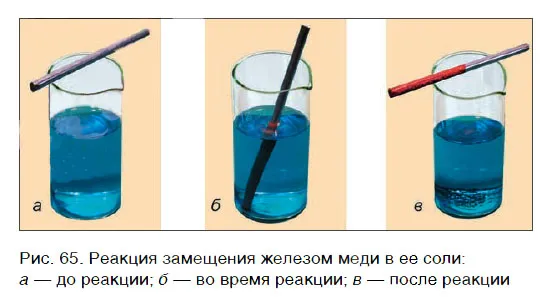
Проведем эксперимент: поместим железный гвоздь в мензурку с раствором сульфата меди(II). Через некоторое время на ногте появляется красный налет, а солевой раствор меняет цвет. Красный осадок — это выделившаяся медь, раствор изменил цвет, потому что в результате реакции образовался раствор сульфата железа(II).








