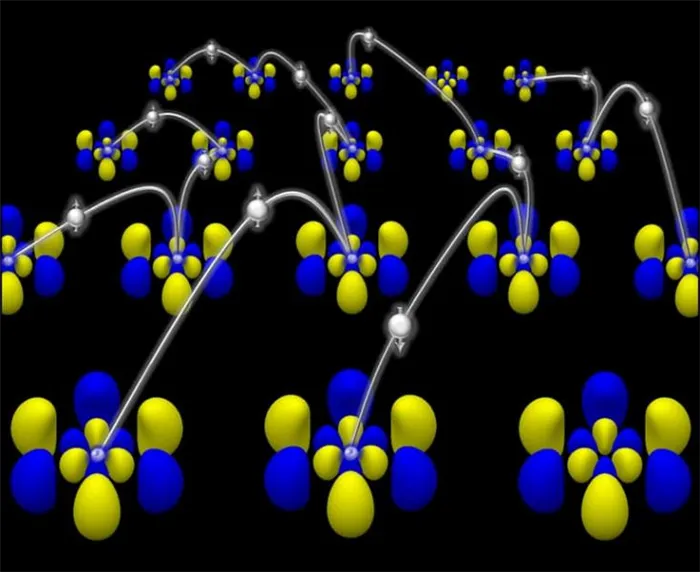
Ионные связи обычно возникают между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, в то время как атомы неметаллов легко связывают их с собой.
Типы кристаллических решёток
В этом видеоклипе студенты могут сделать выводы об унитарном характере химической связи. Примеры показывают свойства веществ в зависимости от природы химической связи.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам необходимо добавить его в свой личный кабинет.
2. Распределите видеоуроки по личным кабинетам ваших учеников.
3. Смотрите статистику просмотра видеоуроков учениками.
Конспект урока «Типы кристаллических решёток»
Чтобы определить тип кристаллической решетки, сделайте следующее. Если связь в соединении ионная, то и кристаллическая решетка всегда ионная: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
Если связь металлическая, то кристаллическая решетка всегда металлическая: латунь, железо, медь, натрий.
Если это ковалентная связь, то решетка может быть атомной или молекулярной. К веществам с атомной решеткой относятся карборунд, оксид кремния, бор, кремний, алмаз, графит, черный и красный фосфор.
В веществах с молекулярной решеткой молекулы расположены в узлах кристаллической решетки, и прочность этой связи слабая.
Характеристики решетчатых молекул — низкие точки плавления, легкость плавления и летучесть, сильная сжимаемость, периодический запах и явления сублимации или возгонки, такие как йод и твердый диоксид углерода.
Растворимость веществ с молекулярной кристаллической решеткой низкая, и большинство из них растворимы в воде. Газы и жидкости в твердом агрегатном состоянии имеют молекулярную кристаллическую решетку. Например, йод, сера, белый фосфор, углекислый газ и большинство органических соединений являются кристаллическими.

В веществах с атомной кристаллической решеткой атомы расположены в узлах. Связи между атомами в кристаллической решетке ковалентные и очень прочные. Эти вещества характеризуются высокой температурой кипения и плавления, что означает, что они огнестойкие, нелетучие, очень твердые, почти нерастворимые в воде и не имеют запаха.
Примерами веществ с таким типом кристаллической решетки являются алмаз и графит.
Известно, что твердость алмаза имеет наивысшее значение твердости по Моосу — 10. Благодаря своей высокой твердости алмаз используется для изготовления сверл, буровых коронок, шлифовальных инструментов и стеклорезов. Алмаз — камень ювелиров, которые используют бриллианты.
Графит также является веществом с атомной кристаллической решеткой, но он все еще мягкий, поскольку имеет слоистую структуру. В решетке графита атомы углерода соединены в плоскости, образуя правильные шестиугольники. Связи между слоями слабые, что означает, что графит мягкий. Как и алмаз, графит является тугоплавким материалом. Он используется для изготовления электродов, твердых смазочных материалов, свинцовых слитков и регуляторов нейтронов в ядерных реакторах.
Не только простые вещества имеют атомные кристаллические решетки, но и сложные вещества. Например, все виды оксида алюминия. Например, изумруд, корунд, рубин и сапфир.
Что такое кристаллическая решетка
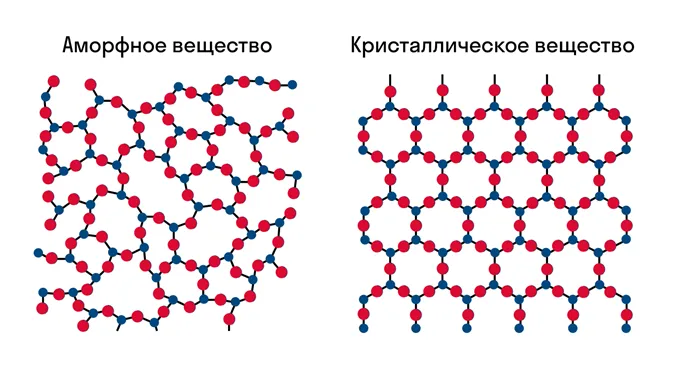
Известно, что все вещества состоят из частиц — атомов, которые могут быть расположены хаотично или в определенном порядке. В аморфных веществах частицы расположены хаотично, в то время как в кристаллических веществах они образуют определенную структуру. Такая структура называется кристаллической решеткой. Он определяет такие свойства, как твердость, хрупкость, температура кипения и/или плавления, деформируемость, растворимость, электропроводность и т.д.
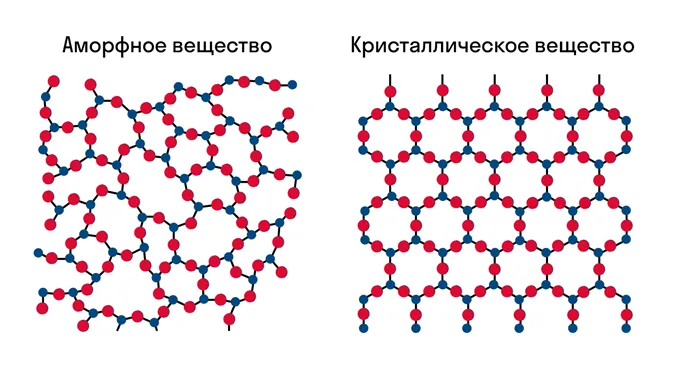
Решетка — это внутренняя структура кристалла, порядок, в котором расположены атомы, ионы или молекулы. Точки, в которых расположены частицы, называются узлами решетки.
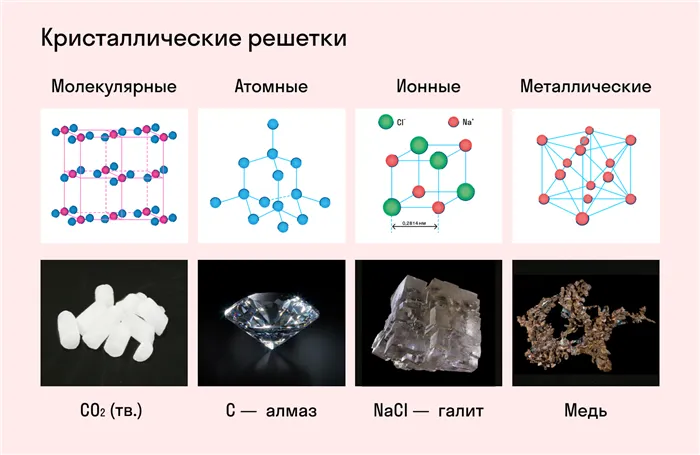
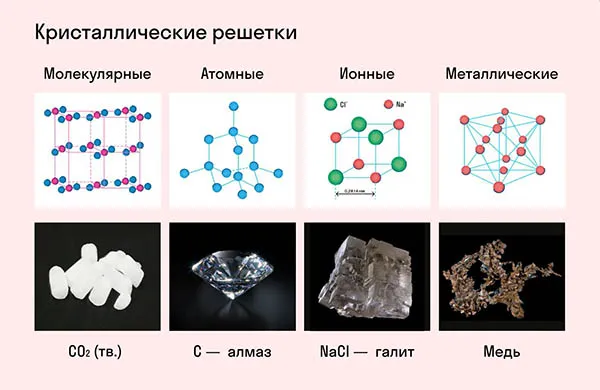
Частицы удерживаются на месте с помощью химических связей. В зависимости от типа связи, удерживающей атомы или ионы конкретного вещества вместе, в химии различают основные типы кристаллических решеток:
- атомная (ковалентные связи),
- молекулярная (ковалентные связи и притяжение между молекулами),
- металлическая (металлические связи),
- ионная (ионные связи).
Не путайте два понятия — кристаллическая решетка и химическая связь. Тип решетки показывает, как атомы/ионы расположены в молекуле вещества, а тип связи — как они взаимодействуют друг с другом.
Бесплатный урок для современных мам и пап от Екатерины Мурашовой. Зарегистрируйтесь и примите участие в розыгрыше 8 уроков

Атомная кристаллическая решетка
Как следует из названия, кристаллическая решетка — это структура, в которой атомы расположены в виде узлов. Они взаимодействуют посредством ковалентных связей, что означает, что один атом отдает свободный электрон другому атому, или электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы плотно связаны друг с другом, что обуславливает ряд физических свойств.
Свойства веществ с атомными решетками:
- прочность,
- твердость,
- неспособность к растворению в воде,
- высокая температура кипения и плавления.
Например, алмаз, самый твердый минерал в мире, имеет атомную решетку.
Другие примеры — германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если вы хотите объяснить свойства веществ с атомной решеткой, просто подумайте о песке и перечислите его свойства.
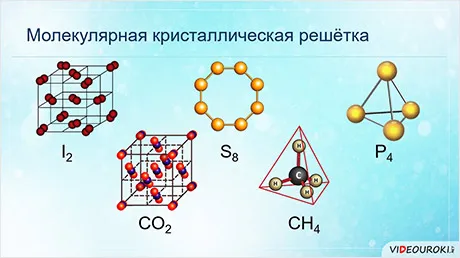
Молекулярная кристаллическая решетка
Как и предыдущая группа, она содержит вещества с ковалентными связями между атомами. Однако физические свойства этих веществ совершенно разные — они легко плавятся, становятся жидкими и растворяются в воде. Почему это так? Причина в том, что кристаллы состоят не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой вместо атомов находятся молекулы.
Атомы внутри молекул имеют прочные ковалентные связи, но сами молекулы связаны лишь слабо. В результате кристаллы этих веществ становятся хрупкими и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре он жидкий, но при нагревании до температуры кипения (которая относительно низка) он сразу же начинает испаряться, т.е. становится газообразным.
Некоторые молекулярные вещества — например, сухой лед CO2способны переходить из твердого состояния в газообразное без перехода в жидкое (этот процесс называется сублимацией).
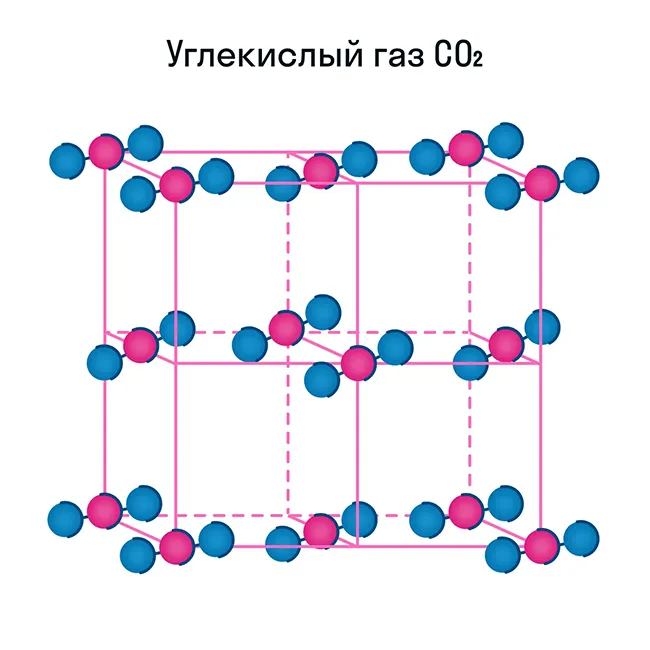
Свойства молекулярных веществ:
- небольшая твердость;
- низкая прочность;
- легкоплавкость;
- летучесть;
- у некоторых — наличие запаха.
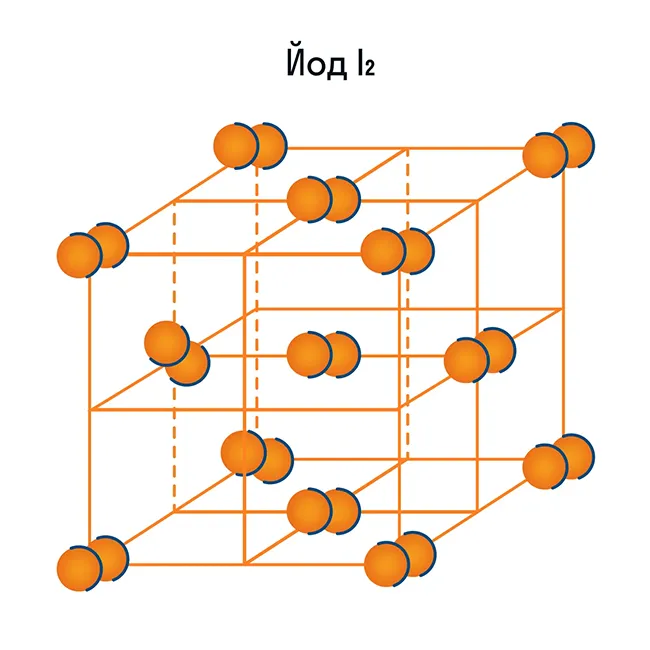
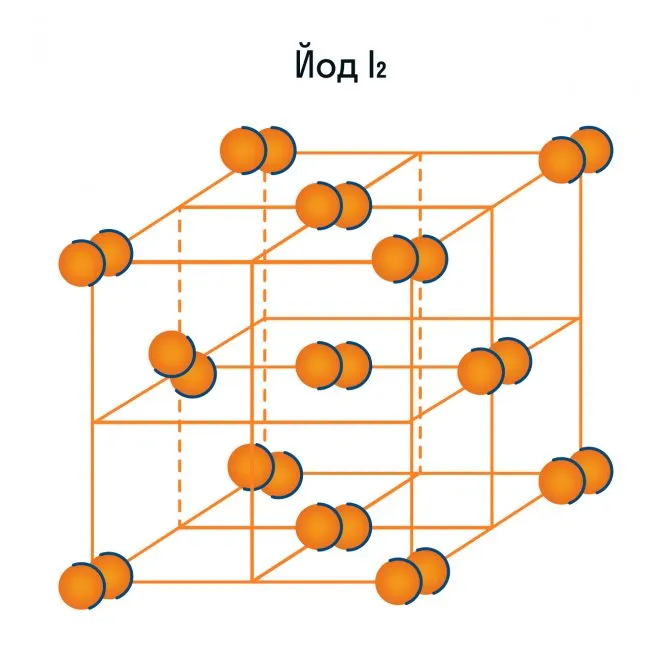
Помимо воды, к веществам с молекулярной кристаллической решеткой относится аммиак N H3гелий He, радон Rn, йод I, азот N2и другие. Все благородные газы являются молекулярными веществами. Большинство органических соединений (например, сахар) также относятся к этой группе.
Занимайтесь 15 минут в день. Освоить английскую грамматику и лексику. Сделайте язык частью своей жизни.

Общая характеристика
Существует большое количество кристаллических структур. Они связаны главным свойством кристаллического состояния вещества — нормальным положением атомов в кристаллической решетке. Одно и то же вещество может кристаллизоваться в разных кристаллических решетках и иметь совершенно разные свойства (классический пример графита — алмаз). В простых веществах это явление называется аллотропией; в общем случае любого химического соединения оно называется полиморфизмом. В то же время различные вещества могут образовывать похожие или изоморфные сети, например, сети из нескольких металлов: Медь, алюминий, серебро и золото. Иногда атомы кристаллической решетки заменяются атомами другого химического элемента, образуя твердый раствор.
Все системы кристаллических решеток можно разделить на семь кристаллических систем в соответствии с их пространственной симметрией. Их можно разделить на шесть вкладов в зависимости от формы элементарной ячейки. Все возможные комбинации осей вращательной симметрии и зеркальных плоскостей симметрии в кристаллической решетке приводят к разделению кристаллов на 32 класса симметрии, а с учетом осей спиральной симметрии и плоскостей симметрии скольжения — на 230 пространственных групп.
В дополнение к основным смещениям, на которых основана элементарная ячейка, кристаллическая решетка может содержать дополнительные смещения, так называемые решетки Браве. Трехмерные решетки бывают гранецентрированными (F), оноцентрированными (I), базисноцентрированными (A, B или C), первичными (P) и ромбоэдрическими (трансляции состоят из нескольких векторов (a, b, c), Поэтому система перевода, ориентированная на тело, включает четыре вектора (a, b, c, ½(a+b+c)), а система, ориентированная на человека, — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). (a+c)), а C равно (a, b, c, ½(a+b)), с центром на одной из граней элементарного объема)).
Виды решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов, из которых мы упомянем наиболее распространенные:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярно-кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее все типы кристаллических решеток будут описаны более подробно.

Молекулярная кристаллическая решетка
Как и предыдущая группа, эта группа включает вещества с ковалентными связями между атомами. Однако физические свойства этих веществ совершенно разные: они легко плавятся, становятся жидкими и растворяются в воде. Почему так происходит? Потому что кристаллы состоят не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой вместо атомов находятся молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны лишь слабо. Поэтому кристаллы этих веществ хрупкие и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре он жидкий, но как только его нагревают до температуры кипения (которая относительно невысока), он сразу же начинает испаряться, т.е. переходит в газообразное состояние.
Некоторые молекулярные вещества, например, сухой лед CO2, можно сразу перевести из твердого состояния в газ, минуя жидкое состояние (этот процесс называется парообразованием).
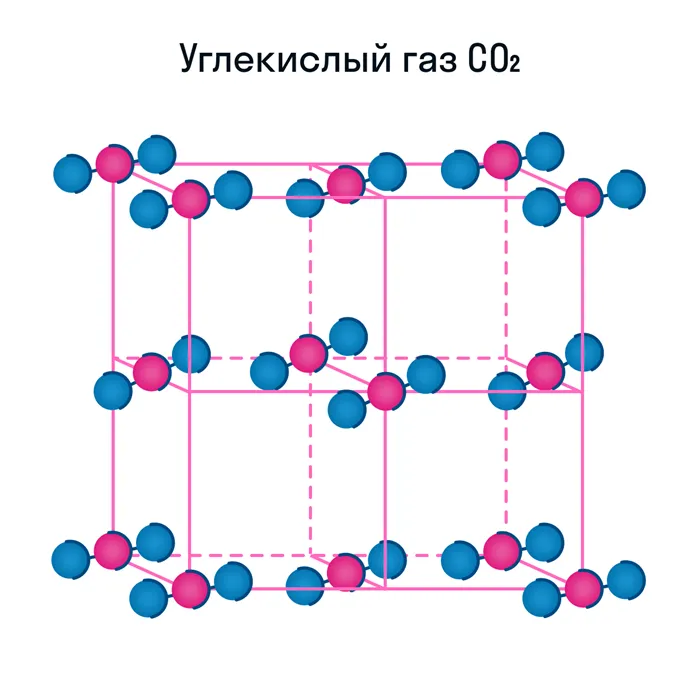
Свойства молекулярных веществ:
- небольшая твердость;
- низкая сила;
- плавкость;
- волатильность;
- некоторые имеют запах.
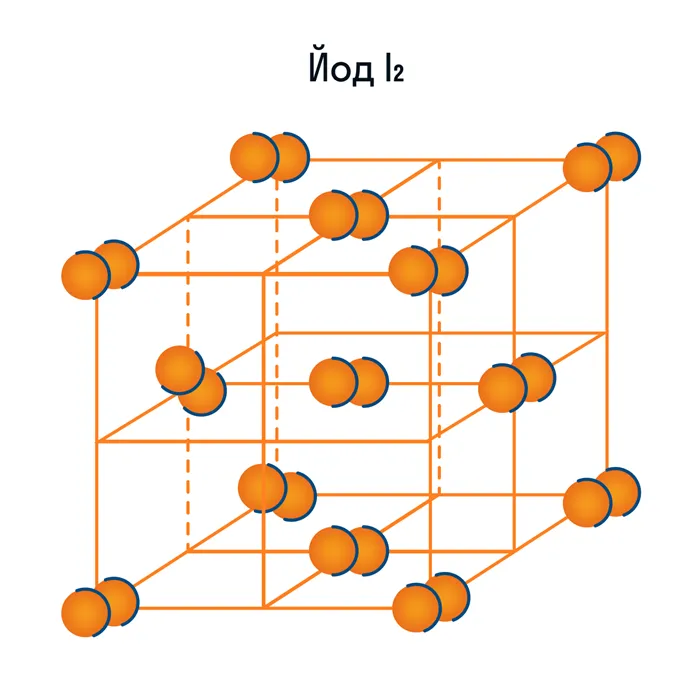
Кроме воды, к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы являются молекулярными веществами. Большинство органических соединений (например, сахар) также относятся к этой группе.
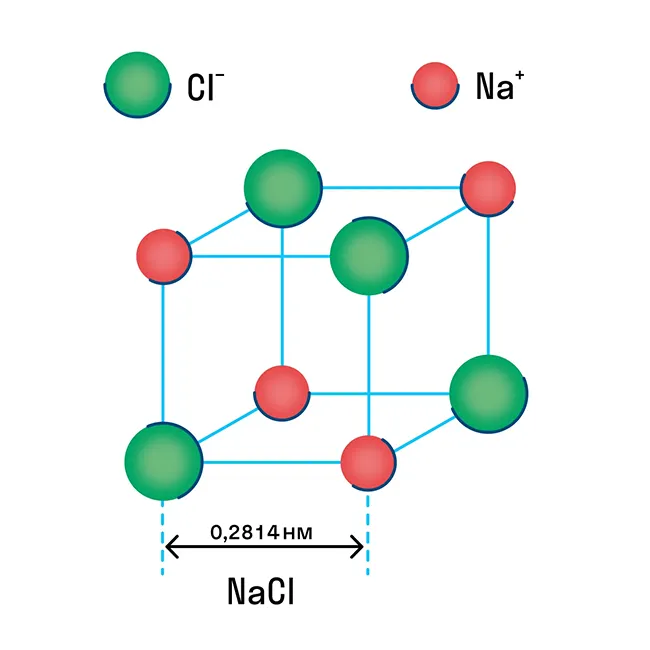
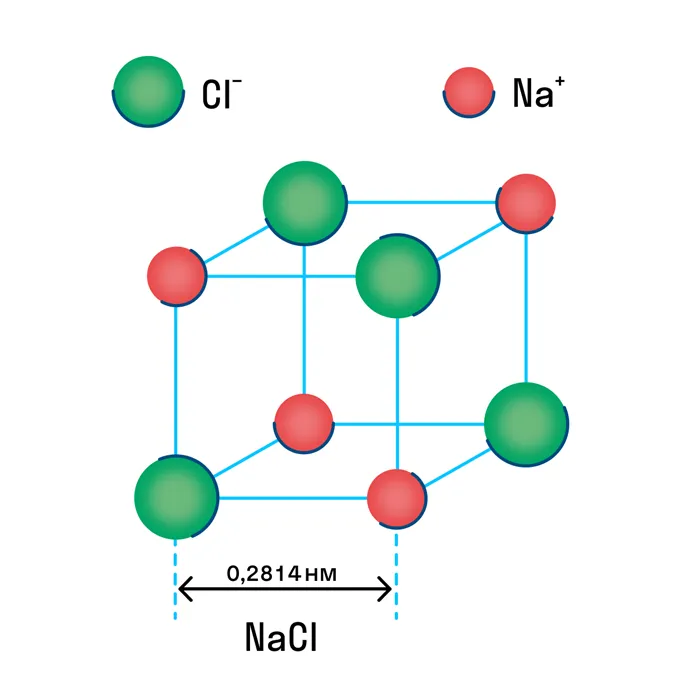
Ионная кристаллическая решетка
Известно, что в химической ионной связи один атом отдает ион другому и заряжен положительно, а принимающий атом заряжен отрицательно. В результате образуются противоположно заряженные ионы, которые формируют кристаллическую структуру.
Ионная решетка — это кристаллическая структура, в узлах которой находятся ионы, связанные друг с другом взаимным притяжением.
Почти все соли имеют ионную кристаллическую решетку; типичным примером является поваренная соль NaCl. Вы должны иметь это в виду, когда вам нужно будет перечислить физические характеристики этой группы. Щелочи и оксиды активных металлов также имеют ионную сеть.
Свойства веществ с ионной структурой:
- твердость;
- хрупкость;
- неплавкость;
- отсутствие волатильности;
- электропроводность;
- способность растворяться в воде.
Примерами веществ с ионной кристаллической решеткой являются оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Молекулярно-кинетическая теория
Все молекулы состоят из крошечных частиц — атомов. Все открытые на сегодняшний день атомы перечислены в периодической таблице.
Атом — это наименьшая химически неделимая частица материи, которая сохраняет свои химические свойства. Атомы соединены друг с другом химическими связями. Ранее мы рассмотрели типы химических связей и их свойства. Обязательно изучите теорию предмета: Типы химических связей перед изучением этой статьи!
Теперь давайте посмотрим, как частицы могут объединяться, образуя материю.
В зависимости от положения частиц по отношению друг к другу, свойства образуемых ими веществ могут быть очень разными. Таким образом, если частицы находятся очень далеко друг от друга (расстояние между частицами намного больше, чем сами частицы), почти не взаимодействуют друг с другом и хаотично и непрерывно перемещаются в пространстве, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, сильнее взаимодействуют друг с другом, интенсивно движутся, колеблясь в одном положении, но могут перескочить в другое положение, то мы имеем дело с моделью текучей структуры.
Если частицы расположены близко друг к другу, но более упорядочены, сильнее взаимодействуют друг с другом и движутся только в пределах положения равновесия и почти никогда не переходят в другие положения, то мы имеем дело с твердым телом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример — вода. При нормальных условиях он находится в жидком состоянии, при 0°C он замерзает — переходит из жидкого состояния в твердое, а при 100°C он закипает — переходит в газообразную фазу — водяной пар. В то же время многие вещества при нормальных условиях являются газообразными, жидкими или твердыми. Воздух, например, смесь азота и кислорода, при нормальных условиях является газом. Однако при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используется в промышленности. Иногда плазму и жидкие кристаллы выделяют как отдельные фазы.

Многие свойства отдельных веществ и смесей можно объяснить взаимным расположением частиц в пространстве!
В данной работе свойства твердых тел изучаются на основе их структуры. Наиболее важными физическими свойствами твердых тел являются: Температура плавления, электропроводность, теплопроводность, механическая прочность, деформируемость и т.д.
Температура плавления — это температура, при которой вещество переходит из твердого состояния в жидкое и наоборот.

Пластичность — это способность вещества деформироваться без разрушения.

Электропроводность — это способность вещества проводить электричество.
Электричество — это равномерное движение заряженных частиц. Поэтому только вещества с движущимися заряженными частицами могут проводить электричество. Вещества делятся на проводники и диэлектрики в зависимости от их способности проводить электричество. Проводники — это вещества, которые могут проводить электричество (т.е. содержат движущиеся заряженные частицы). Диэлектрики — это вещества, которые практически не проводят электричество.
Атомные кристаллические решетки
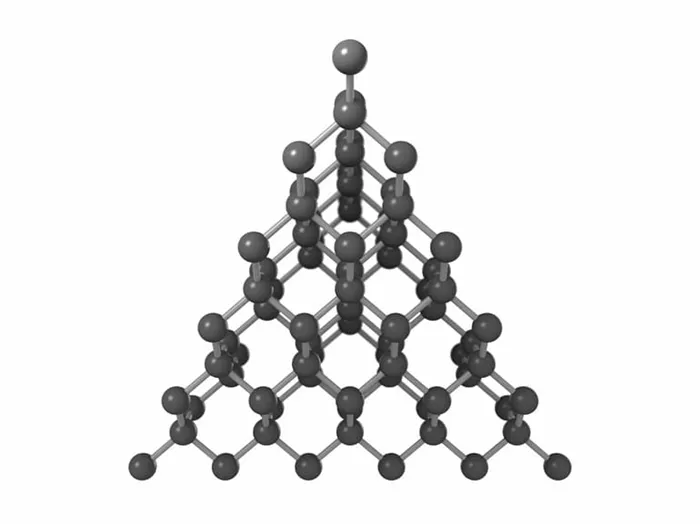
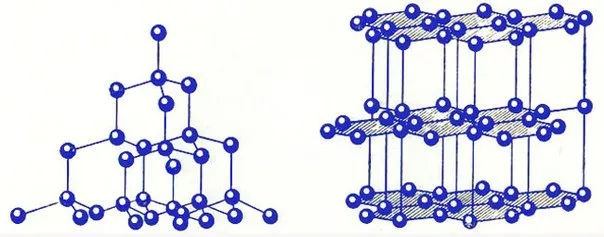
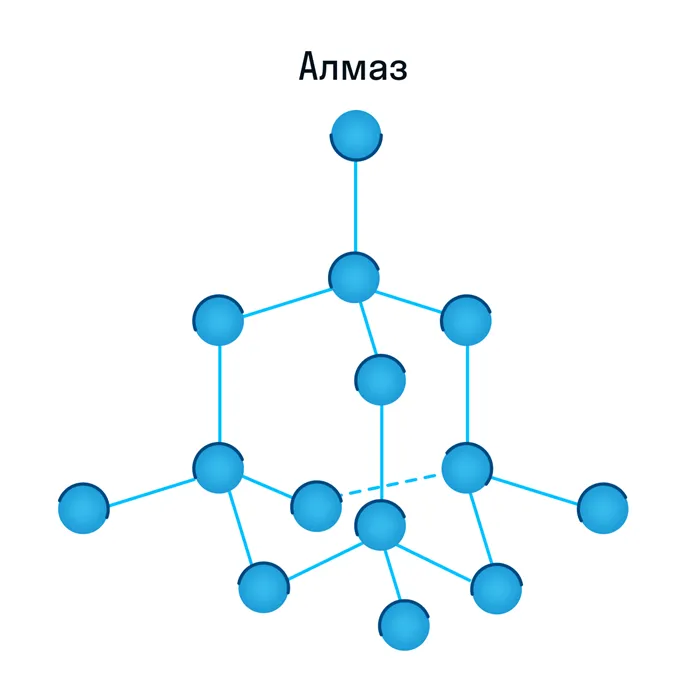
Атомные решетки — это решетки, в узлах которых расположены отдельные атомы. В этом типе решетки атомы соединены друг с другом прочными ковалентными связями. Алмаз является типичным примером вещества с такой решеткой.
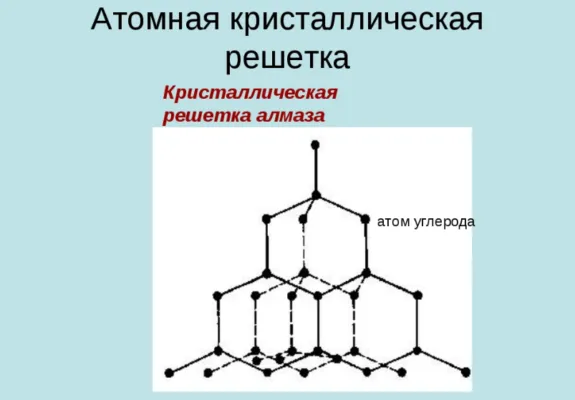
Это минерал (часть минеральной породы), относящийся к С-модификации углерода (химическая формула). Элементарная ячейка алмаза представляет собой куб, в каждой вершине которого находится по одному атому. Также есть по одному атому на каждой стороне и еще четыре атома внутри куба. Атомы соединены очень прочными ковалентными связями. Такая структура и «упаковка» считается самой плотной. Это приводит к высокому значению твердости.
Вещества с атомной кристаллической решеткой характеризуются не только высокой твердостью, но и высокими температурами плавления (Tтемпература плавления= 3500 0 C) и низкой растворимостью.
После специальной огранки бриллиантов их можно превратить в самые популярные ювелирные изделия: Бриллианты. В промышленности алмазы используются в качестве абразивов (материалов для обработки поверхности) и твердых покрытий для инструментов. Кстати, несмотря на высокую твердость, алмаз довольно хрупок и может быть разбит резким ударом.
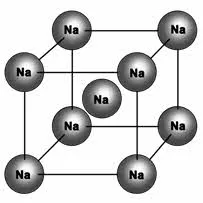
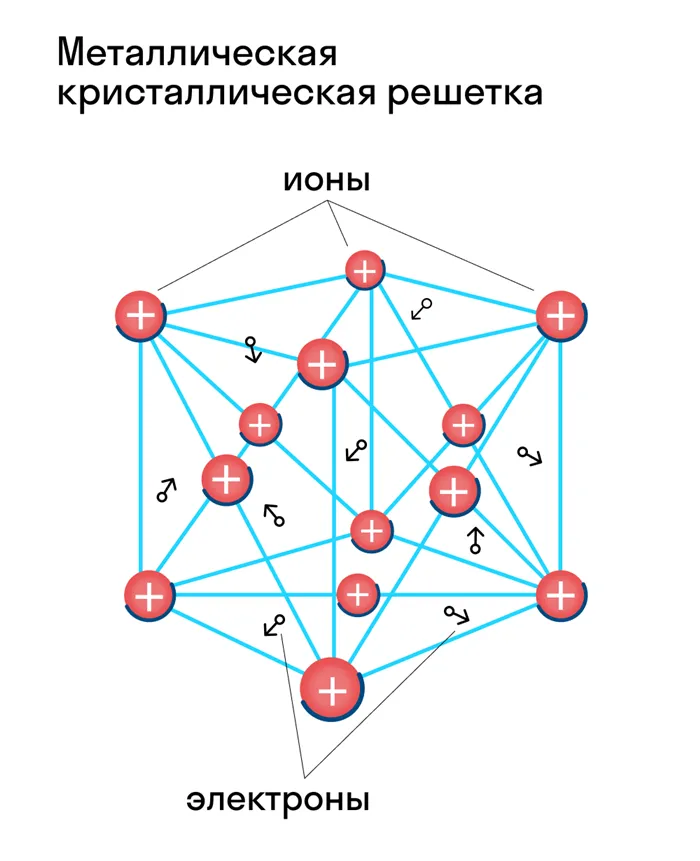
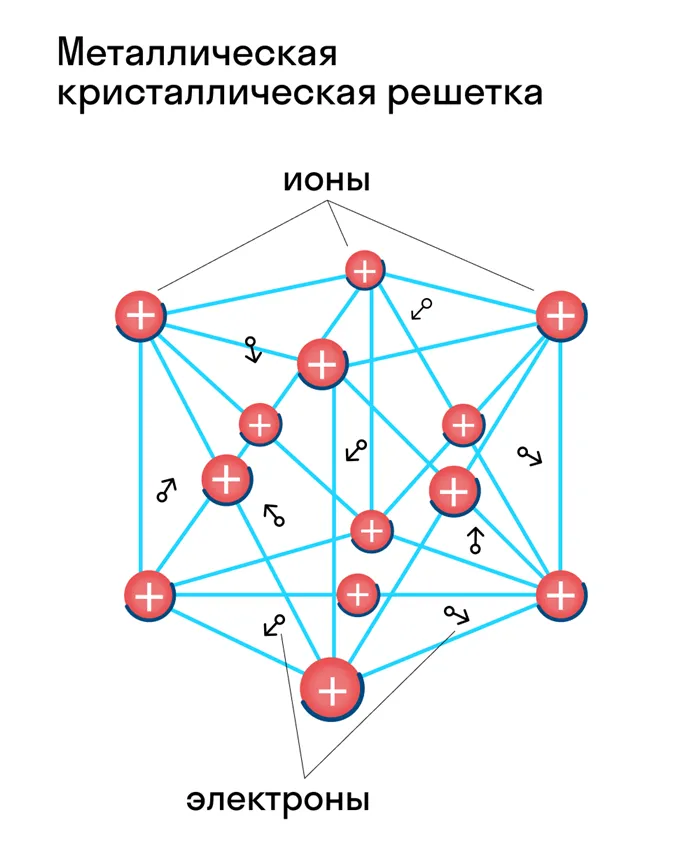
Металлические кристаллические решетки
Атомы и ионы (атомы превращаются в ионы путем высвобождения электронов с их внешних орбит) расположены в узлах этих решеток. Эта структура определяет основные физические свойства металлов: Пластичность, ковкость, высокая тепло- и электропроводность, непрозрачность и блеск, присущие металлам.
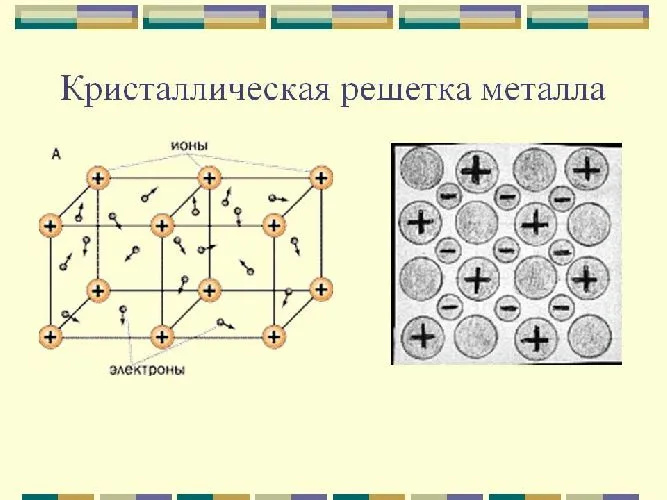
Металлические и атомные кристаллические решетки очень похожи, но их физические свойства сильно отличаются. В отличие от веществ с атомной решеткой (например, алмаза), все металлы обладают высокой электропроводностью и теплопроводностью. Тип связи в этих решетках называется металлическим. К таким веществам относятся все металлы (Fe, Hg, Cu, Na и т.д.) и металлические сплавы.
Ионные кристаллические решетки
Отрицательно и положительно заряженные ионы располагаются в узлах ионной решетки, и между ними образуется отдельный тип связи — ионная связь. Ионы могут быть как одиночными (Na +, Cl — ), так и комплексными (SiO4Ионная решетка характерна для оксидов и гидроксидов металлов. Решетка поваренной соли, например, представляет собой куб, в котором в узлах чередуются положительные ионы Na+ и отрицательные ионы Cl-.
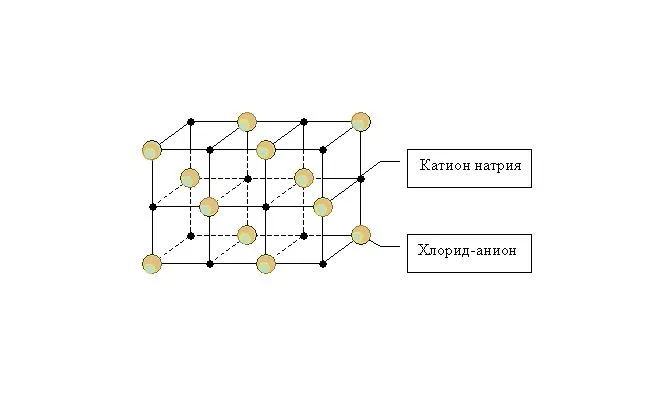
Металлические связи характеризуются высокой стабильностью. Вещества с таким типом решетки имеют высокие показатели твердости и прочности. Ионные соединения имеют высокие температуры кипения и плавления. Однако многие ионные вещества хорошо растворимы в воде.
Примеры ионных веществ: Хлорид натрия (NaCl), соленая вода (NH4NO3), сульфат алюминия (Al2(SO4)3), исландский полевой шпат (CaCO3).
Исландский полевой шпат обладает широким спектром полезных оптических свойств. Он используется в более чем 200 типах оптических приборов: Микроскопы, поляриметры, калориметры, спектрофотометры, дальномеры, сахарометры, лазеры и т.д.
Атомная кристаллическая решетка
Как следует из названия, кристаллическая решетка — это структура, в которой атомы расположены в виде узлов. Они взаимодействуют посредством ковалентных связей, что означает, что один атом отдает свободный электрон другому атому, или электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы плотно связаны друг с другом, что обуславливает ряд физических свойств.
Свойства веществ с атомными решетками:
- прочность,
- твердость,
- неспособность к растворению в воде,
- высокая температура кипения и плавления.
Например, алмаз, самый твердый минерал в мире, имеет атомную решетку.
Читайте также: Изготовление искусственного камня в домашних условиях
Другие примеры — германий Ge, кремний Si, нитрид бора BN, карборунд SiC. Типичным примером является песок, который по сути является оксидом кремния Si O
Если вы хотите объяснить свойства веществ с атомной решеткой, просто подумайте о песке и перечислите его свойства.
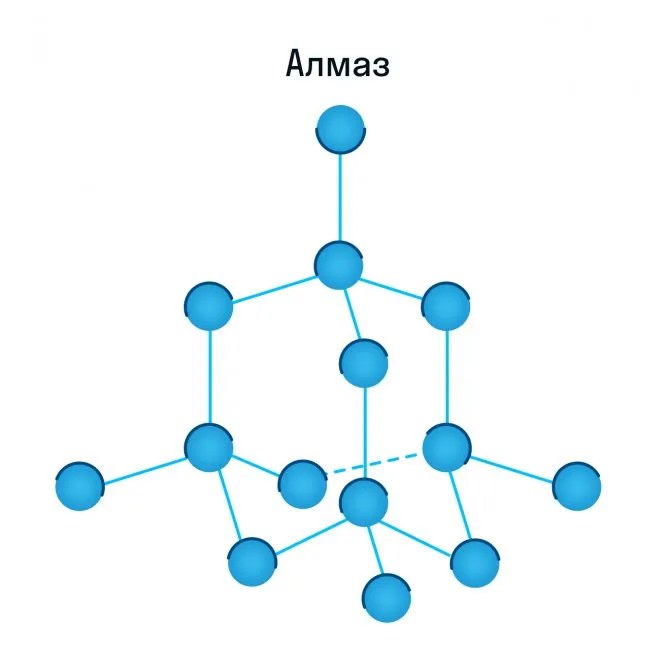
Физические и химические свойства
Химическая формула минерала — C. Кристалл хорошо проводит тепло, но не проводит электричество (или проводит очень мало). Он обладает хорошими преломляющими и отражающими свойствами.
Он плавится при температуре выше 3700 градусов. В сочетании с кислородом он горит при температуре более 721 градуса. Устойчивость к воздействию кислот и щелочей.
- Цвет: бесцветный, прозрачный. Возможны оттенки голубого, желтого, синего, розового, красного, бурого, черного.
- Форма: кристалл с разным количеством граней.
- Блеск: сильный алмазный.
- Плотность: 3,5 г/см3.
- Твердость: абсолютная, 10 баллов. Но при этом камень очень хрупкий.
- Спайность: средняя.
- Электропроводность: слабая или отсутствует.
- Люминесцирует при ультрафиолете.
- Под действием рентгеновского излучения снижается прочность связей.
Молекулярная кристаллическая решетка
Как и предыдущая группа, она содержит вещества с ковалентными связями между атомами. Однако физические свойства этих веществ совершенно разные — они легко плавятся, становятся жидкими и растворяются в воде. Почему это так? Причина в том, что кристаллы состоят не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой вместо атомов находятся молекулы.
Атомы внутри молекул имеют прочные ковалентные связи, но сами молекулы связаны лишь слабо. В результате кристаллы этих веществ становятся хрупкими и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре он жидкий, но при нагревании до температуры кипения (которая относительно низка) он сразу же начинает испаряться, т.е. становится газообразным.
Некоторые молекулярные вещества — например, сухой лед CO
2, может превращаться в газ в твердом состоянии (этот процесс называется сублимацией).
Читайте также: Как просверлить ушной хрящ в домашних условиях и как долго он заживает при правильном уходе
Свойства молекулярных веществ:
- небольшая твердость;
- низкая прочность;
- легкоплавкость;
- летучесть;
- у некоторых — наличие запаха.
Помимо воды, к веществам с молекулярной кристаллической решеткой относится аммиак N H
3, гелий He, радон Rn, йод I, азот N 2 и другие. Все благородные газы являются молекулярными веществами. Большинство органических соединений (например, сахар) также относятся к этой группе.
Графит в природе
В природе он встречается в граните и пирите. Он образуется в магматических и вулканических породах, скарнах и пегматитах при высоких температурах, встречается в кварцевых жилах с различными материалами и широко распространен в мраморе, кристаллическом сланце и гнейсе. Процесс крекинга в угольных месторождениях позволяет получить большие запасы этого природного минерала. Индикаторы:
- Содержание минералов 2.0%
- Содержание углерода>98.0%
- Содержание серы 550 ppm
- Температурный диапазон -200…3000°C
- Выщелачиваемый хлорид 50 ppm
- Сжимаемость 40%
- Регенерация 15%
- pH диапазон 0-14
- Проседание под нагрузкой
Стоимость материала
Графит и графитовые смеси продаются специализированными компаниями, которые добывают и сохраняют материал. Цена вполне приемлема и зависит от содержания углерода и размера кристаллов. Каждый вид графита имеет свою цену: чем больше углерода в материале, тем он дороже и тем лучше его свойства.
Графит продается как оптом, так и в розницу. Стоит отметить, что вы можете получить очень хорошую скидку, если покупаете его в больших количествах.
Стоимость материала также зависит от региона, где он продается. Средняя цена составляет 45-50 рублей за 1 кг. Графитовые изделия имеют более высокую цену.
Месторождения
Крупнейшие месторождения графита находятся в Китае, Украине, Мексике, Канаде и Южной Корее. Месторождения полезных ископаемых являются экономически выгодными для страны, в которой они расположены. Добыча месторождений обеспечивает промышленность необходимым сырьем. Порода состоит из серовато-серых скоплений. Графитовая руда добывается в открытых карьерах, а дробленая руда — в подземных шахтах.
Одним из высокотемпературных жильных минеральных месторождений является месторождение на Цейлоне, имеющее большое промышленное значение. Здесь графитовые жилы расположены среди гнейсов. Подобные месторождения встречаются в Квебеке, Монтане и Англии.
Где и как добывается
Графит встречается в промышленных количествах на всех континентах:
Читайте также: Сталь: определение, классификация, химический состав и применение.
- Обе Америки – США, Канада, Бразилия;
- Европа – ФРГ, Гренландия, Италия;
- Австралия.
Сырье из каждой графитовой шахты можно отличить по структуре, цвету и другим характеристикам.
В России имеется три основных месторождения:
- Бурятия – качественное плотнокристаллическое сырье.
- Краснодарский край (два) – плотно-, мелкокристаллический, чешуйчатый, графитовые сланцы.
Графиты образуются при пиролизе угля или под воздействием чрезвычайно высоких температур и давления. Например, путем извержения магмы в месторождениях каменного угля.
Его добывают в открытых или подземных шахтах. Кристаллы графита встречаются в сланце, мраморе и других органических образованиях.
Ежегодное мировое производство графита составляет 600 тыс. тонн.
Запасы
Мировые запасы графита (1978 г., в тыс. т) в капиталистических и развивающихся странах: Хлопья — Южная Америка, 136; Европа, 3500; Африка, 5442; Азия, 900; плотные кристаллические — Азия, 2900; скрытокристаллические — Северная Америка (кроме США), 3084; Европа, 5623; Азия, 6168. О добыче графита см. статью Графитовая промышленность.
Металлы и металлосодержащие вещества
Химическая структура этих твердых веществ определяется типом связи между их частицами, которая может быть металлической или ионной. Структура, состоящая из положительно заряженных ионов одного химического элемента, между которыми находятся электроны внешнего энергетического уровня, легко теряющие связь с ядром и свободно перемещающиеся по всему металлическому телу (электронный газ), называется металлической кристаллической решеткой. Ионы и атомы располагаются в узлах. Такая решетка состоит из элементарных ячеек, которые могут быть следующих типов:
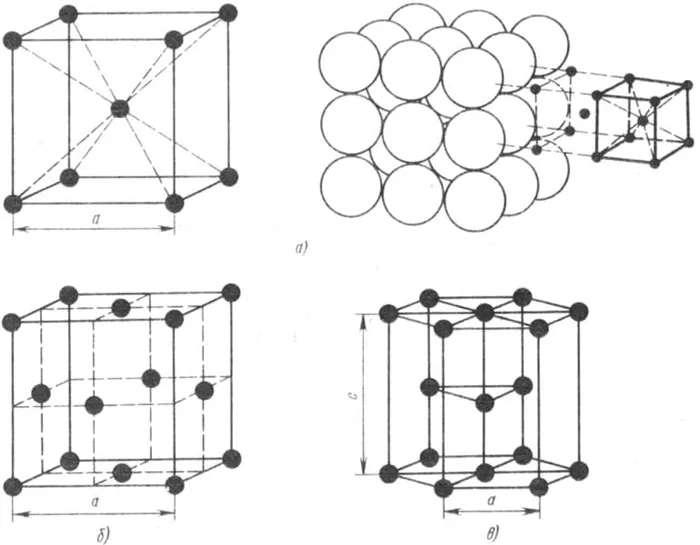
- Объемноцентрированный куб. Включает два атома. Ионы металла, имеющие положительный знак заряда, размещаются в узлах куба, а еще один атом — в его центре. Такую решетку имеют очень твердые и тугоплавкие металлы — вольфрам, молибден, хром, ванадий.
- Гранецентрированный куб. Содержит четыре атома, положительные ионы находятся не только в узлах, но и в центре каждой грани куба. Эта решетка характерна для свинца, меди, никеля, железа, алюминия и многих других металлов.
- Гексагональная плотно упакованная. Состоит из шести атомов и представляет собой шестигранную призму. Ионы располагаются в узлах, по центру оснований и в середине призмы. Такое строение имеют все элементы II группы таблицы Менделеева — бериллий, кальций, магний, стронций, барий, радий.
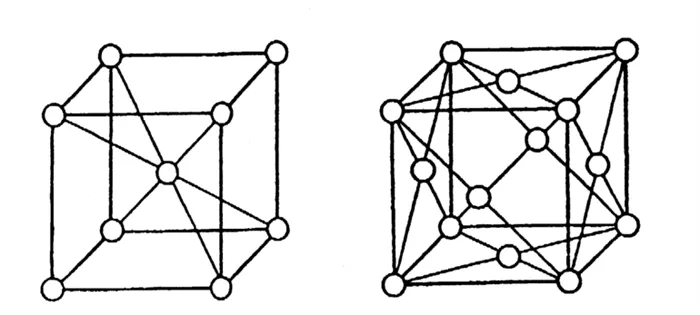
Металлическая структура характеризуется типичными свойствами металлов и их сплавов, а именно блеском, пластичностью и податливостью, а также высокой электро- и теплопроводностью.
Если кристалл состоит из атомов с различной электроотрицательностью (способность атома притягивать общую пару электронов), электроны могут мигрировать от одного атома к другому. В результате образуются положительно и отрицательно заряженные ионы, называемые соответственно катионами и анионами. Связь между ними называется ионной связью, а структура, в узлах которой расположены разноименно заряженные ионы, называется ионной решеткой.
Геометрия элементарной ячейки ионных структур такая же, как у металлических структур, за исключением того, что узлы содержат ионы различных химических элементов, причем однозарядные ионы находятся как можно дальше друг от друга, а незаряженные — как можно ближе друг к другу.
Такая структура обычно встречается в соединениях, состоящих из типичного металла и неметалла, где металл менее реакционноспособен, чем неметалл. Ионная структура соответствует оксидам, гидроксидам, щелочам и солям, а ее компоненты могут быть простыми или сложными. Кристалл поваренной соли (хлорида натрия), например, образован из простых ионов — катиона калия K и аниона хлора Cl. Кристалл сульфата калия состоит из простого катиона калия K и сложного отрицательного сульфатного иона SO4.
Связи между ионами в структурах очень устойчивы, поэтому вещества с такой структурой твердые, жесткие, тугоплавкие и обладают низкой летучестью.
В то же время они хрупкие — ионные слои легко смещаются. Они проводят электричество и тепло только в растворах или расплавах.
Атомные связи в неметаллах
Физические и химические свойства кристаллических неметаллов зависят от взаимодействия атомов или молекул в их решетке. Атомные или немолекулярные связи очень прочные, а молекулярные — слабые.
Между соседними атомами образуются общие электронные пары, при этом каждый атом остается стабильным элементом. Связь, образующаяся в таких парах, называется ковалентной (или сильной) связью. Когда взаимодействуют атомы с одинаковой электроотрицательностью, расположение электронных пар симметрично относительно двух атомов и называется ковалентной неполярной связью.
В веществах, состоящих из различных неметаллов, связь образуется атомами с разной электроотрицательностью, так что общая электронная пара смещается в сторону более отрицательного элемента. Образуется ковалентная полярная связь.
Существует два типа соединений с ковалентными связями: молекулярные и атомные.
Структуры, в узлах которых расположены атомы, соединенные ковалентными связями, называются атомными кристаллическими решетками. В неполярной ковалентной связи в ее образовании участвуют атомы химического вещества. Такую структуру имеют кремний Si, бор B, германий Ge и кристаллические модификации углерода C.
Например, существует две модификации углерода: алмаз и графит. В кубической структуре алмаза атомы расположены в каждой вершине в центре грани и по четыре внутри самого куба. Такая структура обеспечивает наиболее плотное расположение атомов и делает ковалентные связи между ними очень прочными. По этой причине алмаз является самым твердым материалом в мире. Другие свойства: Теплопроводность низкая, и он не проводит электричество.
Графит имеет гексагональную решетку, что делает его мягким. Он имеет очень высокую температуру плавления (4 000 градусов Цельсия), электропроводен, называется полуметаллом и используется для изготовления электродов.
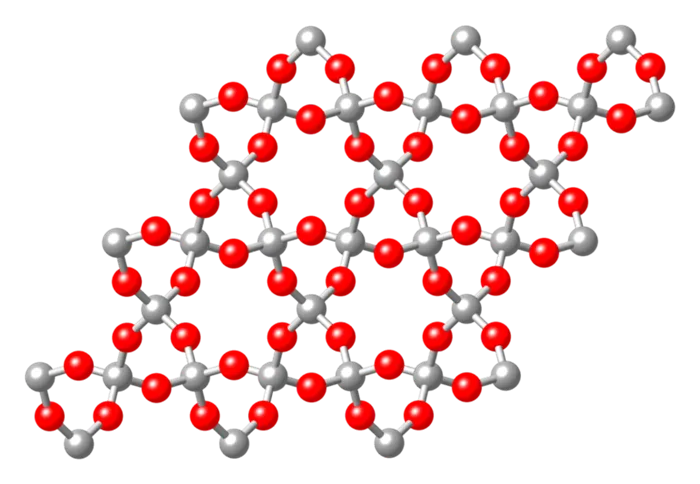
При биполярных ковалентных связях кристаллическая решетка обычно образована атомами различных химических элементов. Муассанит, состоящий из кремния Si и углерода C, и диоксид кремния SiO2 в различных модификациях имеют такую структуру:
- кварцевый песок;
- лютецит;
- опал;
- халцедон;
- хрусталь;
- кремнезем.
Наиболее важными свойствами являются нерастворимость, прочность, твердость, высокая температура плавления и кипения.
Молекулярное строение
Структуры, образованные полярными молекулами с взаимодействием между ними, называются молекулярными кристаллическими решетками. Их межмолекулярные связи являются электрическими и не требуют много энергии для разрыва. В то же время атомы этих молекул ковалентны.
К веществам с молекулярной структурой относятся:
- белый фосфор, моноклинная и ромбическая сера;
- галогены, галогеноводороды и другие жидкости и газы в твердом агрегатном состоянии (йод, фтор, хлор, азот, кислород, озон, вода, оксид углерода — так называемый сухой лед);
- инертные газы с одноатомными молекулами (неон, аргон, ксенон).
Эта структура также соответствует большинству органических соединений.
Большинство молекулярных структур встречаются и в большинстве органических веществ. Слабое взаимодействие между молекулами определяет свойства веществ с такой структурой. Они мягкие и хрупкие, имеют низкую температуру плавления и кипения. Эти кристаллы летучи и хорошо растворимы в воде и других жидкостях.
Благодаря разнообразию пространственных узоров кристаллов, одни и те же химические элементы могут быть использованы для получения совершенно разных материалов.