The attempt to put dynamite in cannon shells failed — very often the shells exploded when fired. On the other hand, dynamite was suitable for creating mines — firstly sea mines, but also for blowing up walls, bridges and tunnels.
Получение простейшего косметического средства на основе глицерина в условиях школьной лаборатории
Uvarova, M.L. Designing a simple cosmetic on the basis of glycerin in a school laboratory / M.L. Uvarova. — Text : direct // Pedagogical excellence : materials of the IX International scientific-practical conference (Moscow, November 2016) — Moscow: Buki-Vedi, 2016. — С. 198-207. — URL: https://moluch.ru/conf/ped/archive/208/11223/ (date of reference: 26.11.2022).
Modern man cannot imagine his life without cosmetics, often without thinking about the composition of the product he chooses. How harmless are the most common creams, soaps and shampoos?
We tried to solve this problem both theoretically and experimentally.
Objective of the work: to establish the universality of glycerin in various cosmetic products and to synthesize a simple cosmetic product based on the esterification reaction.
— Study the relevant literature,
— Study the physical and chemical properties of glycerol, reveal the peculiarities of its interaction with organic acids.
During the study of this topic, it became clear that most of the material is related to the solubility of glycerol in water, the qualitative reaction in glycerol, the esterification reaction (between glycerol and nitric, palmitic, stearic acids). There is a desire to move away from established stereotypes and learn more about the little-known properties of glycerol.
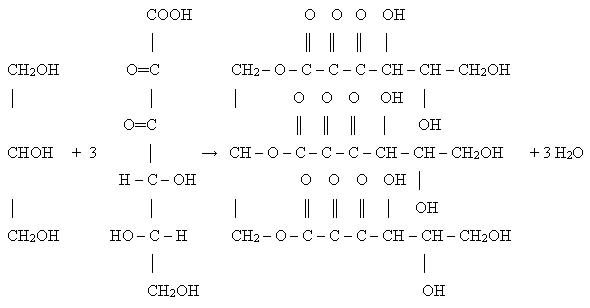
Glycerol CH2OHCHCHCHOHCH2OH is a triatomic alcohol, an odorless, colorless, and sweet-tasting viscous liquid. The name «glycerin» comes from the Latin glycos — sweet. Glycerin is not poisonous. It is miscible with water, alcohol (methyl and ethyl), acetone, insoluble in fats, gasoline, arenes, ether and is a solvent for some organic and inorganic substances such as mono- and disaccharides, salts, alkali and others5.
Its chemical properties are similar to those of monatomic alcohols. The physical properties of glycerol are viscosity, hygroscopicity, solubility, low freezing point, transparency, nontoxicity, wearability, odorless1 .
Due to its chemical and physical properties, glycerin is used in many areas. Especially our attention was attracted by the use of glycerin in medicine and cosmetology.
It can be called one of the cheapest moisturizers. It is widely used in creams, ointments and soaps, and it is believed to protect the skin by storing moisture in the cells. The moisturizing effect is due to the fact that glycerin extracts moisture from the surrounding skin and thus provides additional hydration. However, this property is only applicable in humid climates. When glycerin is applied to the skin, it retains moisture inside and returns it to the skin when needed. However, in the absence of moisture in the air, it will absorb it from the skin, drying out its surface. If a person is in a dry climate, before applying glycerin or glycerin-based products, he should first moisten his skin with special water 6 .
В медицине глицерин используется как антисептик в комплексном лечении многих заболеваний, особенно кожных (способствует заживлению ран, предотвращает инфекции и образование гноя). В фармакологии — в производстве лекарств, в качестве добавки, как эффективный растворитель для некоторых лекарств. Он поддерживает нужное содержание влаги в таблетках и делает жидкие препараты более вязкими. Глицерин входит в состав многих мазей, предотвращая их высыхание. Он используется для приготовления высококонцентрированных лекарственных растворов 5 .
Определение уровня аскорбиновой кислоты в лекарственных.
L-аскорбиновая кислота (витамин С) является активным соединением.
Рисунок 2. Динамика качественного ответа на витамин С в серии из 5 экспериментов с легким настоем крапивы.
Машковский М. Д. Наркотики. В 2-х томах — М.: Медицина, 2000.
Сравнительный анализ содержания аскорбиновой кислоты .
L-аскорбиновая кислота — это активный ингредиент, который на самом деле называется витамином С, в отличие от.
Согласно уравнению химической реакции (1), для окисления 1 моль аскорбиновой кислоты (Mg=176,12) необходимо 1 моль йода (Mg.
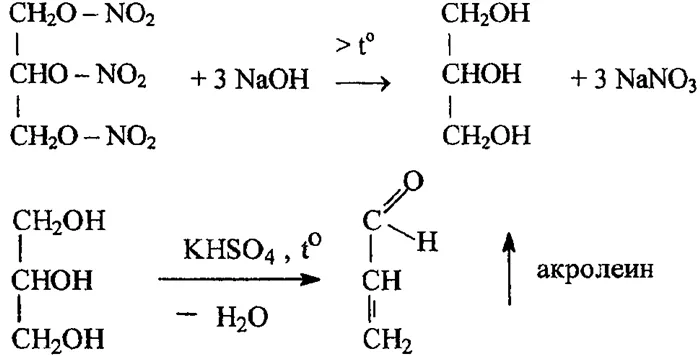
Свойства и получение нитроглицерина
| Rubrica | Химия |
| Тип | письменная работа |
| Язык | Русский |
| Дата добавления | 08.03.2014 |
| Размер | 99,4 K |
Студенты, аспиранты и молодые ученые, которые используют базу знаний для своей учебы и работы, будут очень благодарны.
Доступно на сайте http://www.allbest.ru
1. свойства жидкостей
2. физические и химические свойства нитроглицерина
3 Технология производства
Нитроглицерин представляет собой желтую маслянистую жидкость. Чрезвычайно сильная и опасная для производства взрывчатых веществ. Его емкость составляет 550 мл. Он взрывается при ударе, толчке, перепаде температур. Его получают путем нитрования глицерина. Чистота глицерина определяет эффективность и безопасность производства нитроглицерина. Глицерин, разбавленный водой, должен иметь желтоватый цвет и нейтрально реагировать на литий. Температура плавления глицерина составляет 19 °C, температура кипения — 290 °C. Приготовление: 1 г глицерина медленно (по каплям) добавляют при t = 20 °C к 8 г смеси кислот, состоящей из 60% концентрированной H2SO4 и 40% концентрированной HNO3. После завершения нитрования нитроглицерин отделяют от нитрующей смеси и промывают водой и 5 %-ным раствором соды до удаления всех кислотных примесей, что повышает его чувствительность.
Одно и то же вещество может существовать в одном из трех агрегатных состояний: твердом, жидком или газообразном, в зависимости от соотношения между средней кинетической и средней динамической энергией частиц.
Это энергетическое соотношение определяется внешними условиями — температурой и давлением. Условия перехода из газа в жидкость определяются изотермами агрегатного состояния. Изотерма — это кривая зависимости объема газа от давления при постоянной температуре.
Рассмотрим пример (рисунок 1):
Пунктирная кривая VCS ограничивает диапазон двухфазных состояний вещества (жидкость + пар). Эта кривая и критическая изотерма делят P-V диаграмму ниже изотермы на три области. Ниже кривой ACP находится область двухфазного состояния, где жидкость находится в равновесии с насыщенным паром, слева от кривой ACP находится область жидкого состояния, а справа — область пара. На вершине изотермы АКТКР находится газообразное состояние вещества. Эти регионы более наглядно показаны на рисунке 2.
Рисунок 2. Укажите фазы в системе жидкость + пар: Ж — жидкость, П — пар, Г — газ.
Пар (П) отличается от газообразного состояния (Г) тем, что при изотермическом сжатии переходит в жидкое состояние. Газ же при Т>RCR нельзя перевести в жидкое состояние при любом давлении. Значения RCP, VKR и TKR называются критическими параметрами газа.
Поэтому жидкости имеют две фазы: жидкую и паровую. Испарение — это процесс, происходящий на поверхности жидкости. Испарение объясняется выходом молекул с наибольшей скоростью и энергией из поверхностного слоя жидкости. Испарение приводит к охлаждению жидкости.
Следовательно, испарение — это эндотермический процесс, при котором выделяется теплота испарения. Когда жидкость испаряется с поверхности, эта поверхность естественным образом охлаждается.
Это свойство жидкости используется, например, при тушении пожаров водой: Резкое испарение воды охлаждает место ожога.
Кстати, в жаркую погоду наше тело выделяет пот. Каково его значение? Испарение пота охлаждает кожу человека, чтобы она не перегревалась.
Подобные документы
Зависимость температуры кипения водных растворов азотной кислоты от содержания HNO. Влияние состава жидкой фазы бинарной системы на температуру кипения под давлением. Влияние температуры на поверхностное натяжение водных растворов азотной кислоты.
Равновесный состав жидкости и пара. Определение парообразного состояния. Законы Коновалова. Дробная дистилляция и коррекция. Зависимость состава паровой фазы от температуры. Давление насыщенных паров в системах с ограниченной взаимной растворимостью компонентов.
Аналитическая зависимость теплового эффекта реакции от температуры. Температурный диапазон теплоты парообразования, сублимации и плавления. Зависимость давления насыщенных паров для твердых тел и жидкостей от температуры. Некоторые равновесные давления.
Физические и физико-химические свойства азотной кислоты. Сырье для производства азотной кислоты. Характеристики целевого продукта. Процесс приготовления слабой (разбавленной) и концентрированной азотной кислоты. Влияние на организм и его применение.
Хлорид кальция: физические и химические свойства, применение и сырье. Извлечение расплавленного хлорида кальция из дистилляционной жидкости содово-зольного производства. Производство хлорида кальция и гидроксихлорида кальция из маточного раствора. Кальциевый ангидрид из соляной кислоты.
Вычисление основных свойств газа на основе закона Дальтона, понятие парциального давления. Определение плотности газовой смеси, значения молекулярной массы. Основные типы вязкости: кинематическая и динамическая вязкость. Пределы воспламеняемости для горючих газов.
Химическая формула молекулы воды и ее структура. Систематическое название — оксид водорода. Физические и химические свойства, агрегатные состояния. Требования к качеству воды, зависимость вкуса от состава неорганических компонентов, температуры и наличия газов.
- главная
- рубрики
- по алфавиту
- вернуться в начало страницы
- вернуться к началу текста
- вернуться к подобным работам
Взаимодействие
Салицилаты повышают уровень нитроглицерина в плазме, барбитураты ускоряют метаболизм. Нитроглицерин снижает прессорный эффект адреномиметиков и антикоагулянтный эффект гепарина (при внутривенном введении). Антигипертензивные, антиандрогенные препараты, вазодилататоры, силденафил цитрат, антагонисты кальция, трициклические антидепрессанты, ингибиторы МАО, этанол, хинидин и новокаин усиливают антигипертензивный и системный вазодилататорный эффект. Метионин, N-ацетилцистеин, ингибиторы АПФ и салицилаты усиливают антиангиогенный эффект. Унитиол восстанавливает сниженную чувствительность к нитроглицерину. Дигидроэрготамин, м-холинолитики, альфа-адреномиметики, гистамин, питуитин, кортикостероиды, стимуляторы ЦНС и вегетативных ганглиев, яды пчел и змей, избыток солнечного света снижают вазодилататорный и антиангинальный эффекты.
Передозировка
Симптомы: головная боль, головокружение, сильное ощущение давления в голове, необычная усталость или слабость, обморок, жар или озноб, повышенное потоотделение, сердцебиение, тошнота и рвота, синюшность губ, ногтей или ладоней, одышка, гипотония, слабый учащенный пульс, повышение температуры тела, повышение внутричерепного давления (симптомы в головном мозге вплоть до судорог и комы), метаэмоглобинемия, метаэмоглобинемия.
Лечение: Уложите пациента в горизонтальное положение (поднимите ноги выше уровня головы, чтобы улучшить венозный возврат к сердцу), промывание желудка (если после приема прошло некоторое время), плазмозаменители, внутривенное введение агонистов альфа-адренорецепторов (фенилэфрин). Следует избегать применения эпинефрина в качестве кардиотоника из-за возможности усиления шокоподобных реакций. Для устранения метгемоглобинемии следует ввести кислород под давлением или 1% раствор метилтионина хлорида (метиленовый синий) внутривенно в дозе 1-2 мг/кг. Рекомендуется мониторинг концентрации метгемоглобина в крови.
Способ применения и дозы
Внутривенно (развести в 5% глюкозе или изотоническом растворе до конечной концентрации 50 или 100 мкг/мл): 0,005 мг в минуту; увеличивать дозу на 0,005 мг в минуту каждые 3-5 минут до появления эффекта или достижения 0,02 мг в минуту (при отсутствии эффекта увеличивать на 0,01 мг в минуту).
Сублингвально: таблетки — 0,15-0,5 мг на дозу, при необходимости повторить через 5 минут; аэрозоль — для купирования приступа стенокардии — 1-2 дозы под язык, нажав на дозирующий клапан (можно повторить, но не более 3 доз в течение 15 минут). При острой левожелудочковой недостаточности за короткое время можно ввести 4 или более доз.
Трансдермально: каждый раз наносится на новый участок кожи и оставляется на 12-14 часов, затем удаляется, чтобы сделать перерыв на 10-12 часов во избежание развития толерантности.
Принять: Таблетки и капсулы принимаются не разжеванными и не измельченными 2-4 раза в день до еды, желательно за 30 минут до физической нагрузки; разовая доза составляет 5-13 мг; из-за плохой биодоступности разовая доза может быть увеличена до 19,5 мг.
Подкожно: таблетка вводится в слизистую оболочку полости рта (за щекой) и удерживается до полного всасывания: 2 мг 3 раза в день.
Получение
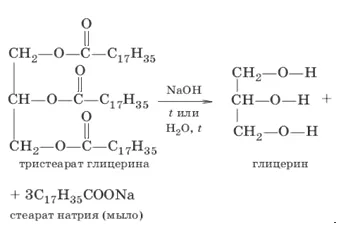
Глицерин был впервые получен Карлом Вильгельмом Шееле в 1779 году путем омыления жиров в присутствии оксида свинца. Большая часть глицерина получается как побочный продукт при омылении жиров.
Большинство синтетических процессов производства глицерина основаны на использовании пропилена в качестве исходного продукта. Пропилен хлорируют при 450-500 °C с получением хлористого аллила, который в сочетании с хлорноватистой кислотой дает хлоргидрины, например, CH2ClCHCHOHCH2Cl, которые при омылении щелочью превращаются в глицерин.
Другие методы основаны на превращении хлористого аллила в глицерин через дихлоргидрин или аллиловый спирт. Известен также способ получения глицерина путем окисления пропилена до акролеина; аллиловый спирт получают путем пропускания смеси паров акролеина и изопропилового спирта через смешанный катализатор ZnO-MgO. Он превращается в глицерин в водном растворе перекиси водорода при температуре 190-270°C.
Глицерин также может быть получен из продуктов гидролиза крахмала, древесной муки, путем гидрогенизации полученных моносахаридов или ферментации сахаров с гликолем. Глицерин также получают в качестве побочного продукта при производстве биотоплива.
Производные глицерина и их место в обмене веществ живых организмов
Глицериды

Глицерин (3D-модель), атомы и электронные пары в атомах кислорода (розовый цвет).
Триглицериды являются производными глицерина и образуются при связывании высших жирных кислот с глицерином. Триглицериды являются важными компонентами в процессе метаболизма живых организмов.
Жиры и масла гидрофобны и нерастворимы в воде, поскольку гидроксильные группы глицерина замещены малополярными остатками жирных кислот.
Применение
Глицерин имеет широкий спектр применения: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих средств и косметики, сельское хозяйство, текстильная, бумажная и кожевенная промышленность, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса для сварки).
Глицерин относится к группе стабилизаторов, обладающих способностью поддерживать и повышать вязкость и консистенцию пищевых продуктов. Он зарегистрирован как пищевая добавка E422 и используется в качестве эмульгатора, с которым можно смешивать различные несмешивающиеся смеси.
Поскольку глицерин может желироваться и хорошо горит без запаха и шлаков, его используют для изготовления высококачественных прозрачных свечей и в качестве основы для жидкости в туманных машинах.
Глицерин также используется при производстве динамита.
В последние годы глицерин наряду с пропиленгликолем используется в качестве основного ингредиента при производстве жидкостей и картриджей для электронных сигарет.
Он используется в криобиологии и крионике в качестве основного ингредиента распространенных криопротекторных проницаемых агентов для криоконсервации анатомических образцов, биологических тканей и организмов.








