-В бетонную смесь добавляется определенное количество нитрата кальция (цемент, песок, камни и вода) и исследуется влияние этой добавки на определенные свойства бетона, такие как скорость схватывания и прочность.
Структура нитрата кальция (Ca (NO3) 2), свойства, применение и применение
Нитрат кальция — это третичная неорганическая соль с химической формулой Ca(NO)3)2. Из его формулы видно, что в твердом состоянии он состоит из Ca 2+ и NO3— ионы в соотношении 1:2. Таким образом, это соединение чисто ионного характера.
Одним из его свойств является окисляющее действие благодаря аниону азота. Он не воспламеняется, т.е. не горит при высоких температурах. Поскольку он не воспламеняется, это надежный сейф, с которым можно обращаться без особой осторожности; однако он может ускорить воспламенение горючих материалов.

Это гранулированное твердое вещество белого или светло-серого цвета (на фото выше). Он может быть безводным или четырехвалентным, Ca(NO3)2— 4H2О. Он хорошо растворим в воде, метаноле и ацетоне.
Нитрат кальция часто используется в качестве удобрения, поскольку он легко перемещается во влажной почве и быстро поглощается корнями растений. Он обеспечивает два важных элемента для питания и роста растений: азот и кальций.
Азот является одним из трех наиболее важных элементов для роста растений (N, P и K) и важен для синтеза белка. В то же время кальций необходим для поддержания структуры клеточной стенки растений. По этой причине Ca3)2предназначен для частого использования в садах.
С другой стороны, эта соль обладает токсичным действием, особенно при прямом контакте с кожей и глазами, а также при вдыхании пыли. Он также может разлагаться при нагревании.
- 1 Структура нитрата кальция
- 2 Физические и химические свойства
- 2.1 Химические названия
- 2.2 Молекулярная формула
- 2.3 Молекулярный вес
- 2.4 Внешний вид
- 2.5 Точка кипения
- 2.6 Точка плавления
- 2.7 Растворимость в воде
- 2.8 Растворимость в органических растворителях
- 2.9 Кислотность (пКа)
- 2.10 Плотность
- 2.11 Разложение
- 2.12 Реактивный профиль
- 3.1 Сельское хозяйство
- 3.2 Бетон
- 3.3 Очистка сточных вод или сточных вод
- 3.4 Приготовление холодных компрессов
- 3.5 Латексная коагуляция
- 3.6 Передача и хранение тепла
Структура нитрата кальция
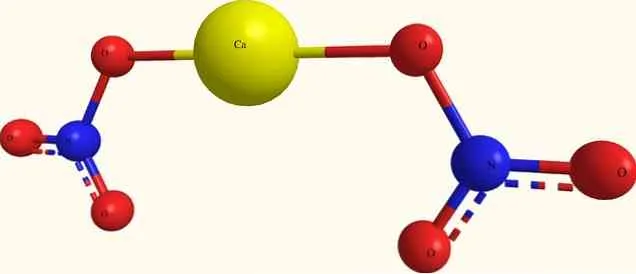
Структура Ca(NO) показана на рисунке выше3)2в модели сферы и стержня. Однако здесь допущена ошибка: предполагаются ковалентные связи Ca-O, что противоречит его ионному характеру. Для уточнения: Взаимодействие на самом деле имеет электростатическую природу.
Катион Ca 2+ окружен двумя NO3— соответствующие их пропорциям в кристалле. В кристаллической структуре преобладает азот в виде нитратных солей.
Ионы расположены таким образом, что образуют конфигурацию, минимальным выражением которой является элементарная ячейка, которая для безводной соли является кубической. Другими словами, из кубиков, содержащих соотношение 1:2 для этих ионов, полностью воспроизводится кристалл.
С другой стороны, Ca(NO)3)2— 4H2OR имеет четыре молекулы воды на один общий NO3— Ca 2+ NO3-. Это делает кристаллическую структуру моноклинной элементарной ячейкой.
Следовательно, кристаллы двух солей, безводной и тетрагидратированной, должны быть разными; различия могут быть определены по их физическим свойствам, таким как температура плавления.
Физические и химические свойства
Химические названия
-Норвежская селитра и азотная известь.
Молекулярная формула
Молекулярный вес
Ангидрид 164,088 г/моль и тетрагидрат 236,15 г/моль. Обратите внимание на влияние воды на молекулярный вес, которым нельзя пренебречь при соответствующем взвешивании.
Внешний вид
Твердые вещества или гранулы белого или светло-серого цвета. Кубовидные белые кристаллы или растворенные зерна, т.е. они поглощают влагу до такой степени, что растворяются из-за своей высокой растворимости.
Точка кипения
Безводная форма разлагается при нагревании до температуры, при которой невозможно определить ее температуру кипения, в то время как тетрагидрическая форма соли имеет температуру кипения 132 °C (270 °F, 405 K).
Точка плавления
-Безводная форма: 561 ºC — 760 мм рт. ст. (1042 ºF, 834 K).
-Тетрагидратная форма: 42,7 ºC (109 ºF, 316 K).
Это показывает, как молекулы воды нарушают электростатическое взаимодействие между Ca 2+ и NET3— внутри кристаллов, так что твердое вещество плавится при гораздо более низкой температуре.
Растворимость в воде
-Водная форма: 1212 г/л при 20 ºC.
-Тетргидрогенизированная форма: 1290 г/л при 20 ºC.
Вода в кристаллах лишь незначительно повышает растворимость соли.
Растворимость в органических растворителях
-В этаноле: 51,42 г/100 г при 20 ºC.
-Метанол, 134 г/100 г при 10 ºC.
-Ацетон, 168 г/100 г при 20ºC.
Кислотность (пКа)
плотность
2,5 г/см 3 при 25 ºC (тетрагидрическая).
разложение
При нагревании нитрата кальция в лампах он разлагается на оксид кальция, оксид азота и кислород.
Реактивный профиль
Он является сильным окислителем, но не воспламеняется. Он ускоряет воспламенение горючих материалов. Распад нитрата кальция на мелкие частицы способствует его взрыву, когда соединение подвергается длительному воздействию огня…..
Смеси с алкиловыми эфирами становятся взрывоопасными при образовании алкилнитратов. Сочетание нитрата кальция с фосфором, хлоридом олова(II) или другим восстановителем может вступить во взрывную реакцию.
Нитрат кальция — Calcium nitrate

Нитрат кальция, также называемый норгессальпетер, представляет собой неорганическое соединение с формулой Ca(NO 3)2. Эта бесцветная соль поглощает влагу из воздуха и обычно присутствует в четырехвалентной форме. В основном он используется в качестве добавки к удобрениям, но имеет и другие применения. Нитрокальцит — это название минерала, представляющего собой гидрат нитрата кальция, который образуется в виде осадка при контакте навозной жижи с бетоном или известняком в сухой среде, например, в конюшнях или пещерах. Известно несколько родственных солей, таких как кальций-аммоний нитрат декагидрат и калий нитрат декагидрат.
Норгессалпетер был синтезирован в 1905 году в Нотоддене, Норвегия, с использованием процесса Биркеланда-Эйде. Большая часть нитрата кальция, производимого сегодня в мире, производится в Порсгрунне.
. Он производится путем обработки известняка азотной кислотой и последующей нейтрализации аммиаком:
CaCO 3 + 2 HNO 3 → Ca(NO 3)2 + CO 2 + H 2O.
Он также является промежуточным продуктом процесса Odda:
Ca3(PO 4)2+ 6 HNO 3 + 12 H 2 O → 2 H 3PO4+ 3 Ca (NO 3)2+ 12 H 2O.
Его также можно получить из водного раствора нитрата аммония и гидроксида кальция:
2 NH 4NO3+ Ca (OH) 2 → Ca (NO 3)2+ 2 NH 4OH.
Как и родственные щелочноземельные нитраты, нитрат кальция разлагается при нагревании (выше 500 °C), выделяя диоксид азота:
2 Ca (NO 3)2→ 2 CaO + 4 NO2 + O 2 ΔH = 369 кДж/моль
Области применения
Использование в сельском хозяйстве
Марка удобрения (15,5-0-0 + 19% Ca): популярный в торговле теплиц и гидропоникой ; он содержит нитрат аммония и воду в качестве «двойной соли» 5 Ca ( NO 3) 2 ⋅ NH 4 NO 3 ⋅ 10 H 2 O>>. Это называется кальциево-аммиачной селитрой. Другие известные составы без аммиака — это Ca(NO 3)2- 4H 2 O (11,9-0-0 + 16,9 Ca) и безводный 17-0-0 + 23,6 Ca. Также доступен жидкий состав (9-0-0-0 + 11 Ca). Безводным, устойчивым на воздухе производным является комплекс мочевины Ca(NO 3)2- 4 OC(NH 2)2, который продается как Cal-Urea.
Нитрат кальция также используется для борьбы с некоторыми болезнями растений. Например, опрыскивания разбавленным нитратом кальция (и хлоридом кальция) используются для борьбы с горькой и пробковой мучнистой росой на яблонях.
Очистка сточных вод
Нитрат кальция используется в предварительной очистке сточных вод для предотвращения выделения неприятного запаха; подготовка основана на создании аноксической биологии в системе сточных вод. В присутствии нитрата метаболизм сульфата прекращается, что предотвращает образование сероводорода. Кроме того, легко разлагаемые органические вещества, которые в противном случае вызвали бы анаэробные условия в нижестоящем оборудовании, расходуются, а сами запахи также разлагаются. Эта концепция также применима к обработке избыточного ила.
Бетон
Нитрат кальция используется в средствах для схватывания бетона. Его использование в бетонах и растворах основано на двух эффектах. Ионы кальция ускоряют образование гидроксида кальция и, следовательно, выпадение осадка и схватывание. Этот эффект также используется в бетонных смесях для холодной погоды и в определенных комбинациях пластификаторов. Нитрат-ион приводит к образованию гидроксида железа, защитный слой которого уменьшает коррозию бетонной арматуры.
Латексный коагулянт
Нитрат кальция является очень распространенным коагулянтом в производстве латекса, особенно в процессах окунания. Растворенный нитрат кальция входит в состав раствора погружной ванны. Горячая форма погружается в жидкость для коагуляции, оставляя на ней тонкую пленку жидкости для погружения. Если форму окунуть в латекс, то нитрат кальция мешает стабилизации раствора латекса, и латекс коагулирует на ней.
Холодные компрессы
Растворение тетрагидрата нитрата кальция сильно эндотермично (охлаждение). По этой причине тетрагидрат нитрата кальция иногда используется для регенерированных холодных компрессов.
Расплавленные соли для передачи тепла и хранения
Нитрат кальция может использоваться в качестве компонента расплавленных солей. Типичными примерами являются бинарные смеси нитрата кальция и нитрата калия или троичные смеси, которые также содержат нитрат натрия. Эти расплавленные соли могут быть использованы в качестве замены термомасла в солнечных электростанциях для теплопередачи, но в основном используются для хранения тепла.








