Кислоты также классифицируются по растворимости в воде (водорастворимые и нерастворимые), летучести (летучие, т.е. способные существовать в газообразном состоянии, и нелетучие), содержанию атомов металлов (металлосодержащие и неметаллосодержащие) и классу химических соединений (органические и неорганические).
Сильные и слабые кислоты: названия, описания, классификация и свойства


Во-первых, следует помнить, что все кислоты являются сложными химическими соединениями, состоящими из различных химических элементов. Во-вторых, характерной особенностью почти всех кислот является наличие атомов водорода H. Помимо водорода, кислота состоит из кислотного остатка. Наиболее известная серная кислота, например, имеет формулу H2SO4,Это означает, что первая часть формулы кислоты всегда состоит из водорода, за которым следует сам кислотный остаток. Однако из этого правила есть исключение — так называемые кислоты Льюиса, которые являются апротовыми кислотами без водорода. Однако при определенных условиях они также являются кислотами, поскольку в химии существуют различные теории о кислотах. Согласно определению, предложенному американским физиком-химиком Х. Н. Льюисом, кислота — это любое химическое соединение, способное принимать пару электронов от донорного соединения. Поэтому, согласно Льюису, молекулы с незаполненной восьмиэлектронной оболочкой, а также комплексные катионы металлов, галогениды металлов, галогениды переходных металлов, молекулы с полярными двойными связями и карбокатионы можно считать кислотами.
Физические свойства

Конечно, все кислоты имеют кислый, а иногда и металлический вкус, и их не следует пробовать на вкус. Но другие физические свойства кислот также могут меняться, например, разные кислоты имеют разный цвет, разный запах (некоторые не пахнут вообще, другие сильно пахнут), а что касается общего состояния вещества, то кислоты могут существовать во всех трех состояниях: твердом, жидком и газообразном.
- Все кислородосодержащие кислоты (то есть содержащие в себе кислород) при разложении образуют воду и кислотный оксид.
- Безкислородные кислоты при разложении распадаются на простые элементы. Характерный пример, соляная кислота HCl состоящая из водовода и хлора (Cl) распадается на эти элементы.
- Кислоты активно вступают в химические реакции с солями, состоящими из более слабых соединений.
Концентрация вещества
Одной из важнейших задач химиков является количественное определение состава жидких химических веществ — их концентрации. В практической химии особенно важно правильно определить концентрацию кислоты в растворе.
Как определить концентрацию кислоты, например, чтобы узнать, сколько чистой серной кислоты присутствует в растворе? Для этого вы наливаете определенное количество раствора в специальный мерный стакан, взвешиваете полученную массу и можете использовать полученные данные для определения концентрации кислоты в таблице плотности, так как плотность веществ неразрывно связана с их концентрацией.

Общие свойства
Все кислоты содержат атомы водорода, которые могут вступать в реакцию. Таким образом, кислота — это сложное вещество, молекулы которого состоят из различного количества атомов водорода и кислотного остатка. Эти соединения имеют кислый и часто слегка металлический вкус. При контакте с ними индикаторы приобретают другой оттенок и даже кардинально меняют цвет.
Химические свойства, общие для всех кислот:

- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут быть очень разными. Например, некоторые из них имеют запах, а другие вообще не имеют запаха.
Кислоты могут быть жидкими, газообразными или твердыми. C2H204 и H3BO3, например, являются твердыми веществами.
Концентрация вещества
Химикам часто приходится рассчитывать, сколько чистой кислоты находится в растворе, выражая это в процентах. В этих случаях важна концентрация.
Это значение, которое может быть использовано для количественной оценки состава жидкого химического вещества. Например, чтобы узнать, сколько чистой серной кислоты содержится в разбавленном растворе, налейте небольшое количество смеси в мерный стакан, взвесьте его и определите значение по таблице плотности. Приведенная выше таблица используется для расчетов, поскольку плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислотные вещества делятся на кислородсодержащие и бескислородные соединения. Состав последних соединений отличается тем, что в них содержится не кислород, а водород. По этой причине за их названиями всегда следует слово «водород». Например, хлористый водород, сероводород.
Кроме того, кислоты классифицируются в зависимости от количества атомов водорода.
Поэтому они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Однако существуют также органические кислоты, то есть органические вещества, обладающие свойствами кислотных соединений. Наиболее известными из них являются уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная кислоты.
Все кислотные вещества и основания делятся на сильные и слабые. Однако важно знать, что эти термины не имеют никакого отношения к концентрации соединений. Сила кислоты определяется ее способностью вступать в химическую реакцию с выделением ионов водорода.
Таким образом, вещество считается сильным, если оно легко вступает в реакцию.
Концентрация вещества
Химикам часто приходится рассчитывать, сколько чистой кислоты находится в растворе, выражая это в процентах. В этих случаях важна концентрация.
Это значение, которое может быть использовано для количественной оценки состава жидкого химического вещества. Например, чтобы узнать, сколько чистой серной кислоты содержится в разбавленном растворе, налейте небольшое количество смеси в мерный стакан, взвесьте его и определите значение по таблице плотности. Приведенная выше таблица используется для расчетов, поскольку плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислотные вещества делятся на кислородсодержащие и бескислородные соединения. Состав последних соединений отличается тем, что в них содержится не кислород, а водород. По этой причине за их названиями всегда следует слово «водород». Например, хлористый водород, сероводород.
Кроме того, кислоты классифицируются в зависимости от количества атомов водорода.
Поэтому они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Однако существуют также органические кислоты, то есть органические вещества, обладающие свойствами кислотных соединений. Наиболее известными из них являются уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная кислоты.
Все кислотные вещества и основания делятся на сильные и слабые. Однако важно знать, что эти термины не имеют никакого отношения к концентрации соединений. Сила кислоты определяется ее способностью вступать в химическую реакцию с выделением ионов водорода.
Таким образом, вещество считается сильным, если оно легко вступает в реакцию.
Сильные и слабые реагенты
Если реактив полностью растворяется в ионах в водном растворе, т.е. отделяется, то он сильный, потому что слабые химические соединения никогда не растворяются полностью.

Кроме того, слабую кислоту можно отличить, измерив ее электропроводность. Сильные соединения являются хорошими электролитами. Сильные основания также растворяются при контакте с водой. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существуют специальные списки слабых и сильных кислот и оснований. Приведенная ниже таблица также может быть использована для классификации реагентов.
| Сильная кислота | Слабая кислота | Прочные основы | Слабая база |
|---|---|---|---|
| HCI Соляная кислота или хлористоводородная кислота | HF Фтористый водород | NaOH Гидроксид натрия | Mg(OH)2 Гидроксид магния |
| HBr Бромистый водород | CH3COOH Уксусная кислота | KOH Гидроксид калия | Fe(OH)2 Гидроксид железа(II) |
| HI Йодистый водород | H2SO3 Сульфат | Ca(OH)2 Гидроксид кальция | Zn(OH)2 Гидроксид цинка |
| HNO3 Азот | H2S Сульфид водорода | Ba(OH)2 Гидроксид бария | NH4OH Гидроксид аммония |
| HClO4 Хлор | Нитрит HNO2 | LiOH Гидроксид лития | Fe(OH)3 Гидроксид железа(III) |
| сульфат H2SO4 | H2SiO3 Кремний |
Следует также отметить, что карбоновая кислота (H2CO3) и ортофосфорная кислота (H3PO4) или фосфорные кислоты, содержащие кислород, являются слабыми. Однако к сильным кислотам необходимо добавлять хромовую кислоту, которая имеет среднюю силу.
Следует также помнить, что современная химия позволяет ученым создавать новые соединения. Поэтому список сильных и слабых кислот постоянно обновляется.
Разница между сильными и слабыми кислотами
Определение
Сильные кислоты: Сильные кислоты — это молекулы, которые полностью распадаются на ионы в воде.
Слабая кислота: Слабые кислоты — это молекулы, которые частично диссоциируют на ионы в водном растворе.
pH
Сильная кислота: значение PH раствора сильной кислоты очень низкое (около pH = 1).
Слабая кислота: значение PH слабокислого раствора составляет 3-5.
Константа диссоциации кислоты
Сильная кислота: константа диссоциации K кислоты выше для сильных кислот.
Слабая кислота: константа диссоциации K кислоты имеет меньшее значение, чем у сильных кислот.
Количество выпущенных ионов H +
Сильная кислота: Сильные кислоты высвобождают все ионы H+, которые могут перейти в раствор.
Слабая кислота: Слабые кислоты не высвобождают все ионы H+.
Заключение
Потенциал кислоты определяется полярностью и атомным размером молекулы кислоты. В зависимости от того, как молекулы кислоты распадаются в воде, существует два типа кислот: сильные и слабые кислоты. Основное различие между сильными и слабыми кислотами заключается в том, что сильные кислоты полностью растворяются в водных растворах, а слабые кислоты растворяются в водных растворах частично.
Рекомендации:
1. сильные и слабые кислоты. Сильные и слабые кислоты. «Сильные и крепкие кислоты».
Как уже упоминалось, азотная кислота в любой концентрации и серная кислота только в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от других кислот, они окисляют не только металлы, стоящие перед водородом в ряду активности, но и почти все металлы после него (кроме платины и золота).
Например, они способны окислять медь, серебро и ртуть. Однако не следует забывать, что некоторые металлы (Fe, Cr, Al), хотя и достаточно активные (до водорода), не реагируют с концентрированной HNO3и концентрированная H2SO4без нагрева за счет эффекта пассивации — на поверхности этих металлов образуется защитная пленка из твердых продуктов окисления, препятствующая проникновению молекул концентрированной серной и азотной кислоты внутрь металла и вступлению в реакцию. Однако при сильном нагревании реакция происходит.
При взаимодействии с металлами необходимыми продуктами всегда являются соль данного металла и используемой кислоты, а также вода. Также всегда имеется третий продукт, природа которого зависит от многих факторов, например, от активности металлов, концентрации кислот и температуры реакции.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только почти со всеми металлами в диапазоне активности, но и со многими твердыми неметаллами, особенно с фосфором, серой и углеродом. В таблице ниже наглядно показаны продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от их концентрации:
Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства под воздействием различных окислителей из-за химического элемента, входящего в состав аниона. Например, все галогенированные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия и дихроматом калия. Галогенид-ионы окисляются до свободных галогенов:
Из всех галогенированных кислот соляная кислота обладает наибольшим восстановительным действием. В отличие от других гидрогалогеновых кислот, гидрогалогеновые кислоты также могут быть окислены оксидами железа и солями трехвалентного железа.
Сероводородная кислота H2S. Даже такой окислитель, как диоксид серы, может его окислить:
Объективное измерение кислотности
Именно так объективно измеряется кислотность по шкале pH. Шкала варьируется от 1 до 14, где 1 — очень сильная кислота, 7 — нейтральный раствор, а 14 — очень сильное основание.
Шкала pH — это логарифмическая шкала. Это отрицательный логарифм (p) концентрации ионов H+ (H в pH). Если концентрация водородных ионов каким-либо образом снижается, pH увеличивается по мере увеличения щелочности.
Однако дело не только в концентрации, но и в активности этих ионов. Активность этих ионов зависит от многих факторов, и концентрация — лишь один из них. Для простоты давайте останемся с понятием концентрации.
Удельную кислотность можно определить, растворив кислоту в водном растворе. Катионы H+ не могут свободно перемещаться; они реагируют с молекулами воды (H2O), образуя гидроксид-ионы (H3O+) и гидроксид-ионы (OH-).
Поэтому более высокая концентрация ионов H3O+ в воде указывает на присутствие сильной кислоты. Оставшиеся ионы без протонов, ионы H+, являются основаниями. Поэтому, в некотором смысле, кислоты и основания естественно существуют парами. Общая идея реакции между водой и кислотой может быть проиллюстрирована следующим выражением.
Другой метод определения относительной кислотности растворов заключается в определении равновесной размерной константы кислоты, обозначаемой символом «Ka».
Ссылаясь на уравнение выше, мы можем найти значение Ka, используя:
H3O+ и A- — концентрации иона гидроксона и растворенного основания в молях на литр. HA — концентрация молекул, которые были неподвижны и не вносили ионы H+.
Для сильной кислоты произведение в числителе имеет большее значение, чем сумма в знаменателе, потому что сильная кислота быстро катализирует разложение и производит больше ионов, оставляя меньше молекул HA. Поэтому значение Ka для сильной кислоты больше 1.
И наоборот, для слабой кислоты произведение в числителе меньше, чем в знаменателе, потому что она почти не способна производить ионы H+. Поэтому значение Ka для слабой кислоты меньше 1.
Таким образом, значение Ka определяет абсолютную силу кислоты.
Реакции кислот и оснований
Слабое основание и слабая кислота
Общий вид реакции: Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH-(р-р).
Сильная кислота и слабое основание
Кислота растворяется полностью, основание растворяется неполностью:
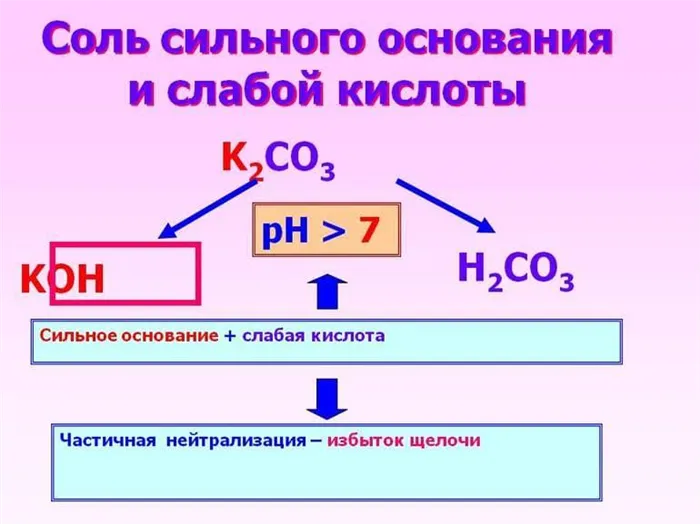
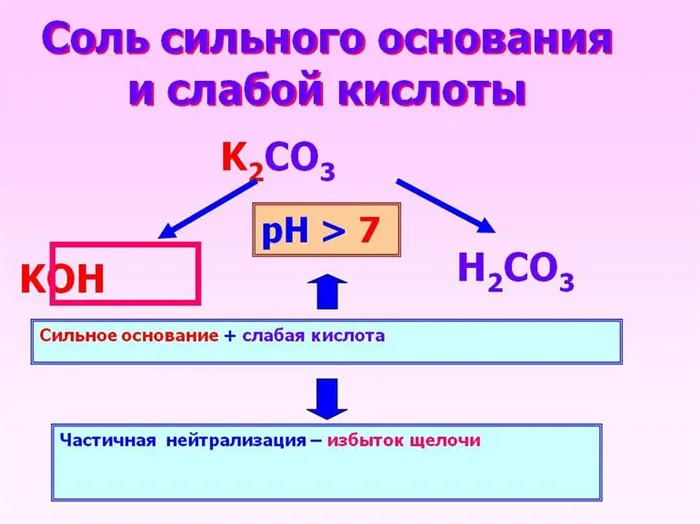
Сильное основание и слабая кислота
Основание полностью растворяется, кислота частично растворяется, и полученный раствор обладает свойствами слабого основания:
Сильная кислота и сильное основание
Эта реакция называется нитрацией: Если реагентов достаточно для полной диссоциации кислоты и основания, то полученный раствор является нейтральным.
Сколько кислоты может убить человека?
Какое количество токсичной кислоты необходимо для того, чтобы вызвать отравление или смерть? Сильные кислоты реагируют мгновенно, поэтому в некоторых случаях может быть достаточно небольшой капли или простого вдыхания.
Количество кислоты, которое может вызвать отравление, зависит от возраста, физического состояния, иммунной системы и способности организма сопротивляться вредным веществам. У детей отравление развивается быстрее, чем у взрослых, поскольку обмен веществ у них ускорен. Точную дозировку может определить медицинский работник.
Водородный показатель
При проведении реакций разложения важно правильно определить кислотность воды. Для количественной оценки этого используется значение pH, называемое водородной силой, весом или потенциалом. Он позволяет измерить активность ионов водорода. Если pH выше 7, вещество кислотное; если pH ниже, оно основное.
Способы определения
Результаты химических реакций с участием вещества напрямую зависят от его кислотности. Именно поэтому химики всегда измеряют значение pH.
Существуют различные методы определения значения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буфер — это вещество, характеризующееся наличием постоянной концентрации ионов водорода.

При добавлении сильной кислоты или аналогичного основания в небольших дозах эти растворы сохраняют свою первоначальную кислотность.
Чтобы приготовить такую смесь, необходимо смешать слабую кислоту или основание с подходящей солью.
При приготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
Пентафторид фторида сурьмы считается на сегодняшний день самой сильной кислотой в мире. Его химическая формула — HFSbF5. Точной информации о силе этого соединения нет, но было установлено, что его 55%-ный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе воздействия соединением является карборановая кислота. Это вещество следует хранить только в специальном контейнере. Она также во много раз опаснее серной кислоты и может растворять даже стекло.
Фтористоводородная кислота — еще одна суперкислота. Он бесцветен и, как и предыдущее соединение, разъедает стекло. Он используется для переноса этого коррозионного соединения на полиэтилен. Он хорошо реагирует с большинством металлов, но не с парафином. Это соединение токсично, даже его пары опасны для здоровья. Кислота обладает наркотическим действием.

Самым сильным из известных веществ является серная кислота. Из-за большого объема производства некоторые химики считают его самым опасным в мире. По мере увеличения концентрации химического вещества возрастает и риск для здоровья человека, хотя даже растворы соединения серной кислоты могут нанести серьезный ущерб. Это вещество окисляет металлы и является очень коррозийным, а его пары также чрезвычайно опасны. Кожа и слизистые оболочки, органы дыхания и внутренние органы поражаются при контакте.
Муравьиная кислота, которая часто используется в быту, также классифицируется как токсичный химикат. Этот статус объясняется тем, что опасность возникает только при высоких концентрациях вещества. При нормальных условиях он бесцветен, легко образует водные растворы и хорошо растворяется в ацетоне.
При концентрации ниже 10 % реагент вызывает только раздражение. Если концентрация выше, соединение может поражать ткани и многие другие вещества. Его пары повреждают глаза, слизистые оболочки и органы дыхания. Проглатывание может привести к тяжелому отравлению. Однако в минимальных концентрациях он успешно перерабатывается и выводится из организма. В небольших дозах он содержится во фруктах, экскрементах насекомых и крапиве.
Азотная кислота является сильнодействующим ядом. В различных пропорциях он хорошо смешивается с водой. Реагент чрезвычайно опасен для человека. Его пары вызывают серьезные повреждения органов дыхания и слизистых оболочек. При контакте с кислотой кожа желтеет и на ней остаются язвы. Травмированные участки требуют длительного процесса реабилитации.
Азотная кислота разлагается под воздействием тепла или света и превращается в довольно токсичный газ. Вещество не вступает в химическую реакцию со стеклом, поэтому этот материал используется для хранения реагента. Изобретателем токсичного соединения является алхимик Джабир.
Кривые титрования
Кривые титрования — это диаграммы, которые показывают, как концентрация титруемого реагента, титранта или продукта химической реакции, соотносится со степенью протекания процесса. Если происходит кислотно-основная реакция, то концентрация каждого объекта обозначается значением pH.

Существуют теоретические и экспериментальные кривые. Теоретические аспекты используются для обоснования выбора индикатора. Они рассчитываются из уравнения реакции и данных о начальной концентрации соединений, вступающих в реакцию. Экспериментальные кривые используются для определения точек эквивалентности. Они определяются путем измерения одного из свойств системы в процессе титрования.
Ход и результат химических реакций, которым подвергается каждая кислота, напрямую зависят от того, является ли она сильным или слабым веществом. Специальные химические таблицы содержат названия наиболее распространенных соединений, чтобы можно было точно определить силу реактива.








