Серебро встречается в природе гораздо реже, чем, например, медь; его содержание в земной коре составляет 10-5 % (по массе). В некоторых местах (например, в Канаде) серебро встречается в естественном состоянии, но в основном серебро извлекается из его соединений. Наиболее важной серебряной рудой является серебряный блеск, или агломерат, Ag.2S.
Серебро
Серебро — элемент малой подгруппы первой группы, пятого периода периодической таблицы химии, с атомным номером 47. Обозначается символом Ag (лат. Argentum). Один из самых редких элементов. Простое вещество серебро (CAS номер: 7440-22-4) представляет собой ковкий, пластичный драгоценный металл серебристо-белого цвета. Кристаллическая решетка — гранецентрированная кубическая. Температура его плавления составляет 963°C, а плотность — 10,5 г/см³.
Серебро известно с древних времен. Как и золото, серебро часто находили в его естественной форме, поскольку его не нужно было выплавлять из руд. Установлено, что серебро играет довольно важную роль в культурных традициях различных народов. В Ассирии и Вавилонии серебро считалось священным металлом и было символом луны. В Средние века серебро и его соединения были очень популярны у алхимиков. С середины тринадцатого века серебро стало традиционным материалом для изготовления посуды. Кроме того, серебро и сегодня используется для чеканки монет.
Происхождение названия
Очевидно, что русское серебро, польское сребро, болгарское сребро и немецкое серебро также используются для изготовления монет. сребро, болгарское сребро, ст. Слав. srebro можно проследить до праславянского *syrebro, которое имеет эквиваленты в балтийских языках (литовское sidabras, d. Дальнейшая этимология вне круга германо-балто-славянских языков неясна; мы подозреваем либо связь с восточным subau-ro ‘яркий’, либо раннее заимствование из ближневосточных языков: см. Аккадск. sarpu «очищенное серебро», от аккадск. sarapu «очищать, благоухать». В греческом языке ‘серебро’, серебряный’, от индоевропейского корня ‘*H₂erǵó-, *H₂erǵí-‘, означающего ‘белый’, ‘блестящий’. Латинское название «argentum» также происходит отсюда.
Нахождение в природе
Определенная доля драгоценных и цветных металлов встречается в природе в естественном виде. Известно и документально подтверждено, что были найдены не только крупные, но и огромные серебряные самородки. Например, в 1477 году в шахте «Санкт-Георг» в районе Шнееберг в Рудных горах, в 40-45 километрах от Фрайберга, был найден серебряный самородок весом 20 тонн. Серебро размером 1 x 1 x 2,2 м было извлечено из раскопа, отмечено, а затем отделено и взвешено.
В Дании в Копенгагенском музее хранится самородок весом 254 кг, найденный в 1666 году в шахте Конгсберг в Норвегии. Крупные самородки были найдены и на других континентах. Один из серебряных самородков из кобальта в Канаде, весом 612 килограммов, сейчас находится в здании канадского парламента. Другая плита, найденная в том же месторождении и названная «серебряным тротуаром» из-за своего размера, имела длину около 30 метров и содержала 20 тонн серебра. При всех впечатляющих находках, однако, следует отметить, что серебро химически более реакционно, чем золото, и поэтому в естественном виде встречается в природе реже.
Известно более 50 природных минералов серебра, из которых только 15-20 имеют промышленное значение, в том числе.
Как и другие драгоценные металлы, серебро характеризуется двумя формами внешнего вида:
- собственно серебряные месторождения, где оно составляет более 50 % стоимости всех полезных компонентов;
- комплексные серебросодержащие месторождения (в которых серебро входит в состав руд цветных, легирующих и благородных металлов в качестве попутного компонента).
Хотя сами серебряные рудники играют важную роль в мировой индустрии добычи серебра, следует отметить, что большинство доказанных запасов серебра (75 %) приходится на составные месторождения.
Физические свойства


Чистое серебро — это довольно тяжелый (легче свинца, но тяжелее меди), необычайно ковкий серебристо-белый металл (коэффициент отражения света близок к 100 %). Тонкая серебряная фольга имеет фиолетовый цвет в проходящем свете. Со временем металл тускнеет, вступая в реакцию со следами сероводорода в воздухе, образуя серные отложения. Он обладает высокой теплопроводностью. При комнатной температуре он обладает самой высокой электропроводностью среди всех известных металлов.
Относительная молекулярная масса (Mr) — это число, показывающее, во сколько раз масса данной молекулы больше, чем 1/12 массы атома углерода, в то время как относительная атомная масса элемента (Ar) — это во сколько раз средняя масса атомов химического элемента больше, чем 1/12 массы атома углерода.
Поскольку серебро в свободном состоянии находится в виде одноатомных молекул Ag, его атомная и молекулярная массы совпадают. Они равны 107,8682.
Известно, что серебро встречается в природе в виде двух стабильных изотопов 107 Ag и 109 Ag. Их массовые числа равны 107 и 109 соответственно. Ядро изотопа серебра 107 Ag содержит сорок семь протонов и шестьдесят нейтронов, а ядро изотопа 109 Ag содержит такое же количество протонов и шестьдесят два нейтрона.
Существуют искусственно нестабильные изотопы серебра с массовыми числами от 93 до 130 и тридцатью шестью изомерными ядрами, из которых самым долгоживущим изотопом является 104 Ag с периодом полураспада 69,2 минуты.
На практике чистое серебро редко используется из-за его мягкости: Обычно его легируют большим или меньшим количеством меди. Серебряные сплавы используются для изготовления ювелирных изделий и предметов домашнего обихода, монет и лабораторного оборудования.
| По заказу | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении 40 г соли в 20 моль воды. |
| Решение | Найдем массу воды (молярная масса 18 г/моль): |
m (H2O)= 20 × 18 = 360 г.
Вычислите массовую долю раствора нитрата серебра:
mРешение(AgNO3) = 40 + 360 = 400 г.
Рассчитайте массовую долю нитрата серебра в растворе:
ω (AgNO3)=40 / 400 × 100% = 10%.
| По заказу | Растворите 3 г сплава меди и серебра в концентрированной азотной кислоте, чтобы получить 7,34 г нитратной смеси. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь нитрата серебра и нитрата меди(II), предполагая, что массовая доля меди составляет x моль, а массовая доля серебра — y моль. Тогда массы этих металлов равны (молярная масса меди равна 64 г/моль, серебра — 108 г/моль):
m (Cu) = n (Cu) × M (Cu),
m (Cu) = x × 64 = 64x.
m (Ag) = n (Ag) × M (Ag),
m (Ag)= x × 108 = 108y.
По условиям задачи масса сплава равна 3 г, т.е:
Согласно уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, таким образом n(Cu(NO(Cu(NO)) = 1:1, таким образом n(Cu(NO)) = 1:1, таким образом n(Cu(NO)) = 1:1.3)2) = n(Cu) = x. Тогда масса нитрата меди(II) (молярная масса равна 188 г/моль) равна 188х.
Согласно уравнению (2) n(Ag) : n(AgNO3) = 1:1, поэтому n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса 170 г/моль) 170y.
Согласно задаче, масса смеси нитратов составляет 7,34 г:
188 x + 170 y = 7,34.
Мы получили систему уравнений с двумя неизвестными:
 Нахождение в природе
Нахождение в природе
Если посмотреть на состав земной коры, то в ней содержится около 70 миллиграммов серебра на тонну. Это не так много. С древних времен серебряные монеты и предметы имели высокую стоимость, что уже говорит о редкости и ценности материала.

Сплавы этого материала встречаются реже, чем чистая руда, но с сегодняшними технологическими достижениями материал легко переработать для выделения нужной фракции.
Интересно отметить, что нередко экскаваторы натыкались не на руду, а на самородки огромных размеров. Истории известен один случай, когда был найден серебряный самородок весом в 20 тонн! Были найдены и другие самородки весом 500-600 кг.
Крупнейшие месторождения серебра в мире
Распределение этого ценного ресурса на поверхности планеты крайне неравномерно. Наиболее интенсивная добыча этого материала происходит в Перу — эта страна является абсолютным лидером по количеству добываемого здесь серебра. В среднем в Перу ежегодно добывается около 110 миллионов унций этого материала.

Польша также является одним из крупнейших производителей серебра, но об этом мало кто знает. Здесь добывается около 40,5 миллионов унций серебра.
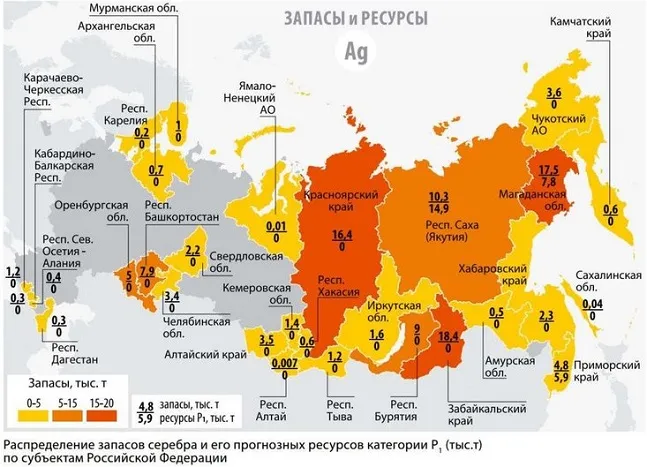
Россия и страны постсоветского пространства располагают примерно 12-15% мировых запасов серебра. Горнодобывающая промышленность здесь хорошо развита и ежегодно производит тонны материала. Австралия также является одним из счастливчиков, обладающих этим ресурсом. В остальном мире серебра не так много, но всегда есть возможность обнаружить еще неизвестные месторождения.
Иодид AgI
Это наименее растворимый из галогенидов серебра, т.е. в отличие от AgCl и AgBr, он нерастворим в аммиачных растворах, но растворим в присутствии ионов CN и S2O².3— образует более прочные комплексы с серебром, чем с аммиаком. Замечательная растворимость AgI наблюдается также в концентрированных растворах йодидов щелочных металлов, что объясняется образованием ионных комплексов AgI-2.
Очень характерным и важным свойством нерастворимых галогенидов серебра является их светочувствительность, которая заключается в их разложении на металлическое серебро и свободный галогенид при воздействии света:
Это свойство галогенидов серебра является основой для их использования в производстве светочувствительных пленок, пластин и бумаги. Фоточувствительность галогенидов серебра увеличивается с увеличением AgI
Галогенид серебра по своим свойствам очень похож на цианид AgCN. Он выпадает в виде белого осадка при добавлении цианистого раствора щелочного металла (без избытка) к раствору, содержащему ионы Ag⁺. Как и галогениды серебра, AgCN практически нерастворим в воде (произведение растворимости 2,3-10-¹⁶) и в разбавленных кислотах, но растворим в растворах аммиака, тиосульфата и цианистых солей вследствие образования комплексных соединений. В отличие от галогенидов, цианид серебра не разлагается под воздействием света.
Нитрат серебра
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgNO3 получается при действии азотной кислоты на металлическое серебро:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O.
Нитрат серебра представляет собой бесцветный, негигроскопичный кристалл, который плавится при температуре 208,5 °C; при температуре выше 350 °C он термически разлагается. AgNO3 очень хорошо растворяется в воде. При 20 °C его растворимость составляет 222 г на 100 г воды; при 100 °C она увеличивается до 952 г на 100 г. В присутствии органических веществ нитрат серебра чернеет в результате частичного восстановления до металла.
Нитрат серебра является технически наиболее важным соединением этого металла. Эта соль служит исходным продуктом для производства других соединений серебра. Водный раствор AgNO3 используется в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2SO4
Его можно получить, растворив металлическое серебро в горячей концентрированной серной кислоте:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O.
Сульфат серебра образует бесцветные кристаллы, которые плавятся при температуре 660°C. При температуре выше 1000°C он термически разлагается. Растворимость Ag2SO4 в воде низкая, при 25 °C она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше из-за образования более растворимого двухвалентного сульфата AgHSO4.
Сульфат серебра Ag2S является самой нерастворимой солью этого металла (произведение растворимости составляет 6,3- 10-⁵º) и выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Ag2S также образуется, когда H2S действует на металлическое серебро в присутствии влаги и атмосферного кислорода,
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Как упоминалось ранее, этот процесс является причиной темного цвета серебра при длительном хранении. Сульфид серебра также может быть получен непосредственно из элементов путем нагревания металлического серебра с элементарной серой.
В цианистых растворах Ag2S растворяется, образуя комплексное соединение:
Ag2S + 4CN- ⇄ 2Ag(CN)-2 + S²-.
Эта реакция является обратимой, ее протеканию слева направо способствует увеличение концентрации ионов CN и удаление ионов S² путем окисления кислородом в нагнетаемом воздухе.
Ag2S не реагирует с разбавленными минеральными кислотами. Концентрированная серная и азотная кислоты окисляют сульфид серебра до сульфата. При нагревании на воздухе Ag2S разлагается на металлическое серебро и диоксид серы:
Ag2S + O2 = 2Ag + SO2
Из вышеупомянутых соединений серебра особый интерес для гидрометаллургии этого металла представляют хорошо растворимые цианистые соединения калия, натрия и кальция. Как и аналогичные соединения золота, цианидные комплексы серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода на воздухе:
4Ag + 8CN- + O2+ 2Н2O = 4Ag(CN)7 + 4ON-
Эта реакция, как и реакция с золотом, лежит в основе процесса цианирования. Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III) с образованием AgCS(NH2)2⁺2
Статья о химических свойствах серебра
Похожие страницы:
Какие бывают соли серебра Амид серебра (AgNH2) Антимонид серебра (Ag3Sb) Арсенат серебра (Ag3AsO4) Арсенат серебра (Ag3As).
Как и золото, серебро встречается в естественном состоянии. Однако он гораздо чаще встречается в рудах этого региона.
ЗАГРЯЗНЕНИЕ СЕРЕБРОМ Комплекс мероприятий по очистке загрязненного материала от посторонних примесей, для дальнейшего извлечения высокочистого серебра. Это.
Ионные уравнения Обычные химические уравнения не учитывают расщепление молекул на ионы, чтобы выразить характер реакций, происходящих при взаимодействии.
Реакции в растворах электролитов как реакции их ионов Главная ценность теории электролитического разложения заключалась в том, что она была абсолютной.
Хлорид серебра — это химическое вещество, состоящее из серебра и хлора, сложного вещества, которое встречается в природе в виде минерала хлоралюминия.
Возникновение названия и его вариации
Название argentum (лат. «белый») происходит от санскритского слова argenta, что означает «свет». Русское название «серебро», английское «silver» и немецкое «Silber» имеют другое происхождение — от слова «sarpa». Так называлась луна на древнеиндийском языке. Все названия материала связаны с описанием его внешнего вида: Это блестящий металл с характерным серебристым блеском, похожий на загадочный спутник Земли.

Как простое вещество, это мягкий или иначе податливый, благородный металл светло-серого цвета и хорошей пластичности. Его решетка имеет кубическую, сварную форму с лицевой стороной в центре.
Ученые обнаружили более трех десятков радиоактивных изотопов и изомеров серебра. Их массовые числа варьируются от 99 до 123. Сам химический элемент состоит только из двух изотопов с массовыми числами 107 и 109. Последний имеет самый длительный период полураспада из всех — 130 лет.
Среди характерных свойств серебра особенно следует отметить его теплопроводность — она самая высокая по сравнению с другими металлами. Его электроотрицательность составляет 1,93 по шкале Паулинга.

Серебро — это тяжелый металл с атомным (молекулярным) весом около 108 дальтонов (граммов на молекулу) и плотностью 10,5 грамма на кубический сантиметр. Его атомный радиус составляет 144 пм, а ковалентный радиус — 134 пм. Металл плавится при температуре 962 градуса Цельсия.
Области использования

В областях, где используется серебро (а их много), этот металл поистине незаменим. Он используется в фотографии благодаря своей высокой чувствительности к свету. Йодид серебра также используется при разгоне облаков, например, во время авиашоу, парадов и т.д.
Этот элемент является компонентом многих сварных швов и сплавов, используемых для изготовления различных изделий. Использование серебра в качестве контактного элемента в электротехнике, электронике и для конденсаторов привело к появлению таких свойств материала, как:
- стойкость к кислородному окислению (в обычных условиях);
- большая теплопроводность;
- сильная электропроводность.
Этот элемент играет важную роль, в частности, в инфракрасной оптике и медицине. Он часто используется в качестве дезинфицирующего средства, в основном для обеззараживания воды.
Этот металл также используется для производства серебра:
- высокоотражающее зеркальное покрытие (простые зеркала покрываются алюминием);
- покрытия для радаров;
- стекла для дозиметрии излучений;
- батареи и аккумуляторы;
- детонаторы;
- пищевые добавки.
Однако основное применение серебра, конечно же, в производстве ювелирных изделий. В основном он используется в сплавах, а не в чистом виде:
- обычно — с медью;
- реже — с никелем и прочими металлами.

Монеты также чеканятся из серебра. Сегодня он используется исключительно для коллекционных и памятных монет. Но до семидесятых годов двадцатого века он также использовался для изготовления оборотных монет. Даже сегодня серебро используется для чеканки медалей и орденов. Часто инвесторы используют металл в качестве инвестиционного инструмента для диверсификации рисков.
Количество заявок на серебро буквально растет с каждым днем, и список их практически бесконечен. Этот элемент играет важнейшую роль в существовании человечества, и последствия его исчезновения, по какой бы причине оно ни произошло, вероятно, будут катастрофическими.








