Это открытие, с одной стороны, удивительно, поскольку не существует эффективного метода, позволяющего избавить рутений от примесей, а с другой — обнадеживает, поскольку теоретические свойства вещества весьма завидны. Так или иначе, рутений невозможно освободить от присущей ему хрупкости.

История
Он был открыт в 1844 году Карлом Клаусом, профессором Казанского университета. В том же году он опубликовал длинную статью о новом элементе в «Ученых записках Казанского университета»: «Химические исследования уральской платиновой руды и металлического рутения». Клаус сообщил об открытии, процессе производства и свойствах нового элемента в письме на немецком языке Г. И. Гессу, который зачитал его на заседании Петербургской академии наук 13 сентября 1844 года; текст был опубликован в «Вестнике Академии» и в русском переводе в «Горном журнале». Клаус выделил рутений из уральской руды белого золота в чистом виде и указал на сходство между триадами рутений — родий — палладий и осмий — иридий — платина.
Происхождение названия
Первооткрыватель элемента, К.К. Клаус, назвал рутений в честь России (Ruthenia — латинское название России). Название «рутений» было предложено Г.В. Озанном в 1828 году для элемента, который был выдан за новый элемент, и Клаус, открывший новый элемент в 1844 году, дал ему это название.
Производство рутения в 2009 году составило 17,9 тонн, а мировые запасы рутения оцениваются в 5 000 тонн. 27 мая 2016 года цена рутения составляла 42 доллара США за тройскую унцию (около 1,35 доллара США/г).
Изотопный состав
Природный рутений состоит из семи стабильных изотопов:
96 Ru (5,7% по массе), 98 Ru (2,2%), 99 Ru (12,8%), 100 Ru (12,7%), 101 Ru (13%), 102 Ru (31,3%) и 104 Ru (18,3%).
Физические свойства
Что касается его преломляющей способности (Tпл= 2334 °C), рутений уступает лишь нескольким элементам — рению, осмию, молибдену, молибдену, иридию, вольфраму, танталу и ниобию.
Химические свойства
Рутений — очень инертный металл.
Неорганические соединения
Рутений нерастворим в кислотах и в aqua regia (смеси HCl и HNO).3Однако при температуре выше 400 °C рутений вступает в реакцию с хлором (образуя RuCl3) и консервируется смесью щелочей и нитратов (образуя соли рутения, например, Na2RuO4).
Рутений способен образовывать соединения, соответствующие различным степеням окисления:
Соединения рутения также представлены широким спектром нитрозосоединений, содержащих группу RuNO. Эти комплексные соединения, особенно нитрозонитроамины (например, RuNO(NO2)2(NH3)2OH) и нитро-нитро комплексы (особенно анионный комплекс RuNO(NO2)4OH 2- ) (желто-оранжевые) обладают высокой стабильностью и кинетической инерцией.
Тетраоксид рутения (Ru +VIII O4) по своим свойствам очень похож на тетраоксид осмия.
Органическая химия рутения
Рутений образует различные металлоорганические соединения и является активным катализатором.
История открытия рутения
Рутений был впервые открыт в 1827 году немецким химиком Готфридом Аузанном, который извлек новые химические элементы из платиноносных руд на Урале. В результате этой работы среди трех новых металлов был открыт рутений. Однако мэтр науки, швед Берцелиус, отверг работу Озанна, заявив, что тот допустил ошибку и что рутений не может содержаться в осадке. Таким образом, открытие рутения было заброшено на 13 лет.
В 1844 году немец Карл Клаус, профессор Казанского университета, с рождения живший в России, решил повторить исследования Озанна, и Берцелиус получил информацию о производстве металлического рутения из необработанной платины. Уже в 1845 году мировая наука признала новое открытие драгоценного металла рутения, сделанное русским ученым.
Спустя столько лет рутений все еще не до конца изучен и продолжает привлекать ученых, которые открывают все новые и новые его свойства.
Свойства рутения

Рутений обладает лучшими свойствами среди платиноидов, а именно сверхтвердостью и невероятной устойчивостью к другим химическим веществам. Твердость металла составляет 6,5 по шкале Мооса, что превосходит твердость платины. Рутений — восьмой по тугоплавкости металл в мире после осмия и иридия. Температура плавления этого драгоценного металла составляет 2334 ?
Рутений интересен еще и тем, что он может легко и неожиданно принимать различные валентные состояния, что до сих пор озадачивало химиков, изучавших этот уникальный металл.
В мире насчитывается всего пять тысяч тонн рутения, а в земной коре — 0,0000005%. Большая часть этого редкого металла содержится в отходах производства платины. Кроме того, рутений встречается в качестве примеси в полиметаллических рудах, в минералах лазурит и арсенид рутения, а также в продуктах распада радиоактивных металлов, причем в одной тонне переработанного топлива содержится 250 граммов этого редкого металла.
Добыча и применение рутения

Рутений добывается в России, Канаде и Южной Африке. Основным поставщиком драгоценного металла является Южная Африка. Ежегодно в мире добывается 17-21 тонна рутения.
Рутений в основном используется в электронной промышленности. Электрохимия является вторым крупнейшим потребителем рутения, за ней следуют химикаты. В остальной промышленности рутений используется в пропорции 10% или менее.
Рутений редко используется в ювелирном деле. Рутений в основном используется в сплавах для повышения прочности или в качестве покрытия для повышения прочности ювелирных изделий.
Химическая промышленность ценит рутений за его уникальную способность не вступать в реакцию с другими веществами и за его кристаллические свойства.
Рутений также используется в электротехнической, радиовещательной и аэрокосмической промышленности. Рутениевые сплавы используются в производстве компонентов и сплавов для точных приборов. Рутений используется, например, в производстве компасов, особенно компасных игл, которые этот металл делает податливыми и чрезвычайно прочными.
Рутений также биологически активен, поэтому его соединения полезны при лечении рака и кожных заболеваний.
Автор: Виктория Голдин, Дата публикации: 16.12.2010 Дата обновления: 15.03.2018 Перепечатка без активной ссылки запрещена.

Применение рутения довольно ограничено из-за его редкости. Большая часть металла используется в электронной промышленности. Он зарегистрирован с 2006 года и в основном играет роль вертикального элемента магнитной записи. Причиной использования рутения является его гексагональная кристаллическая структура, которая имеет такую же стабильную кристаллическую решетку, как и используемый сплав памяти. Тонкие слои рутения используются в электрических контактах, таких как контактные кольца или реле. По сравнению с другими металлами, которые могут быть использованы, например, кобальтовым золотом, они более твердые и поэтому более устойчивы к истиранию.
Как и другие платиновые металлы, рутений также обладает каталитическим действием. Таким образом, он может участвовать в гидрогенизации соединений ароматических кислот и кетонов. Рутений также является катализатором метанации — производства метана из водорода и монооксида (или диоксида) углерода. Более низкие температуры, необходимые для метанирования рутения, могут представлять интерес для длительных космических полетов, поскольку углекислый газ, выдыхаемый астронавтами, может быть преобразован и замкнуть кислородный цикл.
Подобно железу и осмию, рутений также катализирует синтез аммиака из азота и водорода. Он обладает более высокой каталитической активностью, чем железо, и поэтому обеспечивает более высокий выход при более низком давлении. Применение металла в основном ограничено его ценой. Рутениевый катализатор, нанесенный на углеродную матрицу и обогащенный барием и цезием в качестве промоторов, используется в промышленных масштабах на двух производственных заводах KBR в Тринидаде с 1998 года. Поскольку медленное метанирование углеродной матрицы препятствует процессу, продолжаются исследования по созданию безуглеродных рутениевых катализаторов для синтеза аммиака.
Небольшое количество рутения используется в сплавах палладия или платины для повышения твердости. Сплавы, содержащие рутений, используются, в частности, для изготовления шариковых ручек или зубных пломб. Небольшое количество рутения (0,1 %) делает титановые сплавы более устойчивыми к коррозии, что важно для применения в химической промышленности или на нефтяных месторождениях. Это возможная альтернатива палладию. Рутений также может быть легирующим компонентом в жаропрочных сплавах на основе никеля, используемых для изготовления лопаток турбин, что влияет на улучшение фазовой стабильности.
В основном рутений используется не в металлической форме, а в виде соединений, особенно в форме оксида рутения(IV), который используется, в частности, в качестве материала для резисторов и электродов, например, для покрытия титановых анодов при хлорщелочном электролизе. Бета-поппер 106 Ru используется для лучевой терапии хориоидеи и меланомы.
Интересные факты
Интересных данных о рутении не так много, поскольку он редок и не изучен. Рутений, как и другие платиновые металлы, не распространен в организме человека. Отдельные соединения рутения обладают фармакологическим потенциалом. В настоящее время этот элемент исследуется в качестве активного вещества. То есть вещество, которое может вызывать определенные реакции в организме человека при внутреннем и внешнем применении. Уже есть положительные результаты по его использованию в качестве цитостатика. Это означает, что определенные соединения рутения подавляют деление клеток в живых организмах. Это исследование может оказать положительное влияние на методы лечения (или, по крайней мере, контроля) рака. Помимо противоракового эффекта различных соединений платиновых металлов, это в основном основано на трех свойствах комплексов рутения:
- медленный обмен лигандами (комплекс может достигать нужного места в организме, не реагируя с водой или другими молекулами);
- несколько возможных степеней окисления (+2, +3, +4) в физиологических условиях;
- имеет большое сходство с железом ( соединения рутения могут замещать его в белках, таких как трансферрин).
Помимо использования в химиотерапии для борьбы с раком, изучаются возможности применения соединений рутения в качестве иммунодепрессантов, антибиотиков и противомикробных препаратов, например, для борьбы с малярией или болезнью Шагаса.
Как металл, рутений нетоксичен. В отличие от осмия, токсичный и очень летучий тетраоксид образуется не при взаимодействии с кислородом при комнатной температуре, а только при взаимодействии с сильными окислителями. В виде порошка рутений очень огнеопасен, и его нельзя тушить водой, а только порошковыми или металлическими огнетушителями. Рутений — это серебристо-белый, твердый и хрупкий металл. С плотностью 12,37 г/см3 это вторая по легкости платина после палладия. Рутений плавится при температуре 2606 К и кипит при температуре около 4423 К. При температуре ниже 0,49 К элемент становится сверхпроводящим.
Где используется?
Поскольку рутений не окисляется и имеет приятную окраску и блеск, его часто используют в ювелирных изделиях. Однако не существует изделий из чистого металла, поскольку он считается редким товаром. Платина хрупкая, поэтому ее используют в качестве застежки из сплава драгоценных металлов.
Высокая стоимость рутения и его низкая пластичность способствуют его использованию в качестве покрытия для ювелирных изделий. Его присутствие в ювелирных изделиях делает титановые украшения более устойчивыми к коррозии, а золотые и платиновые — более долговечными. Рутений может использоваться в качестве добавки, которая делает золото черным.
Соединения рутения используются в стекольной промышленности. Некоторые эмали содержат этот драгоценный металл в своем составе. Кроме того, рутений входит в состав флуоресцентного покрытия, которое светится от его присутствия.
В медицине рутений используется в качестве красного красителя. Он выделяет определенные типы тканей, которые можно исследовать под микроскопом.


Известно, что рутений окрашивает опухоли и делает их видимыми при исследовании человеческого тела. Это позволяет врачам увидеть каждую из пораженных клеток. Рутений также используется в производстве лекарств против туберкулеза, инфекционных и кожных заболеваний. Невозможно представить космическую промышленность без этого драгоценного металла.
Поскольку рутений жаропрочен, он является важным сырьем для термопар, используемых для измерения высоких температур. В электротехнической промышленности рутений используется в чистом виде. Рутений наносится тонким слоем на радиодетали для достижения антикоррозийного эффекта. Благодаря этому покрытию изделия химически неразрушимы и механически износостойки.


Перспективы производства
Хотя рутений добывается в небольших количествах — до 5 000 тонн — он считается отходами. Этот минерал не добывается в чистом виде, а отделяется в процессе производства платины. Дорогой металл покупают в основном промышленные компании, он ценится сейчас и будет цениться в будущем. До сих пор известно, что рутений используется в производстве алмазов.
Уже сегодня этот драгоценный металл пытается конкурировать с платиной, иридием и родием. Ученые считают, что в будущем можно многого ожидать от использования покрытий на основе рутения, которые делают изделия более устойчивыми к коррозии, механическим и химическим повреждениям. Уникальное свойство металла поглощать и пропускать водород может быть использовано для производства чистого водорода в будущем.


Интересные факты
Существует множество интересных фактов о металле серебро.
- Рутений – это единственный металл, который в России вывели путем извлечения из минерального сырья.
- До настоящего времени ни у кого не получалось добыть 100% устойчивый рутений, так как элемент характеризуется высокой химической активностью.
- Рутений – очень тугоплавкий металл, в этой характеристике ему уступают только рений, осмий, молибден, иридий, вольфрам, тантал, ниобий.
- Уникальность рутения заключается в его многовалентности, он имеет возможность к проявлению в 9 разных валентностях.
- Данный благородный металл невозможно растворить в кислоте и «царской водке».
- Этот элемент считается единственным, который имеет возможность к связыванию воздушного азота в химическое соединение. Такую способность имеют некоторые виды бактерий.
- В природе встречается одно вещество с рутением – лаурит.
- Относительно большое количество рутения находится в России, Канаде и США.
- Рутений – это редкий высоковалентный металл с уникальными свойствами. Его высший оксид считается довольно ядовитым веществом.
Являясь сильным окислителем, рутений способен воспламенять легковоспламеняющиеся вещества.



В следующем видеоролике вы найдете больше информации о рутении.
Карл Карлович Клаус, «папа» рутения
В истории исследований платиноидов появилось несколько ученых. Среди них К. Клаус — химик, фармацевт и философ.

Карл Клаус — русский химик, фармацевт и ботаник, основатель химии платины и ее спутников в России, учитель А.М. Бутлерова, член-корреспондент Академии наук в Петербурге (1861) и Берлине (1863).
В детстве он был сиротой. Он жил в бедных условиях, даже не закончил школу, но отличился своей любознательностью и самообразованием. Именно поэтому он сдал экзамен, чтобы стать фармацевтом. Он переехал в Казань и стал управляющим аптеки. В возрасте 32 лет, будучи женатым и отцом троих детей, он решил продолжить обучение.
У талантливых людей широкий круг интересов. Клаус интересовался ботаникой и изучал растения Трансвольгаштрассе. А во время учебы (у него была семья, которую нужно было содержать) он работал лаборантом.
Он закончил обучение в Дерптском университете, защитил диссертацию и вернулся в Казань. Здесь я был заведующим химической лабораторией в Казанском университете и заинтересовался химией.
Хорошему игроку достается карта. В 1840 году платиновая руда была отправлена в университет, и начались исследования.
После четырех лет работы был обнаружен новый платиноид — металл под названием рутений. Награда за это открытие была немаленькой. Ученый получил Демидовскую премию (5000 рублей), внушительную сумму по тем временам.
Клаус написал о своем открытии:
«Больше целого года я работал над этим вопросом, но в конце концов открыл простой и безопасный метод получения его в чистом виде. Этот новый металл я назвал у нас на родине рутением.
Удивительные свойства
Свойства рутения во многом парадоксальны. Некоторые химики считают, что свойства металла зависят от … метода получения платины. Проблема в том, что до сих пор не существует эффективного способа избавить рутений от примесей. Ученые и исследователи облизывают пальцы при мысли о свойствах (теоретически) капризного платинового металла. Однако до сих пор не удалось получить химически чистый рутений.
Рекомендуется: Никель — «пасынок» в семье серебряных металлов
| Свойства атома | |
|---|---|
| Имя, символ, номер | Рутений / Ruthenium (Ru), 44 |
| Атомная масса (молекулярная масса) | 101,07(2)1 op. cit. (г/моль) |
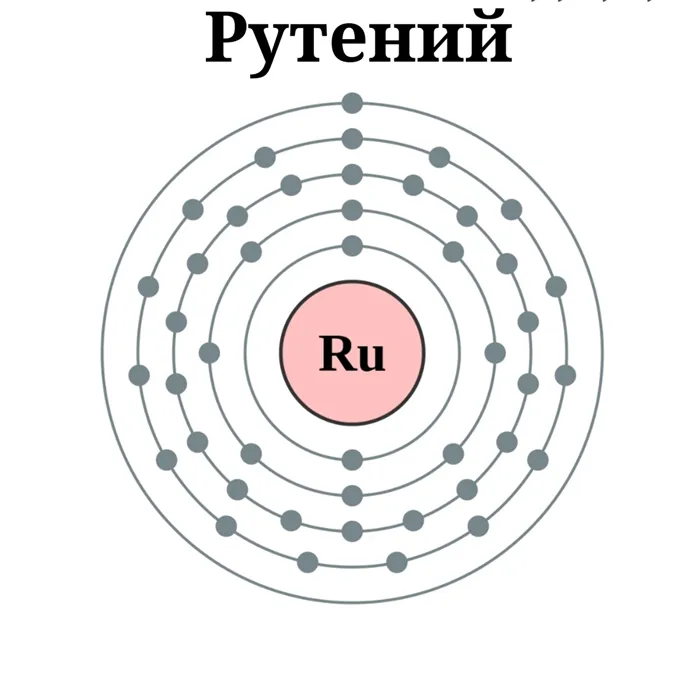
| Электронная конфигурация | Кр 4d7 5s1 |
| Атомный радиус | 134 мкм |
| Химические свойства | |
| Ковалентный радиус | 125 мк.м. |
| Ионный радиус | (+4e) 67 м |
| Электромагнетизм | 2,2 (по шкале Паулинга) |
| Электродный потенциал | |
| Состояния окисления | +3, +4, +6, +8, 0 |
| Энергия ионизации (первый электрон) | 710,3 (7,36) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (в н.у.м.) | 12,41 г/см³ |
| Температура плавления | 2334 °C2 (2607 K, 4233 °F) |
| Температура кипения | 4077 °C2 (4350 K, 7371 °F) |
| Удельная теплота плавления | (25,5) кДж/моль |
| Молекулярная теплоемкость | 24,02 Дж/(К-моль) |
| Молекулярный объем | 8,3 см³/моль |
| Кристаллическая решетка одного вещества | |
| Решетчатая структура | шестигранный |
| Параметр решетки | a=2.706 c=4.282 Å |
| соотношение с/х | 1,582 |
| Температура Дебая | 600 K |
| Другие характеристики | |
| Теплопроводность | (300 K) 117,0 Вт/(м-K) |
| номер CAS | 7440-18-8 |
Газопоглощающая способность металла поразительна. Один объем металла может поглотить более 1500 объемов водорода; азот он «съедает» с несколько меньшим аппетитом и не выделяет неметаллических элементов.
Поучительно: самым дорогим взрывчатым веществом в мире является, по-видимому, оксид рутения (RuO4), который ни в чем не уступает своему «родственнику», мелкозернистому родию. Однако маловероятно, что террористы будут заинтересованы в этом материале для своих незаконных целей…..
Немного химии
Это не урок, и мы не будем ставить оценок (если вам понравилась статья — поставьте ей оценку и поделитесь с друзьями, мы будем рады).
Вспомните картину Менделеева. В нем представлены все химические элементы земли. Буквально все вокруг вас и (простите) вы сами состоите из этих элементов, аккуратно расположенных в таблице Менделеева.
Кстати, история о том, что именно Менделеев определил оптимальный для употребления уровень водки в 40°, не соответствует действительности. Он не ставил ее и не пил водку — предпочитал вино.
Таблица не только классифицирует данные, но и дает возможность группировать данные по схожим характеристикам. Рутений относится к VIII группе таблицы и хорошо вписывается в семейство из шести металлов. Все они занимают свое место в таблице Менделеева, и каждый имеет порядковый номер.
Сразу следует сказать, что платиноиды не подходят для изготовления ювелирных изделий.

Хорошо видна крупнокристаллическая структура рутения, образовавшаяся во время застывания расплава.
Использование металла в электрохимической и химической промышленности необходимо и оправдано.
- Рутениевые катализаторы используют в системах очистки космических аппаратов.
- Металл применяются в металлургии как легирующая добавка. Такие сплавы необходимы в изготовлении турбин реактивных аппаратов, деталей ракет, работающих в условиях высоких температур.
- Газопоглотительные способности рутения дали возможность изобрести технологии получения графена. Он может использоваться как сверхчувствительный сенсор в обнаружении отдельных молекул веществ. Перспективная область — применение графенов в суперконденсаторах (ионисторах). Фотодетекторы и светодиоды новых типов ждут графенов.
- Поможет рутений криминалистам. Из его соединений получают пудру, способную обнаружить очень слабые следы отпечатков.
- Добавление металла в краску позволит окрашенной поверхности поглощать солнечную энергию — это еще одна отрасль применения металла, солнечная энергетика.
- Покрытие рутением изделий и материалов удлиняет срок их службы.
В целом, ученые возлагают большие надежды на рутений.
Промышленное получение
Рутений считается благородным элементом, а основным источником металла являются отходы производства платины. Южная Африка является бесспорным лидером по добыче рутения (а также платины). Россия, Канада и Зимбабве также разрабатывают и производят этот металл. Последняя страна, кстати, занимает второе место в мире по доказанным запасам платинового металла.
Количество рутения, доступного на рынке, составляет от 17 до 20 тонн в год. Цикл производства рутения занимает около 6 недель и состоит из непрерывной цепи последовательных термохимических реакций.
Технология получения рутения была разработана путем нейтронного облучения радиоактивных изотопов технеция. Однако следует отметить, что выделение чистого и стабильного металла остается несбыточной мечтой из-за его химических свойств, непредсказуемости и недостаточной изученности.
Применение: от химической промышленности до криминалистики
Сразу следует сказать, что платиноиды не подходят для изготовления ювелирных изделий.

Хорошо видна крупнокристаллическая структура рутения, которая образуется при застывании расплава.
Использование металла в электрохимической и химической промышленности необходимо и оправдано.
- Рутениевые катализаторы используют в системах очистки космических аппаратов.
- Металл применяются в металлургии как легирующая добавка. Такие сплавы необходимы в изготовлении турбин реактивных аппаратов, деталей ракет, работающих в условиях высоких температур.
- Газопоглотительные способности рутения дали возможность изобрести технологии получения графена. Он может использоваться как сверхчувствительный сенсор в обнаружении отдельных молекул веществ. Перспективная область — применение графенов в суперконденсаторах (ионисторах). Фотодетекторы и светодиоды новых типов ждут графенов.
- Поможет рутений криминалистам. Из его соединений получают пудру, способную обнаружить очень слабые следы отпечатков.
- Добавление металла в краску позволит окрашенной поверхности поглощать солнечную энергию — это еще одна отрасль применения металла, солнечная энергетика.
- Покрытие рутением изделий и материалов удлиняет срок их службы.
В целом, ученые возлагают большие надежды на рутений.
Промышленность
Основной потребитель металла.
Он используется в следующих отраслях промышленности:
- Производство электроники.
- Электрохимия.
- Химическое производство.
90% сырья используется в этих отраслях.
90 % сырья используется в этих отраслях:
- Он наделен уникальным свойством избирательности в реакциях. За это востребован при синтезировании органических и неорганических веществ.
- В паре с ним каталитическая активность платины повышается.
- Рутениевые соединения используются как суперокислители, пигменты в составе стекла, эмалей.
Современная промышленность не испытывает недостатка в рутении как легирующем элементе:
- Из них делают узлы, контакты приборов повышенной точности для нужд радио-, электро-, аэрокосмической техники, оборонного комплекса. Для этого достаточно 1,1-4,9% рутения в сплаве.
- 0,1% рутения, добавленная к титану, кратно повышает антикоррозионные свойства последнего.
- Рутениево-платиновый симбиоз – материал для изготовления топливных систем, систем по очистке воды на космических кораблях.
- Тугоплавкий металл добавляют в сплавы при изготовлении приборов, замеряющих сверхвысокие температуры.
Чистый рутений используется для покрытия особо важных компонентов, чтобы сделать их механически и химически более прочными.
Ювелирное дело
Металл используется в ювелирных изделиях двумя способами: как укрепляющий компонент сплава и как твердое покрытие.
Изделия из сплавов рутения особенно долговечны, так как они прочны и износостойки (кольца, браслеты).
Рутениевое покрытие образует на поверхности предмета пленку различных оттенков от графитового до черного.
Вместе с родием они образуют прекрасное черное золото.
Перспективы производства
Хотя рутений добывается в небольших количествах — до 5 000 тонн — он считается отходами. Этот минерал не добывается в чистом виде, а отделяется в процессе производства платины. Дорогой металл покупают в основном промышленные компании, он ценится сейчас и будет цениться в будущем. До сих пор известно, что рутений используется в производстве алмазов.
Уже сегодня этот драгоценный металл пытается конкурировать с платиной, иридием и родием. Ученые считают, что в будущем можно многого ожидать от использования покрытий на основе рутения, которые делают изделия более устойчивыми к коррозии, механическим и химическим повреждениям. Уникальное свойство металла поглощать и пропускать водород может быть использовано для производства чистого водорода в будущем.


Рутений №44 Ru
Во-первых, некоторые факты об особом положении рутения среди химических элементов. Рутений является одним из аналогов платины. Это самый легкий и, если можно так выразиться, самый «простой» из платиновых металлов. Рутений — самый «универсальный» элемент: он может находиться как минимум в девяти валентных состояниях.

Рутений был первым элементом, который мог связывать азот в воздухе в химическое соединение (рутениевый комплекс), как это делают некоторые бактерии. Еще в 1962 году одному из авторов этой статьи удалось получить комплекс рутения с молекулярным азотом. Синтез этого комплекса (NO)(NH3)4RuN2Ru(NH3)4(НЕТ)Q6. В 1965 году канадский ученый Альберт Аллен получил более простое (также сложное) соединение Ru(NH3)5N2Cl2.
Рутений образуется в ядерных реакторах и при взрыве атомных бомб. Это один из самых неприятных фрагментирующих элементов.
Рутений — элемент, открытый в нашей стране в 1844 году и названный в честь нашей страны. Рутения — это латинское название России. Автором открытия стал профессор Казанского университета Карл Карлович Клаус.
Сегодня рутений ставит перед химиками по меньшей мере три проблемы. Они рассматриваются в этой статье.
Как избавиться от рутения
Рутений обладает многими ценными и интересными свойствами. По многим механическим, электрическим и химическим свойствам он может соперничать со многими металлами, даже с платиной и золотом. Однако, в отличие от этих металлов, рутений очень хрупок, поэтому до сих пор из него не удавалось изготовить изделия. Хрупкость рутения и его плохая обрабатываемость, по-видимому, объясняются недостаточной чистотой исследованных образцов. Физические свойства металла во многом зависят от метода обработки, и никому еще не удалось выделить рутений высокой чистоты. Попытки получить чистый рутений путем брикетирования, зонной плавки и другими методами не дали положительных результатов. По этой причине такие технически важные свойства, как прочность на разрыв и удлинение при разрыве, еще не были точно определены. Только недавно стало известно, что рутений имеет температуру плавления 2250 °C и температуру кипения около 4900 °C. Металл рутений очень активен в поглощении водорода. Палладий, который поглощает 940 см3 водорода на кубический сантиметр, обычно считается эталоном для поглотителя водорода. Поглощающая способность рутения выше. Он поглощает 1 500 кубических сантиметров водорода.
Еще одним важным свойством рутения является то, что он становится сверхпроводящим при температуре 0,47 К. Твердый металл рутений нерастворим в щелочах, кислотах и даже в кипящей водной среде, но частично растворим в азотной кислоте при добавлении сильных окислителей — перхлората или бромата. Рутений может быть растворен в щелочной среде гипохлоритами или в кислой среде электрохимическими методами.
При нагревании на воздухе рутений начинает частично окисляться. Максимальная скорость окисления происходит при температуре 800°C. При температуре до 1000°C рутений окисляется только до RuO2но при нагревании до 1200°C и выше он начинает превращаться в летучий тетроксид RuO, который имеет более высокую валентность 8+.4, который имеет наивысшую валентность 8+.
RuO4— является очень интересным соединением. При нормальных условиях он представляет собой золотисто-желтые, игольчатые кристаллы, которые плавятся при 25°C и превращаются в коричнево-оранжевую жидкость со специфическим, похожим на озон запахом. Тетроксид рутения быстро взрывается при контакте с малейшими следами большинства органических материалов. В то же время он хорошо растворяется в хлороформе и четыреххлористом углероде. RuO4токсичен: при длительном вдыхании его паров у человека возникает головокружение, приступы рвоты и удушье. У некоторых химиков, работающих с тетроксидом рутина, развилась экзема.
Способность рутения образовывать тетрагидроксид сыграла важную роль в химии этого элемента. Превращая его в летучий RuO.4Он используется для отделения рутения от других благородных и неблагородных металлов и для получения более чистого рутения путем восстановления. Этот же процесс используется для удаления примесей рутения из родия, иридия и платины.
Но не металлургия сделала проблему контроля рутения столь актуальной. Самая большая проблема для ученых — ядерная.
Радиоактивные изотопы рутения не встречаются в природе, а образуются при делении урана и плутония в реакторах на атомных электростанциях, на подводных лодках, кораблях и при взрывах ядерных бомб. Большинство радиоактивных изотопов рутения короткоживущие, но два — рутений-103 и рутений-106 — имеют довольно длительный период полураспада (39,8 дня и 1,01 года) и накапливаются в реакторах. При распаде плутония изотопы рутения составляют до 30 % от общей массы всех осколков деления. С теоретической точки зрения этот факт, безусловно, интересен. Есть даже особый «поворот»: мечта алхимиков сбылась — ненадежный металл стал благородным. Сегодня заводы по производству плутония выбрасывают десятки килограммов драгоценного металла рутения. Однако практический ущерб, который этот процесс наносит ядерному механизму, не может быть компенсирован, даже если бы весь рутений, произведенный в ядерных реакторах, мог быть использован с пользой.
Изучение химии рутения и его соединений
Некоторые аспекты химии рутения в разное время изучались многими известными химиками: Berzelius, Saint Clair Deville, Debre, Remy, Werner и др. Было установлено, что рутений по одним химическим свойствам близок к железу, а по другим — к родию и осмию, что он может иметь различные валентности и что стабильный оксид рутения имеет формулу RuO2.
Рутений — редкий и широко распространенный элемент. Это единственный известный минерал, который образуется в естественной среде. Это лаурит RuS2— очень тяжелый черный твердый камень, который очень редко встречается в природе. В некоторых других природных соединениях рутений является лишь изоморфной примесью, доля которой обычно не превышает нескольких десятых долей процента. Незначительные примеси соединений рутения были обнаружены в медно-никелевых рудах на руднике Седбери в Канаде, а затем и на других рудниках.
Ученый А. Е. Ферсман обнаружил следы рутения в магматических кислых породах и во многих минералах. Однако вопрос о диффузии рутения во время эрозии горных пород и его дальнейшей судьбе еще не до конца прояснен. Его растворение осложняется тем, что, с одной стороны, рутений образует малорастворимые оксиды, которые откладываются в обломках горных пород, а с другой стороны, металлические и поверхностные воды растворяют часть рутения, он переходит в раствор и растворяется. Сильные адсорбенты и биохимические агенты могут повторно обогащать рутений из растворов. Повышенные концентрации рутения были обнаружены, например, в минерале пиролюзит MnO2. Некоторые виды растений также обладают способностью накапливать этот элемент, и он особенно концентрируется в корнях бобовых.
Одним из наиболее интересных химических свойств рутения является множество валентностей. Легкость, с которой рутений может переходить из одного валентного состояния в другое, и обилие этих валентных состояний делают химию рутения чрезвычайно сложной и очень специфичной, и здесь еще предстоит найти много пробелов.
Посмотрите на большое количество соединений рутения, представленных ниже, и на множество сложных и плохо изученных соединений между ними (металлы с одним валентным состоянием отмечены символом M).
Валентное состояние рутения в соединениях — примеры соединений.
Очень немногие ученые систематически изучали химию рутения. Некоторые из них опубликовали одну-две работы и изучали другие элементы, а другие, не справившись с лавиной все новых и новых вопросов, оставили работу над рутением незавершенной. По этой причине мы считаем своим долгом упомянуть в этой статье имя советского ученого Сергея Михайловича Старостина, умершего слишком рано и посвятившего всю свою жизнь изучению химии рутения и его соединений. Именно он обнаружил, что огромные трудности, возникающие при отделении рутения от плутония и урана, связаны с образованием и свойствами рутений-нитрокомплексов.
Но вернемся к многочисленным значениям рутения. Если посмотреть на его соединения, то можно обнаружить девять валентностей — от нуля до восьми. Можно подумать, что их больше. Но это еще не все. Рутений также способен образовывать соединения с множественными связями, включающими более одной пары электронов. Помимо ковалентных связей, которые образуются при соединении свободного электрона рутения с электроном любого другого атома, элемент может образовывать и более сложные связи — донорные и донорно-акцепторные. Например, было обнаружено, что в соединении K.4(Ru2OCl10)*H2O Ru ↔ O ↔ Ru (2 x 1,8 A°) является кратным. Она короче и прочнее, чем одиночная связь Ru-O.








