Частица, содержащая разное количество протонов и электронов, называется ионом. Если присутствует больше протонов, ион заряжается положительно и становится катионом. Ионы с отрицательным зарядом (с преобладанием электронов) называются анионами.
Общее описание
Термин «ион» впервые появился в химии в 1834 году благодаря экспериментам Майкла Фарадея. Ученый исследовал электропроводность водных растворов кислот, солей и щелочей. Он предположил, что способность проводить электричество обусловлена движением заряженных частиц — ионов — в растворе.
Молекулы могут распадаться на ионы — атомы с недостатком или избытком электронов. Процесс разложения называется электролитическим разложением, а полученный раствор или расплав — электролитом. Когда электрод погружается в раствор электролита, катионы перемещаются к катоду (отрицательный полюс), а анионы — к аноду (положительный полюс). Это объясняет электропроводность электролитов.
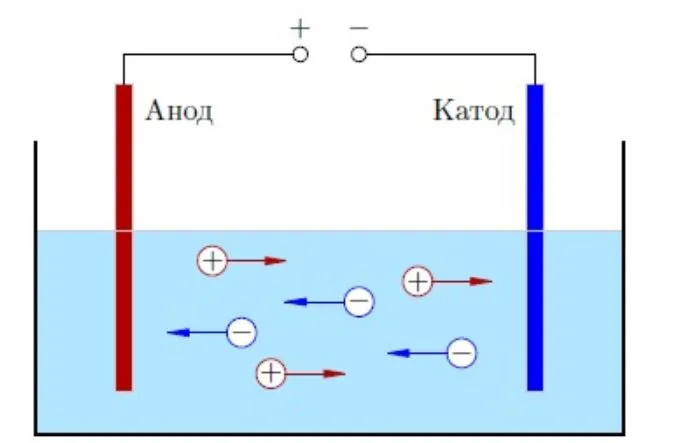
В растворах или расплавах ионы образуются под действием молекул воды или высоких температур.
Строение
Ионы состоят из ядра и электронов, движущихся вокруг него. Атомное ядро состоит из положительно заряженных частиц (протонов) и нейтральных частиц (нейтронов). Число протонов равно номеру класса элемента. Число нейтронов равно значению разности между относительной атомной массой и числом протонов.
Электроны находятся на энергетических уровнях. Количество уровней совпадает с периодом элемента. На внешнем энергетическом уровне находятся валентные электроны, которые могут взаимодействовать с другими атомами. Когда валентные электроны отдаются, атом становится катионом, а когда добавляется дополнительный электрон, он становится анионом.
Например, если к атому хлора добавить еще один электрон, он становится отрицательно заряженным ионом, анионом. Если с атома натрия удалить электрон, он становится положительно заряженным ионом, катионом, поскольку протонов больше, чем отрицательных электронов.
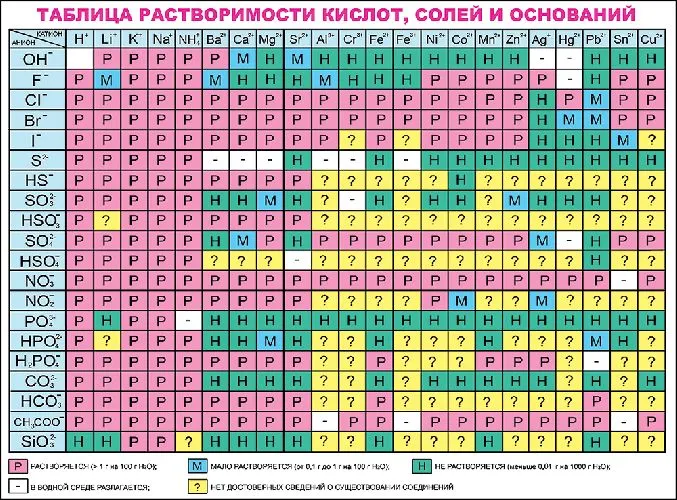
Катионы обозначаются в уравнениях знаком плюс, анионы — знаком минус. Например, Fe 2+, Al 3+, Na +, F -, Cl -. Число показывает, сколько электронов отдал или принял атом в результате превращения в ион, т.е. показывает степень окисления. Количество катионов или анионов можно взять из таблицы растворимости.
Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
Простые ионы включают металлические и неметаллические катионы и анионы — Na +, Mg 2+, Cl -. Комплексные ионы образуются путем присоединения иона к нейтральным молекулам вещества. Например:
Катионы — это ионы металлов, ионы водорода, ионы аммония и некоторые другие вещества. Анионы — это ионы гидроксида (OH — ), ионы кислотного остатка, неметаллы и другие вещества.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Существуют также ионы-радикалы — свободно заряженные частицы, которые могут присоединяться к атомам или соединяться с атомами других веществ. В зависимости от заряда они делятся на радикальные катионы и радикальные анионы.
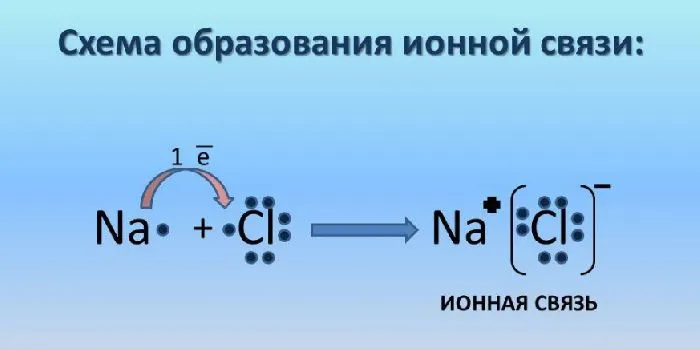
Ионная связь — это класс ионных связей. Ионные связи образуются в результате электростатического притяжения анионов и катионов. Таким образом, атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионные связи возникают в основном между металлическими и неметаллическими ионами. Металл всегда отдает электроны, т.е. является восстановителем.
Положительные ионы — это частицы, несущие положительный электрический заряд. Они называются катионами. Катионы образуются, когда нейтральная частица теряет электрон из своей химической структуры. Положительные ионы могут быть атомами или частицами молекул.
Эти частицы имеют протоны и электроны в равных количествах, чтобы нейтрализовать заряды. Поэтому, когда атом или молекула теряет электрон, образуется дополнительный протон, имеющий положительный заряд. Это придает атому или молекуле чистый положительный заряд. Кроме того, эти ионы принимают различные формы в зависимости от количества атомов, присутствующих в ионных составляющих: одноатомные ионы, двухатомные ионы или многоатомные ионы.
Пример: K +, Na +, NH4+, и т.д.
Что такое Отрицательный ион?
Отрицательные ионы — это частицы, несущие отрицательный электрический заряд. Они называются анионами. Эти анионы образуются, когда нейтральные частицы получают электрон из своей химической структуры. Отрицательные ионы могут быть атомами или частицами молекул.

Эти соединения имеют протоны и электроны в равных количествах для нейтрализации зарядов. Поэтому, когда атом или молекула приобретает электрон, появляется дополнительный электрон, имеющий отрицательный заряд. Это придает атому или молекуле чистый отрицательный заряд. Кроме того, эти ионы встречаются в различных формах как одноатомные ионы, двухатомные ионы или многоатомные ионы, в зависимости от количества атомов, присутствующих в ионных составляющих.
Пример: Cl -, Br -, SO4— и т.д.
В чем разница между Положительным и Отрицательным ионами?
Положительные ионы — это частицы, несущие положительный электрический заряд. Эти ионы образуются, когда атом или молекула теряет электрон. Поэтому положительные ионы имеют больше протонов, чем электронов. С другой стороны, отрицательные ионы — это частицы, несущие отрицательный электрический заряд. Эти ионы образуются, когда атом или молекула получает электрон. Поэтому отрицательные ионы имеют больше электронов, чем протонов. Таковы основные различия между положительными и отрицательными ионами.
Ионы — это частицы, несущие электрический заряд. Существует две формы — положительные ионы и отрицательные ионы. Разница между положительным и отрицательным ионом заключается в том, что положительные ионы несут положительный электрический заряд, а отрицательные ионы несут отрицательный электрический заряд.
Энергия ионизации
Когда электрону придается достаточно энергии, он «высвобождается» из атома. Чем ближе электрон находится к ядру, тем труднее его оторвать, а значит, нужно передать больше энергии. Энергия, необходимая для отделения электрона, называется энергией ионизации или потенциалом ионизации (I). Значения I приведены в таблицах и могут быть найдены в различных справочниках.
| # | Статья | Имя | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Йод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празодимий | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Tulium | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Tantaglio | 761 |
| 74 | W | Volframio | 770 |
| 75 | Re | Ренио | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридиум | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Hermes | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Вести | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астате | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Francium | 380 |
| 88 | Ra | Радио | 509.3 |
| 89 | Ac | Актиниум | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Poseidonium | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Куриум | 581 |
| 97 | Bk | Беркли | 601 |
| 98 | Cf | Калифорния | 608 |
| 99 | Es | Эйнштейниум | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелиус | 642 |
| 103 | Lr | Лаврентий | 470 |
| 104 | Rf | Резерфордиум | 580 |
| Таблица 1: Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Кроме того, электроны могут присоединяться к атому, при присоединении электрон отдает энергию, эта энергия называется энергией сродства электрона, для каждого электрона данного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например.17Cl, чтобы отсоединить 17-й электрон от атома хлора, нужно придать ему 13 эВ, любому другому электрону, который может быть отсоединен от 17-го электрона, нужно придать 13 эВ.
Атомы, в которых число протонов не равно числу электронов, называются ионами, поскольку электрон имеет отрицательный заряд. Поэтому, если электронов больше, чем протонов, общий заряд отрицательный: S 2- означает, что для данного атома серы количество электронов на два электрона больше, чем количество протонов. Если электронов меньше, чем протонов, то общий заряд положительный и обозначается H+.
Какой заряд будет у атома?
Теоретически можно удалить все электроны из атома, но это возможно только в лабораторных условиях, а вне лаборатории атомы не будут находиться в таком состоянии.
Давайте вернемся к структуре электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням, причем каждый заполненный уровень защищает ядро и является более стабильным, чем неполностью заполненный уровень. То есть, электронная конфигурация стремится к полносубстратному состоянию: если в p-коре 5 электронов, атом с большей вероятностью примет один электрон, чем отдаст пять. Например, атом хлора, имеющий пять электронов в 3p-подуровне, имеет энергию сродства 3,61 эВ и энергию ионизации 13 эВ. Натрий имеет один электрон на последнем подуровне, энергия сродства составляет 0,78 эВ, а потенциал ионизации — 0,49 эВ, поэтому более вероятно, что натрий отдаст электрон, чем примет его.
Если мы знаем потенциал ионизации и энергию сродства, мы можем выдвинуть гипотезу о взаимодействии веществ. Если мы смешаем натрий и хлор и придадим им энергию, Na с большей вероятностью отдаст электрон Cl, и в результате получится смесь ионов Na+ и Cl-.
Пример
По номеру элемента мы можем предположить, какой заряд он будет иметь, например, элемент 19 имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1, такой элемент, скорее всего, пожертвует или примет электрон. Электронная конфигурация элемента 27 — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7, d-плоскость может иметь в общей сложности 10 атомов, то есть атом будет либо принимать 1, 2 или 3 электрона, либо отдавать 1, 2, 3 7 электронов, в этом случае он, скорее всего, примет 3 электрона, то есть возможные состояния — +1, +2 и +3,
Теперь, когда вы знаете, что такое ионы, вам остается только узнать о химической связи, и вы сможете проводить окислительно-восстановительные реакции!








