2. структура комплекса 3выступают в качестве соединительных элементов. Кобальт в комплексе с NH3образует внутреннюю сферу. Ионы хлора образуют внешнюю координационную сферу. Координационное число комплексообразователя (Co) равно 6.
Переходные элементы в химии
В органической химии существует всего несколько элементов, и каждый, кто осмеливается называть себя химиком, наверняка помнит, где находятся углерод, кислород, азот и галогены, не говоря уже о водороде. В химии количество переходных металлов гораздо больше, и не каждый может запомнить их все, и человек, даже посвятивший всю свою жизнь химии, может справедливо засомневаться, пытаясь вспомнить, где находится, например, иридий и является ли он вообще элементом или, возможно, красным или синим цветком.
Но здесь это совершенно необходимо — все это время мы будем считать электроны, оценивать положение элементов в группах и рядах, а не увязать в глупых вопросах о, например, катализе кросс-сочетаний фосфиновыми комплексами свинца. Свинец может иметь фосфиновые комплексы, но он не является переходным металлом и поэтому не особенно интересен для данного урока. Во второй букве символа есть все — переверните ее, и все встанет на свои места.
Итак, давайте посмотрим на периодическую таблицу элементов. Неизвестная с детства (раннего или позднего, в зависимости от удачи) удобная и компактная краткосрочная таблица, восходящая к Менделееву, но так называемая долгосрочная таблица больше подходит для наших целей. Краткосрочная историческая таблица была основана на классификации элементов в соответствии с единственным доступным в древности параметром — индивидуальным весом. В то время еще ничего не было известно об электронах, не говоря уже об атомных орбиталях, валентных оболочках и т.д. Поэтому в краткой форме элементы разных видов смешиваются в группы и делятся только на основные группы и подгруппы, которые не очевидны для недалекого ума. Однако самое неприятное в исторической форме то, что она втискивает 15 элементов в октет, что затрудняет понимание того, чем отличаются все эти восхитительные элементы и почему только эти, благородные газы и металлы и три самых незначительных металла получили такой отпор. Поэтому давайте отдадим должное величию исторической таблицы и перейдем к более современной форме, в которой валентные плоскости заполнены электронами, а различные части элементов четко разделены.
Краткое отступление, навеянное посещением амфитеатра Northern Chemical. Никогда не называйте периодическую таблицу таблицей Д.И. Менделеева. Это своего рода литературное недоразумение, которое сильно портит память о действительно великом ученом. Можно спорить о том, следует ли называть таблицу таблицей Менделеева или нет, и какая именно таблица должна так называться, и может ли длиннопериодическая форма так называться или нет (на мой взгляд, может, но это не важно), и следует ли упоминать в ней Лотара Мейера или нет — все это суета, которую следует оставить бессмысленным научным функционерам и окружающему их мусору. Все здравомыслящие люди знают и помнят, кому история химии обязана этим необыкновенным инструментом, и нет необходимости трепаться об этом. Ничто не исчезнет и ничто не будет забыто.
Вот она в уродливой, но максимально валидной форме, рекомендованной Международным союзом теоретической и прикладной химии (IUPAC) в Номенклатуре неорганических и координационных соединений 2005 г. Многим она интуитивно не нравится, потому что слишком длинная и плохо помещается на последних страницах тетрадей и учебников, не совсем помещается в поле зрения и вообще выглядит странно и не похожа на обычную таблицу. Вы должны читать его, покачивая головой слева направо и обратно, почти как болельщик на теннисном матче. Но структура абсолютно умная — элементы расположены строго по мере заполнения валентных оболочек, поэтому все элементы естественным образом образуют блоки из s, p, d и f элементов (последние приходится разбирать, но их положение на таблице понятно. Вместо восьми групп мы имеем 18, что является очень важным числом в подсчете электронов и соответствует spd-коре, полностью заполненной валентностями. Да, первые три периода, которые могут только мечтать об этих 18 электронах и обречены наблюдать более скромное число 2 и 8 электронов (правило октетов Льюиса), затронуты, но это лишь незначительная деталь.
D-Элементы
В длиннопериодической таблице элементы расположены строго в соответствии с порядком занятия валентных уровней, участвующих в образовании химических связей и, в целом, в любой химической деятельности. Напомню, что заполнение уровней атомов элементов происходит в соответствии с их относительной энергией снизу вверх (так называемый принцип наращивания, в разных формулировках называемый также принципом Маделунга-Клечковского); порядок заполнения определяется эмпирически (спектроскопически) и может быть удобно представлен простой диаграммой: Мы пишем все уровни в порядке их появления, а затем вычитаем уровни по диагонали. Мы сразу понимаем и принцип заполнения оболочки, и способ заполнения периодов на графике. Только в первых трех периодах уровни заполняются просто и кропотливо — номером оболочки (или значением главного квантового числа n ). На четвертом и пятом уровнях d выходит из предыдущей оболочки и стоит между следующими уровнями s и p. Это очень важно, поскольку во многом определяет положение интересующих нас элементов, переходных металлов, в таблице — они нагло расположились между s и p элементами, то есть между более металлическими металлами (щелочными и щелочноземельными) и неметаллическими, вместе с соседними металлоидами и горсткой неметаллических металлов. Валентные оболочки в этих двух периодах содержат s-, p- и d-плоскости, что означает, что они могут принять в общей сложности 18 электронов. Как мы сейчас увидим, это священное число химии переходных металлов. В шестом периоде приходит следующий сюрприз — «забытый» f-уровень с количеством на две единицы меньше и вплоть до d-уровня, а его медленное пополнение дает семейство f-элементов, лантаниды. Затем идут обычные d-элементы, но они сильно отличаются от своих родственников с более высоких уровней только наличием уже заполненного f-уровня. Можно было бы ожидать, что в этом порядке будет наблюдаться добавление 14 f-электронов к валентной оболочке, но этого не происходит — полная f-оболочка становится внутренней и не участвует в непосредственном образовании связей, валентная оболочка остается типа sdp и содержит 18 электронов, а на специфические свойства элементов добавление в виде полной f-оболочки влияет косвенно, в основном за счет эффекта сильно утяжеленного и очень большого дополнительного положительного заряда ядра. О следующем периоде мы ничего не скажем, там все радиоактивно и нестабильно, за исключением начала новой партии f-элементов, но мы договорились, что вообще не будем иметь дело с f-элементами. Пока не сбудется старое пророчество об «острове стабильности» среди трансурановых металлов, мы не можем ожидать, что семейство переходных металлов пополнится чем-то ощутимым. В 7-м периоде ничего не появилось, хотя он полностью завершен, и даже имена все названы. Давайте дождемся восьмого тура.
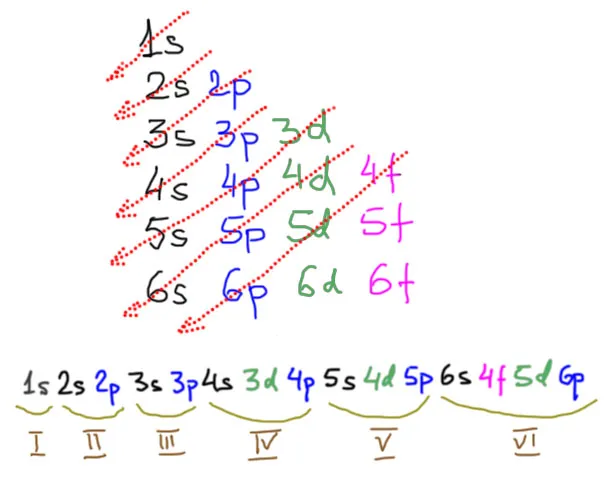
Давайте рассмотрим, какие уровни должны быть заполнены в периодической таблице. С левой стороны находятся две группы (1-я и 2-я) S-элементов — щелочи и щелочные металлы. С правой стороны находятся 6 групп (с 13-й по 18-ю) p-элементов, то есть все, что нужно для обычной органической химии. В середине находятся d-элементы, которые мы покрасили в зеленый цвет, но я не знаю, почему-то мне кажется, что этот цвет соответствует переходным металлам. На этом этапе мы должны быть осторожны и спросить себя (если у нас нет никого другого), являются ли d-элементы и переходные металлы одним и тем же. Почти, но не совсем. Чтобы понять, в чем тут фокус, нужно внимательнее присмотреться к уровням. С f-элементами тоже все понятно, оставим их в покое. Существует одна проблема: какой из элементов, занимающих клетку ниже иттрия, является переходным металлом, а его аналог иттрий и скандий — первым или вторым, лантаном или лютецием. У обоих одинаковая валентная оболочка 6s 2 5d 1, но у лантана вообще нет f-электронов (уровень пуст!), а у лютеция f-оболочка полностью заполнена, как у всех переходных металлов третьего порядка. К сожалению, простого ответа на этот очевидный вопрос не существует.
Электроны на d-уровне
Теперь давайте более подробно рассмотрим d-данные. Существует три полных серии таких элементов. В каждом из них поочередно заполняется соответствующий уровень d. Всего имеется пять d-орбиталей или десять d-электронов. Поэтому в каждой серии также имеется десять элементов, расположенных группами от 3 до 12. Количество групп от 3 до 7 соответствует исторической матрице Менделеева, только там используется термин «подгруппа», а в матрице длинного периода все группы равноправны (хотя термин main group elements, main (sub)group elements, очень часто используется для обозначения s и p элементов, и никакие позиции не сдаются). В занятии оболочек в атоме любого элемента, к сожалению, существуют довольно серьезные отклонения от простого порядка, в котором каждый последующий электрон просто занимает следующее вакантное место. Электроны вообще очень капризные дети, чьи квантовые привычки нелегко понять и запомнить. В первом порядке все еще довольно просто, нужно только понять, что если есть возможность заполнить d-плоскость полностью (две пары в каждой ячейке) или наполовину (одна непарная пара в каждой ячейке), все остальное отходит на второй план, и что конфигурацию атомов хрома или меди, заимствующих электроны из уже заполненной s-плоскости, запомнить несложно. Но на втором или третьем уровне даже эти простые идеи уже не работают так четко.
К счастью, в реальной химии мы редко имеем дело с отдельными атомами, а когда образуется кодинамическое соединение, комплекс, картина просто радикально упрощается. Предполагается, что d-орбитали, которые в основном участвуют в образовании связей с лигандами, стабилизированы в комплексах и попадают под s-орбитали.
И если это объяснение кажется немного надуманным и неубедительным, мы можем просто принять во внимание тот факт, что в металлических комплексах новые орбитали комплекса образуются в любом случае из валентных орбиталей металла и орбиталей связей, Металл все равно отдает то, что у него есть, а электроны должны быть перегруппированы снизу вверх, уже в орбиталях комплекса, которые не все сохранят чистый d-характер, как у исходного атома металла. Поэтому так называемая d-электронная конфигурация атома металла в комплексе на самом деле является совершенной формальностью, а раз так, то нет необходимости ее усложнять, и лучше использовать самый простой возможный вариант — взять все, что есть, и для простоты предположить, что оно находится на d-орбиталях металла.
Другими словами, для целей резонансной химии электроны размещаются в атомах металлов с уровнем окисления 0 (мы обсудим, что это значит в ближайшее время, а пока просто примем это за отправную точку) на d-орбиталях до полного заполнения уровня. Это очень удобно, потому что число d-электронов тогда соответствует номеру группы в длиннопериодной таблице. Например, сколько валентных электронов у ниобия? А иридий: группа 9, значит, девять.
Таким образом, до группы 10 (никель-палладий-платина) потребуется время, пока d-уровень не будет полностью заполнен и не наступит очередь s-уровня, который в изолированном атоме находился ниже d-уровня. Теперь он находится выше и принимает первый следующий электрон группы 11 (медь-серебро-золото), создавая конфигурацию с полностью заполненным d-уровнем, который, таким образом, сразу становится внутренним, и наполовину заполненным s-уровнем. Значит, металлы этой группы — не переходные металлы, а S-элементы, и правильно ли, что историческая таблица Менделеева поместила их в одну группу со щелочными металлами? Правильно, но не совсем, и на следующем слайде мы увидим, что утверждение о том, что металлы группы меди полностью принадлежат к семейству переходных металлов, хорошо подтверждается. В группе 12 ситуация на первый взгляд похожа, но на самом деле радикально отличается — есть второй электрон, который попадает в s-плоскость, а d-плоскость в итоге становится внутренней.
Общее понятие
Переходные металлы образуют соединения, в которых они имеют положительные степени окисления. Наибольшая разница в свойствах наблюдается в подгруппах IV-VIII, где меньше металлов и больше неметаллов. Символы самой таблицы обозначаются буквой d, а лантаноиды и актиниды — буквой f. Основными элементами этой категории являются Cr, Mn, Fe, Cu, Zn и Ag. История открытия показывает, что все эти металлы находятся в свободном состоянии. Число электронов во внешней оболочке равно числу периодов.

Одним из самых известных D-металлов на Земле является железо, которое стоит сразу после алюминия. Большинство из них представлены оксидами или сульфидами. Только медь находится в свободном состоянии. Соединения D-металлов также были найдены на Луне.
Из всех групп химических элементов переходные элементы наиболее трудно идентифицировать, поскольку существуют разногласия по поводу того, что именно к ним относится. Согласно одной из версий, вещества с неполностью заполненными d-электронными подоболочками считаются переходными металлами.
Место в периодической таблице
Переходные металлы расположены в группах от IB до VIIIB c:
- 21 (скандия) — по (29 медь).
- 39 (иттрия) — по 47 (серебро).
- 57 (лантана) — до 79 (золота).
- 89 (актиния) — до 112 (коперниция).
Последние представлены лантаноидами и актинидами, f-элементами особой группы. Остальное состоит из d элементов.
Химические свойства
Атомы в соединениях используют как σ-, так и π- и δ-валентные электроны. Исходя из этого, d-элементы имеют переменную валентность, чего нет в главных подгруппах. По этой причине они могут образовывать сложные соединения.
Все переходные металлы имеют твердую структуру и высокие температуры плавления и кипения.
Слева направо, 5 d орбиталей в таблице показывают высокую заполненность. Благодаря слабой электронной связи увеличивается электропроводность и гибкость.
Все это связано с низкой энергией ионизации, необходимой для удаления электрона из свободного атома. До сих пор ученые расходились во мнениях относительно классификации элементов, находящихся на границе между основной группой и переходными металлами, которые находятся в правой части таблицы. Это цинк (Zn), кадмий (Cd) и ртуть (Hg). Внешне они похожи на металлы:
- Податливы и пластичны.
- Проводят тепло и электричество.
- Образуют положительные ионы.
О сходстве физических свойств этих двух групп свидетельствует тот факт, что переходный металл медь и элемент основной группы алюминий являются лучшими проводниками электричества. Особенностью является то, что элементы основной группы легко образуют устойчивые соединения с нейтральными молекулами воды или аммиака.








