В остальном они химически и физически похожи на алканы, поскольку содержат только атомы углерода и водорода, являются нейтральными молекулами и поэтому взаимодействуют с силами Ван дер Валла.
Строение циклоалканов
Атомы углерода в молекулах циклоалканов находятся в sp 3-гибридном состоянии и образуют четыре связи C-C и C-H. В зависимости от размера цикла валентные углы меняются.
| В малых циклах (циклопропан и циклобутан) валентные углы между связями С-С значительно отличаются от валентных углов между связями С-С в алканах (109 o 35′). Поэтому в малых циклах существуют напряжения, которые приводят к высокой реакционной способности этих циклоалканов. |
Простейший циклоалкан, циклопропан, по сути, представляет собой плоский треугольник.
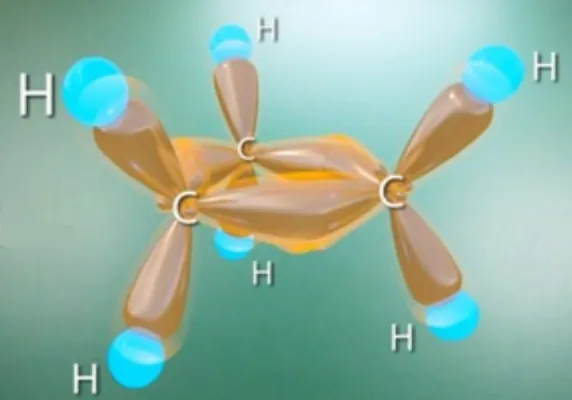
σ-связи в циклопропане называются «банановыми связями». Они не лежат вдоль оси, соединяющей атомные ядра, а отклоняются от нее, уменьшая напряжение в молекуле циклопропана.
Банановые облигации похожи на p-облигации. Они легко ломаются.
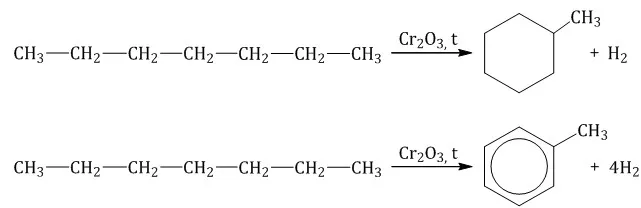
Поэтому циклопропан можно очень легко использовать в реакциях присоединения, разорвав углеродный цикл.
Другие циклоалканы имеют непланарную структуру. Молекула циклобутана имеет изгиб в соединительной линии между первым и третьим атомом углерода кольца:
Циклобутан также участвует в реакциях сложения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции сложения в циклобутане сложнее.
Большие циклы имеют более сложную, непланарную структуру, что означает, что молекулы больших циклоалканов практически не имеют углового напряжения.
Циклоалканы с большими циклами не участвуют в реакциях присоединения. Для них характерны реакции замещения.
Структура циклопентана также не является плоской, молекула имеет так называемую «оболочку».

Молекула циклогексана не является плоским многоугольником и принимает различные конфигурации, называемые «стул» и «ванна»:
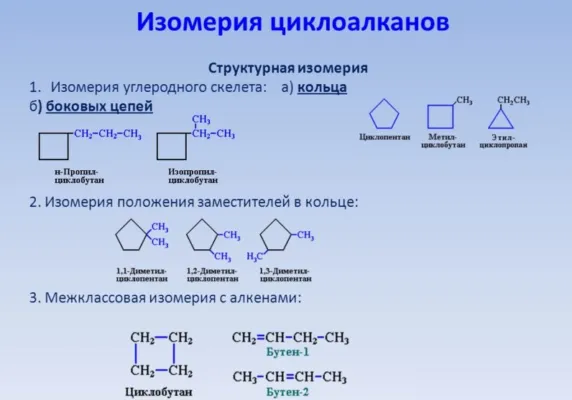
Изомерия циклоалканов
Циклоалканы характеризуются структурными изомерами, связанными различным числом атомов углерода в кольце, различным числом атомов углерода в заместителях и положением заместителей в кольце.
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
| 1-метил-2-пропилциклопентан | 1,2-диэтилциклопентан |
- Изомеры с разным положением одинаковых заместителей в углеродном цикле .
| Например. |
| 1,1-диметилциклогексан | 1,2-диметилциклогексан |
- Межклассовая изомерия : циклоалканы изомерны алкенам.
Геометрическая (цис-транс-) изомерия
Циклоалканы с двумя заместителями возле соседних атомов углерода в цикле проявляют цис-транс-изомерию из-за различного пространственного расположения заместителей относительно плоскости цикла.
| В цис-изомерах заместители находятся по одну сторону от плоскости цикла; в транс-изомерах заместители находятся на противоположных сторонах. |
Цис-транс-изомер не характерен для 1,1-диметилциклопропана.
Chemistry48.Ru
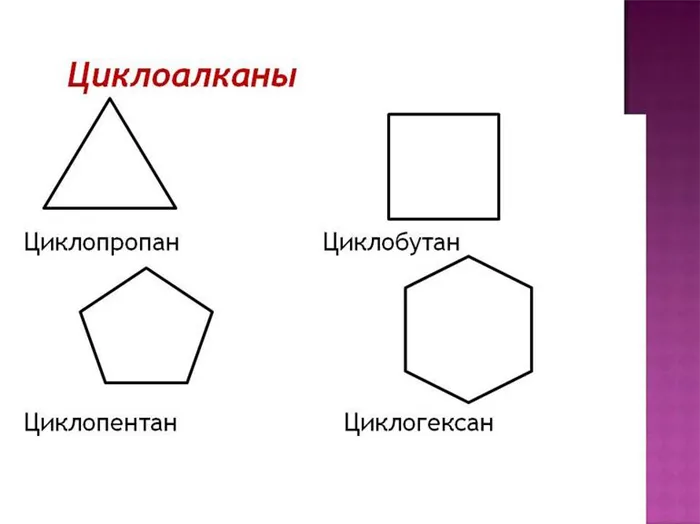
Циклоалканы — это насыщенные циклические углеводороды. Самые простые представители этой серии:
Общая формула для гомологического ряда циклоалканов CnH2n. Точно такая же формула описывает ряд гомологов алкенов. Из этого следует, что для каждого циклоалкана соответствующий алкен является изомером. Это пример так называемой «упорядоченной» изомерии.
Структура Каждый атом углерода в циклоалканах находится в состоянии sp 3-гибридизации и образует четыре s-связи C-C и C-H. Углы между связями зависят от размера цикла. В простейших циклах, C3и C4Углы связей С-С сильно отклоняются от гетероэдрического угла 109,5°, что приводит к напряжению в молекулах и обеспечивает их высокую реакционную способность. Свободное вращение вокруг связей С-С, образующих круг, невозможно.
Изомеры и номенклатура. 1) Циклоалканы, как и все классы органических соединений, характеризуются изомерией углеродного скелета (структурной изомерией). Структурная изомерия циклоалканов в первую очередь определяется размером цикла. Например, существуют два циклоалкана типа C4Н8циклобутан и метилциклопропан. Во-вторых, эта изомерия основана на положении заместителей в кольце (например, 1,1- и 1,2-диметилбутан).
2) Отсутствие свободного вращения вокруг связи С-С кольца создает условия для существования пространственных изомеров в некоторых замещенных циклоалканах. В молекуле 1,2-диметилциклопропана, например, два CH3группы могут находиться на одной стороне плоскости цикла (цис-изомер) или на противоположных сторонах (транс-изомер):
Циклоалканы подразделяются на несколько групп в зависимости от размера цикла, из которых мы имеем малые (C3, С4) и обычный (C5-С7) циклов.
Названия циклоалканов образуются путем добавления префикса цикло- к названию алкана с соответствующим числом атомов углерода. Нумерация в цикле такова, что заместители получают наименьшие номера.
Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму круга и опуская символы для атомов углерода и водорода.
Получение. Свойства
Физические свойства. В нормальных условиях первые два члена серии (C3— С4) являются газами, (C5— С16) являются жидкостями, начиная с
C17— твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
1. Наиболее важным методом получения циклоалканов является отщепление двух атомов галогена от дигалогенированных алканов:
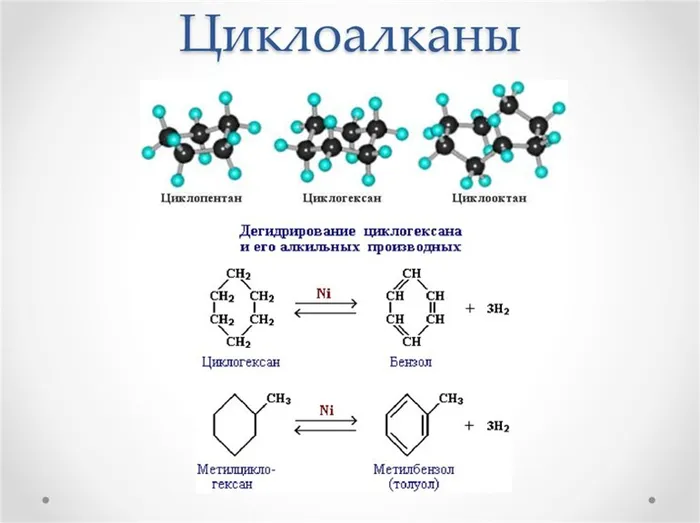
2. каталитическое гидрирование ароматических углеводородов дает циклогексан или его производные:
Химические свойства. По своим химическим свойствам малые циклы и нормальные циклы значительно отличаются друг от друга. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. в этом отношении они похожи на алкены. Циклопентан и циклогексан по своему химическому поведению близки к алканам, поскольку участвуют в реакциях замещения.
(1) Циклопропан и циклобутан, например, могут связывать бром, хотя реакция протекает сложнее, чем для пропена или бутена:
(2) циклопропан, циклопропан, циклобутан и даже циклопентан могут связывать водород с соответствующими нормальными алканами. Добавление происходит при нагревании в присутствии никелевого катализатора:
3. опять же, только небольшие циклы реагируют с галогеноводородами. Присоединение к гомологичным циклопропанам происходит по правилу Марковникова:
4. реакции замещения. Нормальные циклы (C6и выше) стабильны и возникают только в реакциях радикального замещения, например, в алканах:
5. дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:
6. действие сильных окислителей (например, 50% азотной кислоты) на циклогексан в присутствии катализатора приводит к образованию адипиновой кислоты (гексановой кислоты):
Особенности строения циклоалканов и их химическое поведение. Выше мы показали нестабильность малых циклоалканов и их способность разлагаться и вступать в реакции присоединения. Причины этого кроются в структуре циклов. Циклопропан, например, имеет планарную структуру, так что атомы водорода соседних атомов углерода выше и ниже круговой плоскости находятся в энергетически неблагоприятном («скрытом») положении. Это одна из причин «напряженности» цикла и его нестабильности.
Если предположить, что тримерный круг представляет собой плоский равносторонний треугольник, то валентные углы между атомами углерода должны составлять 60°, т.е. значительно отличаться от значения нормального валентного угла 109,5° для классического случая гибридизации sp’.
Было обнаружено, что образование s-связей между атомами углерода за счет перекрывания sp 3-гибридизационных орбиталей происходит не на прямой линии, соединяющей атомные ядра, а вне этой линии.
Это перекрытие не является аксиальным, как это характерно для образования s-связей, а несколько ближе к латеральному перекрытию, характерному для образования p-связей. Образующаяся s-связь с расположением максимума электронной плотности вне прямой линии между ядрами связанных атомов называется «бананом». Его свойства аналогичны свойствам p-облигаций. Циклопропан действительно способен участвовать в реакциях сложения (с прерыванием цикла).
Нормальные циклы, с другой стороны, очень стабильны и не склонны к поломкам. Молекула циклогексана, например, не является плоским многоугольником и принимает различные формы.
Среди непланарных конфигураций наиболее энергетически благоприятной является конфигурация «рука», поскольку в этой конфигурации все валентные углы между атомами углерода составляют 109,5°, а атомы водорода в соседних атомах углерода находятся в заторможенном положении по отношению друг к другу.
Общее описание
Циклопарафины имеют схожую структуру с алканами. Вещества находятся в состоянии sp 3-гибридизации. Все атомы углерода заняты атомами водорода.
Простейшим веществом является циклопропан, три атома углерода которого образуют треугольный круг. По мере увеличения числа атомов углерода форма круга меняется и становится более сложной. Например, молекула с пятью атомами углерода имеет форму пятиугольника, а молекула с десятью атомами — форму двойного пятиугольника. Молекула вещества по умолчанию рисуется в виде фигуры с группами CH по углам.2.
Согласно номенклатуре ИЮПАК, названия цикланов состоят из префикса «цикло-» и названия алкана. Циклопропан представляет собой гомологический ряд циклоалканов:
Циклоалканы отличаются от алканов двумя атомами водорода. Пентан, например, представляет собой C5H12и циклопентан — C5H10.
Нафтены получают из полезных ископаемых, таких как нефть и газ. Их также получают путем гидрирования ароматических углеводородов (аренов) и дегидрирования алканов:
Циклоалканы образуют три типа изомеров: пространство, углерод (добавление дополнительного CH2) и между алкенами.
Свойства
Циклоалканы физически и химически похожи на алканы. В нормальных условиях первые три связи являются газами. Соединения, содержащие от пяти до 11 атомов углерода, являются жидкостями. Высшие нафтены с 12 и более атомами углерода являются твердыми веществами.
Температуры плавления и кипения увеличиваются с ростом молекулярного веса. Однако нафтены плавятся и кипят при более высоких температурах, чем их алканы.
Низшие цикланы, циклопропан и циклобутан, похожи на алкены и могут участвовать в реакциях присоединения. Циклоалканы выше циклопентана похожи на алканы и участвуют в реакциях замещения. Основные химические свойства циклопарафинов описаны в таблице ниже.
Реакция
Описание
Уравнения реакций
Циклопропан и циклобутан связывают галогены. Начиная с циклопентана, нафтены реагируют с галогенами
Циклопропан и циклобутан связывают водород при нагревании в присутствии никеля
Циклопропан и циклобутан связывают галогенированные углеводороды
Дегидрирование нафтенов из циклопентана и выше в присутствии катализатора
Окисление в присутствии катализатора
Нафтены используются для синтеза спиртов, кетонов, кислот, полимеров и в качестве растворителей.








