- 40% марганцевых руд планеты сосредоточено в Грузии (Чиатурское месторождение).
- В России крупных залежей единицы: в Кемеровской, Еврейской автономной, Свердловской областях, Красноярском крае, на Новой Земле.
Марганец: сплавы, свойства, распространение

Марганец — это химический элемент с атомным весом 54,9380 и атомным номером 25. Он имеет серебристо-белый цвет, большую массу и встречается в природе в виде стабильного изотопа 35 Mn. Первое упоминание о металле относится к древнеримскому ученому Плинию, который назвал его «черным камнем». В то время марганец использовался в качестве осветлителя для стекла, а пиролюзит марганца MnO добавлялся в расплав в процессе варки.2.
Когда-то давно марганцевый пиролюзит использовался в качестве добавки при производстве железа в Грузии, его называли черной магнезией и считали одним из вариантов магнетита (магнитного железняка). Только в 1774 году шведский ученый Шееле доказал, что это соединение неизвестного науке металла, а несколько лет спустя Й. Хан получил первый марганец, загрязненный атомами углерода, нагрев смесь углерода и пиролюзита.

Воздуховоды хим стойкие
Имеются цилиндрические и прямоугольные проводники. Специалисты и менеджеры по продукции Plast помогут вам выбрать и установить цену на интересующую вас продукцию. Воздуховоды используются в промышленных и бытовых установках, они устойчивы к химическим веществам и коррозии.
Вентиляторы промышленные коррозионностойкие и химстойкие
Химически стойкие промышленные воздуховоды Plast-Product предназначены для гальванических заводов и производственных площадок с агрессивными парами. Они изготавливаются из химически стойких пластмасс, таких как полипропилен, ПНД, ПВХ и ПВДФ, причем материал и свойства выбираются в соответствии с требованиями заказчика.
Фильтры волокнистые гальванические (ФВГ, ФКГ)
Гальванические волокнистые фильтры предназначены для высокоэффективной очистки вентиляционных выбросов от жидких и водорастворимых твердых частиц и аэрозольных паров в гальванической, травильной и химической промышленности, из вытяжных шкафов, лабораторных помещений и камер мойки для обработки поверхностей. Его можно использовать в пищевой промышленности.
Скруббер
Компания «Пласт-Продукт» производит абсорбционные скрубберы и центробежное абсорбционное оборудование, используемое для очистки воздуха от пылегазовоздушных смесей и токсичных испарений.
Если вас интересует стоимость производства какого-либо продукта, пришлите нам техническую спецификацию на адрес info@plast-product.ru или позвоните по телефону 8 800 555-17-56.
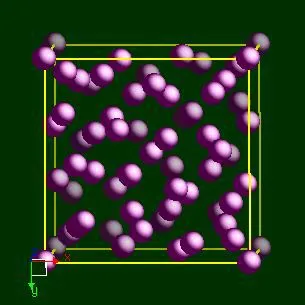
Марганец имеет 4 полиморфные модификации: a-Mn (кубическая оноцентрическая решетка с 58 атомами в элементарной ячейке), b-Mn (кубическая оноцентрическая с 20 атомами в элементарной ячейке), c-Mn (квадратная с 4 атомами в элементарной ячейке) и d-Mn (кубическая оноцентрическая). Температуры превращения: a=b 705 °C; b=c 1090 °C и c=d 1133 °C; модификация a является хрупкой; c (и частично b) — вязкой, что важно для производства сплава.

Серебристо-белый цвет с легким серым налетом свидетельствует о наличии марганца. Он превосходит железо по твердости и хрупкости. Он является парамагнитным. Марганец окисляется при контакте с воздухом. Он покрыт оксидным слоем, который защищает его от дальнейших реакций окисления.
Он растворим в воде и полностью поглощает водород, не вступая с ним в реакцию. При нагревании он сгорает вместе с кислородом. Активно реагирует с хлором и серой. Реагирует с кислотными окислителями и образует соли марганца. Плотность — 7200 кг/м3, температура плавления — 1247°C, температура кипения — 2150°C. Теплоемкость составляет 0,478 кДж. Он является электропроводящим. При контакте с хлором, бромом и йодом образует дихалогониды.
При высоких температурах он вступает в реакцию с азотом, фосфором, кремнием и бором. Он медленно реагирует с холодной водой. При нагревании реактивность элемента увеличивается. Результаты по Mn(OH)2и водорода.
| Штрунц (8-е издание) | 1/A.07-05 |
| Никель Штрунц (10-е издание) | 1.AE.30 |
| Дана (7-е издание) | 1.1.39.1 |
| Минеральный цвет | Серая сталь |
| Характерный цвет | тёмно-серый |
| Прозрачность | непрозрачный |
| Блеск | металлик |
| Разбивка | нет |
| Твердость (по шкале Мооса) | 6.5 |
| Плотность (измеренная) | 7,01 г/см 3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | парамагнитный |
| Тип | изотропный |
| Плеохроизм | неплеохроичный |
| Люминесценция в ультрафиолетовом излучении | нефлуоресцентный |
Химические свойства
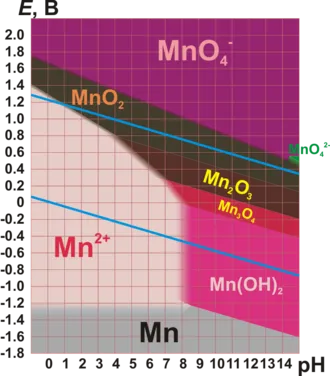
Стандартные окислительно-восстановительные потенциалы по отношению к водородному электроду| Окисленная форма | Сокращенная форма | Средний | E 0, B |
|---|---|---|---|
| Mn 2+ | Mn | H + | -1,186 |
| Mn 3+ | Mn 2+ | H + | +1,51 |
| MnO2 | Mn 3+ | H + | +0,95 |
| MnO2 | Mn 2+ | H + | +1,23 |
| MnO2 | Mn(OH)2 | OH | -0,05 |
| MnO42- | MnO2 | H + | +2,26 |
| MnO42- | MnO2 | OH | +0,62 |
| MnO4− | MnO42- | OH | +0,56 |
| MnO4− | H2MnO4 | H + | +1,22 |
| MnO4− | MnO2 | H + | +1,69 |
| MnO4− | MnO2 | OH | +0,60 |
| MnO4− | Mn 2+ | H + | +1,51 |

Типичные состояния окисления марганца: +2, +3, +4, +6, +7 (+1, +5 имеют второстепенное значение).
При окислении на воздухе он становится пассивированным. Марганец в виде порошка сгорает в кислороде (Mn + O2→ MnO2Марганец разлагается в воде, вытесняя водород при нагревании (Mn + 2H2O → (t) Mn(OH)2+ H2↑), образующийся гидроксид марганца замедляет реакцию.
Марганец поглощает водород, и его растворимость в марганце увеличивается с повышением температуры. При температуре выше 1200 °C он реагирует с азотом, образуя различные нитридные композиции.
Углерод реагирует с расплавленным марганцем и образует Mn-карбиды3карбиды C и другие. Он также образует силициды, бориды и фосфиды.
Он реагирует с соляной и серной кислотой в соответствии с уравнением:
» width=»» height=»» />
С концентрированной серной кислотой он реагирует согласно уравнению:
С разбавленной азотной кислотой он реагирует по уравнению:
В щелочном растворе марганец стабилен.
Марганец образует следующие оксиды: MnO, MnO, Mn2O3, MnO2, MnO3(который не может быть выделен в свободном состоянии) и гидрид марганца Mn2O7.
Mn2O7представляет собой маслянистую жидкость темно-зеленого цвета при нормальных условиях, которая очень нестабильна; в сочетании с концентрированной серной кислотой она может воспламенить органические материалы. При 90 °C Mn2O7он разлагается взрывом. Наиболее стабильные оксиды Mn2O3и MnO2и комбинированный оксид Mn3O4(2MnO-MnO2или соль Mn2MnO4).
Когда оксид марганца(IV) (пиролюзит) сплавляется со щелочами в присутствии кислорода, образуются соли марганца:
Раствор марганцовой кислоты имеет темно-зеленый цвет. При подкислении происходит реакция:
Раствор становится малиновым, потому что анион MnO4— и выпадает коричневый осадок гидроксида марганца (IV).
Применение в промышленности
Марганец в форме ферромарганца используется для «раскисления» стали во время плавки, т.е. для удаления из нее кислорода. Он также связывает серу, что также улучшает свойства сталей. Введение до 12-13% Mn в сталь (известную как сталь Хадфилда), иногда в сочетании с другими легирующими металлами, значительно упрочняет сталь, делая ее твердой и устойчивой к износу и ударам (эта сталь сильно упрочняется и становится тверже при ударе). Эта сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, арматурных элементов и т.д. В шпигелейзен добавляется до 20 % Mn.
Сплав из 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электрическим сопротивлением, которое почти не изменяется при колебаниях температуры. По этой причине он используется для производства трансформаторов тока и т.д.
Марганец добавляют в бронзу и латунь.
Значительные количества диоксида марганца используются в производстве марганцево-цинковых электролитических элементов, MnO2используется в этих элементах в качестве окислительного деполяризующего агента.
Соединения марганца также часто используются в органическом тонком синтезе (MnO2и KMnO4в качестве окислителей), а также в промышленном органическом синтезе (компоненты катализаторов для окисления углеводородов, например, в производстве терефталевой кислоты путем окисления п-ксилола, окисления парафинов до высших жирных кислот).
Цены на металлические слитки марганца чистотой 95% в 2006 году составляли в среднем 2,5 доллара США/кг.
Арсенид марганца обладает большим магнитокардиогенным эффектом, который увеличивается под давлением. Теллурид марганца является перспективным термоэлектрическим материалом (термо-э.д.с. 500 мкВ/К).
Определение методами химического анализа
Марганец относится к пятой группе аналитических катионов.
Конкретные реакции, используемые в аналитической химии для обнаружения катионов Mn 2+, следующие:
1. раствор щелочи, содержащий соли марганца(II), дает белый осадок гидроксида марганца(II):
» width=»» height=»» />
Осадок становится коричневым на воздухе из-за окисления атмосферным кислородом.
Проведение реакции. Добавьте две капли раствора щелочи к двум каплям раствора соли марганцовки. Наблюдайте за изменением цвета осадка. 2.
Перекись водорода окисляет соли марганца (II) в присутствии щелочи до темно-коричневого соединения марганца (IV):
» width=»» height=»» />
Проведите реакцию. К двум каплям раствора соли марганца добавьте четыре капли щелочи и две капли H2O2.
3. диоксид свинца PbO2в присутствии концентрированной азотной кислоты окисляет Mn 2+ до MnO4— образуется марганцевая кислота фиолетового цвета:
+ 2H_2O>» width=»» height=»» />
В присутствии восстановителей, таких как соляная кислота и ее соли, эта реакция приводит к отрицательному результату, поскольку они реагируют как с диоксидом свинца, так и с образовавшейся марганцевой кислотой. Если присутствует большое количество марганца, то эта реакция будет неудачной, так как избыток ионов Mn 2+ преобразует полученную марганцевую кислоту HMnO4к MnO(OH)2и вместо малинового цвета появляется коричневый осадок. Вместо диоксида свинца для окисления Mn 2+ до MnO4— можно использовать другие окислители, например, персульфат аммония (NH4)2S2O8в присутствии катализатора — ионов Ag+ или висмутата натрия NaBiO3:
Проведение реакции. В пробирку поместите небольшое количество PbO2затем 5 капель концентрированной азотной кислоты HNO3и затем смесь нагревают на кипящей водяной бане. Добавьте в предварительно нагретую смесь 1 каплю сульфата марганца(II) MnSO4и нагревайте в течение 10-15 минут, время от времени встряхивая пробирку. Дайте избытку диоксида свинца осесть и наблюдайте фиолетовый цвет полученной марганцовой кислоты.
При окислении с помощью висмутата натрия реакция протекает следующим образом. В пробирку добавьте 1-2 капли раствора сульфата марганца(II) и 4 капли 6н HNO3добавляют несколько капель висмутата натрия и встряхивают пробирку. Наблюдается фиолетовый цвет раствора.
4. сульфид аммония (NH4)2S осаждается из раствора соли марганца — сульфата марганца (II), который представляет собой окрашенное твердое вещество:
\rightarrow MnS\downarrow>» width=»» height=»» />
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Проведение реакции. Поместите 2 капли раствора соли марганца (II) в пробирку и добавьте 2 капли раствора сульфата аммония.
Месторождения, добыча и цены

- 40% марганцевых руд планеты сосредоточено в Грузии (Чиатурское месторождение).
- В России крупных залежей единицы: в Кемеровской, Еврейской автономной, Свердловской областях, Красноярском крае, на Новой Земле.
Добыча сырья традиционна: карьер или шахта.
Цены доступны на мировых биржах: одна тонна Mn95 стоит 2100 долларов США.
Благодаря своим химическим свойствам марганец можно причислить к переходным металлам, поскольку он обладает как восстановительными, так и окислительными свойствами:
- При нагревании образует соединения с простыми веществами, кислотами, основаниями.
- Образует сплавы почти со всеми металлами.

Однако, помимо этих преимуществ, марганец имеет и недостатки:
- Хрупкость, обусловленная структурой вещества. Она позволяет отличить марганец от других металлов.
- Высокая температура кипения.
- Низкая электропроводность.
Эти свойства делают металл сложным для обработки и использования.
| Свойства атома | |
|---|---|
| Имя, символ, номер | Марганец (Mn), 25 |
| Атомный вес (молекулярная масса) | 54,938045 (5) указ. соч. (г/моль) |
| Электронная конфигурация | Ar 3d5 4s2 |
| Атомный радиус | 127 мкм |
| Химические свойства | |
| Ковалентный радиус | 117 мк.м. |
| Ионный радиус | (+7e) 46 (+2e) 80 мк.м. |
| Электромагнетизм | 1,55 (шкала Полинга) |
| Электродный потенциал | -1,180 В |
| Степень окисления | 7, 6, 5, 4, 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 716,8 (7,43) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (в н.у.м.) | 7,21 г/см³ |
| Температура плавления | 1 517 K |
| Температура кипения | 2 235 K |
| Удельная теплота плавления | 13,4 кДж/моль |
| Удельная теплота парообразования | 221 кДж/моль |
| Молекулярная теплоемкость | 26,3 Дж/(К-моль) |
| Молекулярный объем | 7,35 см³/моль |
| Кристаллическая решетка одного вещества | |
| Решетчатая структура | кубический |
| Параметр решетки | 8,890 Å |
| Температура Дебая | 400 K |
| Другие характеристики | |
| Теплопроводность | (300 К) 6,87 Вт/(м-К) |
| номер CAS | 7439-96-5 |
Где используется
Хрупкость исключает использование чистого марганца. Сплавы и соединения марганца пользуются спросом.

Металлургия
Основным потребителем сырья (90 %) является металлургическая промышленность.
Здесь металл используется в качестве легирующего компонента сталей:
- 1% элемента превращает сталь в нержавеющую, делает алюминиевые сплавы коррозиестойкими.
- 12,8%-13,1% Mn в разы повышают прочность, твердость стали. Она становится неуязвимой к ударам, износу.
- Сплав из 13% Mn (плюс медь и никель) наделен высоким электрическим сопротивлением, «равнодушным» к колебаниям температуры.
- 20% необходимы, чтобы чугун стал «зеркальным».
Сплавы этого элемента с железом, углеродом и кремнием пользуются спросом.
Они используются для производства продукции для различных отраслей промышленности — от танков, землеройной техники и дробильных машин до оборудования для пищевой промышленности.
Для производства одной тонны стали требуется 7,5 кг марганца.
Другие отрасли
Соединения марганца востребованы в различных сегментах рынка:
- Электротехника (реостаты).
- Химическая отрасль (промышленный и тонкий органический синтез).
- Выработка текстиля, стекла.
- Производство минеральных удобрений.
- Тара для хранения пищевых продуктов.
Сплавы металлов с медью — материал для деталей судов, контактирующих с соленой водой (океан или море).
Переработка марганцевых руд
Производство основано на потребностях различных отраслей промышленности.
Методы производства металла:
- восстановлением пиролюзита кремнием, углеродом (редко — алюминием);
- электролизом раствора MnSO4; получаемый продукт осаждается на катоде;
- чистый металлический марганец получают электролитическим способом;
- в промышленных масштабах марганец часто получают в реакции восстановления углем из смеси марганцевых и железных руд.
Сплавы
Добавление марганца в стальные сплавы обеспечивает прочность, твердость и пластичность.

Ценный сплав, называемый сталью Хадфилда, обладает превосходными свойствами:
Марганец-медь обладает высокой прочностью на разрыв.
Формула успеха металла в разнообразных свойствах сплавов и соединений манганума.
Плюсы и минусы
Марганцевые сплавы обладают высокой прочностью на разрыв.
| Преимущества | Недостатки |
| Химическая активность металла позволяет получать разнообразные соединения с различными свойствами | Высокая твердость в сочетании с хрупкостью ограничивает применение металла |
| Марганец образует сплавы почти со всеми металлами | Его низкая электропроводность не позволяет использовать его в электротехнике. |
| Его сплавы с углеродом и кремнием незаменимы в сталелитейной промышленности. | Высокая температура кипения делает металл трудным для обработки |
| Соединения железа и марганца образуют твердые растворы в любом соотношении | Недостатки металла — следствие особенностей его структуры |
Важность металла как соединительного элемента невозможно переоценить.
Физические свойства
Марганец — это серый, твердый, блестящий, хрупкий металл. Он настолько хрупок, что не поддается механической обработке в чистом виде. Под механической обработкой понимается гибка и резка. Температура его плавления составляет 1245 °C (2273 °F), а температура кипения — около 2100 °C (3800 °F). Его плотность составляет 7,47 грамма на кубический сантиметр.
Этот металл можно сделать ферромагнитным, но только после специальной обработки. Он существует в четырех аллотропных формах. Аллотропы — это формы элемента с различными физическими и химическими свойствами. При повышении температуры элемент переходит из одной формы в другую. Наиболее распространена форма, которая существует от комнатной температуры до примерно 700 °C (1300 °F).
Химические особенности
Этот химический элемент имеет символ Mn, атомный номер 25 и молярную массу 54,938. Химические свойства марганца определяются его умеренной активностью. При нагревании он медленно соединяется с атмосферным кислородом, образуя диоксид (MnO2); при более высоких температурах он реагирует с неметаллами и может даже гореть, излучая яркий белый свет. Он медленно реагирует с холодной водой, образуя гидроксид, но быстрее с горячей водой или паром, образуя студенистый, бледно-розовый осадок.

Марганец растворяется в большинстве кислот с выделением газообразного водорода и соединяется с фтором и хлоридом с образованием дифторида (MnF 2) и дихлорида (MnCl 2).
Он реагирует при высоких температурах с галогеном, серой, азотом, углеродом, кремнием, фосфором и бором. Степень окисления марганца варьируется от +2 (валентность марганца II) до +7 (валентность VII). Наиболее распространенными состояниями окисления являются 2+, 4+ и 7+.
Все соединения, кроме тех, которые содержат MnII, сильно окрашены. Например, перманганат калия, KmnO4, при разложении дает фиолетовый водный раствор; манганат калия, K2MnO4, дает темно-зеленый раствор.
Биологическая роль
Марганец — это очень распространенное соединение, которое встречается повсюду на земле. Он содержится во всех растительных и животных организмах и является одним из трех наиболее важных токсичных микроэлементов, что означает, что он не только необходим для выживания организмов, но и вреден, если присутствует в высоких концентрациях.
Это необходимый элемент для всех форм жизни, так как он необходим для деятельности многочисленных ферментов, в том числе супероксиддисмутазы, которая защищает от вредного воздействия токсичных кислородных радикалов.

Одна из самых важных реакций в биологии, фотосинтез, полностью зависит от марганца. Он является ключевым участником реакционного центра фотосинтеза II, где молекулы воды превращаются в кислород. Без него не было бы фотосинтеза и кислорода в атмосфере.
Человек получает его в основном через продукты питания, такие как шпинат, чай и травы. Продукты с наибольшей концентрацией этого вещества — злаки, рис, соя, яйца, орехи, оливковое масло, зеленые бобы и устрицы.
После приема внутрь металл транспортируется по кровотоку в печень, почки, поджелудочную и эндокринные железы. Его воздействие в основном сосредоточено в дыхательных путях и головном мозге. Симптомы отравления включают галлюцинации, забывчивость и повреждение нервов. Он также может вызвать паркинсонизм, легочную эмболию и бронхит.
Когда люди подвергаются его воздействию в течение длительного периода времени, ущерб может быть значительным и включать следующие симптомы: Шизофрения, депрессия, мышечная слабость, головные боли и бессонница. Однако, поскольку марганец является важным элементом для функционирования человеческого организма, его отсутствие также может негативно сказаться на здоровье:
- непереносимость глюкозы;
- проблемы с кожей;
- низкий уровень холестерина;
- врождённые дефекты;
- изменения в цвете волос;
- неврологические симптомы.
Свойства и характеристики
Физические свойства металла сильно зависят от температуры. Поскольку изменений четыре, это неудивительно.
Наиболее важные характеристики вещества следующие:
- плотность – при нормальной температуре составляет 7,45 г/куб. см. Именно эта величина слабо зависит от температуры: так, при нагревании до 600 С плотность уменьшается только на 7%;
- температура плавления – 1244 С;
- температура кипения – 2095 С;
- теплопроводность при 25 С составляет 66,57 Вт/(м·К), что для металла является низким показателем;
- удельная теплоемкость – 0,478 кДж/(кг·К);
- коэффициент линейного расширения, измеренный при 20 С, равен 22,3·10 -6 град -1 — ; Теплоемкость и теплопроводность вещества увеличиваются линейно при увеличении температуры;
- удельное электрическое сопротивление – 1,5– 2,6 мком·м, лишь немногим выше, чем у свинца.
Марганец парамагнитен, т.е. он намагничивается во внешнем магнитном поле и притягивается к магниту. Металл переходит в антиферромагнитное состояние при низких температурах, при этом температура перехода различна для каждой модификации.
Структура и состав марганца описаны ниже.
О марганце и его соединениях рассказывается в следующем видеосюжете:
Структура и состав
Описаны четыре структурные модификации вещества, каждая из которых стабильна в определенном диапазоне температур. Путем легирования определенными металлами можно стабилизировать каждую фазу.
- До 707 С устойчивой является а-модификация. – кубическая объемно-центрированная решетка, в состав элементарной ячейки которой входит 58 атомов. Такая структура очень сложна и обуславливает высокую хрупкость вещества. Его показатели – теплоемкость, теплопроводность, плотность, приводятся как свойства вещества.
- При 700–1079 С устойчивой является b-фаза с таким же типом решетки, но с более простым строением: ячейку составляет 20 атомов. В этой фазе марганец проявляет определенную пластичность. Плотность b-модификации – 7,26 г/куб. см. Фазу легко зафиксировать – закалкой вещества при температуре выше температуры фазового перехода.
- При температурах от 1079 С до 1143 С g-фаза стабильна. Для нее характерна кубическая гранецентрированная решетка с ячейкой из 4 атомов. Модификация отличается пластичностью. Однако зафиксировать фазу полностью при охлаждении не удается. При температуре перехода плотность металла составляет 6,37 г/куб. см, при нормальной – 7, 21 г/куб. см.
- Выше температуры 1143 С и до кипения стабилизируется d-фаза с объемно-центрированной кубической решеткой, ячейка которой включает 2 атома. Плотность модификации составляет 6,28 г/куб. см. Интересно то, что d-Mn может перейти в антиферромагнитное состояние при высокой температуре – 303 С.
Фазовые переходы имеют большое значение при производстве разнообразных сплавов, особенно потому, что физические свойства структурных модификаций различны.
Производство марганца описано ниже.
Производство

Марганец обычно является спутником железа в его рудах, но есть и самостоятельные месторождения. Например, месторождение Чиатура содержит до 40 % мировых запасов марганцевой руды.
Этот элемент встречается почти во всех горных породах и легко выщелачивается. Его содержание в морской воде невелико, но на морском дне он образует конкреции вместе с железом, содержащие до 45 % элемента. Эти месторождения считаются перспективными для дальнейшей эксплуатации.
На территории России есть несколько крупных месторождений марганца.
Наиболее известными минералами являются пиролюзит, магнетит, кастанит, марганцевый полевой шпат и др. Содержание этого элемента в них колеблется от 62 до 69 %. Их добывают или извлекают. Обычно руда обогащается перед добычей.
Производство марганца напрямую связано с его использованием. Основным потребителем является сталелитейная промышленность, и для его использования требуется не сам металл, а его соединение с железом — ферромарганец. Поэтому, когда мы говорим о добыче марганца, мы часто имеем в виду соединение, необходимое в черной металлургии.
В прошлом ферромарганец производился в доменных печах. Однако из-за нехватки кокса и необходимости использовать марганцевые руды низкого качества производители перешли на выплавку в электрических печах.
Для выплавки используются открытые и закрытые печи с углеродной футеровкой, в которых производится углеродистый ферромарганец. Плавление производится при напряжении 110-160 В двумя методами: с флюсом или без флюса. Второй метод более экономичен, так как позволяет более полно извлечь элемент, но если содержание кремнезема в руде высокое, то возможен только бесфлюсовый метод.
- Бесфлюсовый метод – непрерывный процесс. Шихта из марганцевой руды, кокса и железной стружки загружается по мере переплавления. Важно следить за достаточным количеством восстановителя. Ферромарганец и шлак выпускаются одновременно 5–6 раз за смену.
- Силикомарганец производят сходным методом в электроплавильной печи. Шихта, кроме руды включает марганцевый шлак – без фосфора, кварцит и коксик.
- Металлический марганец получают аналогично выплавке ферромарганца. Сырьем служат отходы от разливки и разделки сплава. После расплавления сплава и шихты добавляют силикомарганец, а за 30 минут до окончания плавки продувают сжатым воздухом.
- Химически чистое вещество получают электролизом .








