Каждый химический элемент обладает определенными характеристиками и свойствами, которые не относятся к другим веществам. Существует много интересных фактов о германии:
Германий как химический элемент таблицы Менделеева
Германий — химический элемент таблицы Менделеева с атомным номером 32 и символом Ge. Германий — яркий, хрупкий, серовато-белый металлоид группы углерода.
История открытия германия очень загадочна. В 1869 году русский ученый и химик Д.И. Менделеев в своей работе «Периодический закон химических элементов» предположил существование многих еще неизвестных химических элементов. Одним из таких элементов был германий. Дмитрий Иванович назвал этот элемент «экокремний» и предположил, что его масса составит 72 am.
Спустя 16 лет, в середине 1885 года в шахте близ Фрейдберга (Германия) был обнаружен новый минерал. Его называли серебряным родитом из-за высокого содержания серебра. Немецкий химик Клеменс Винклер проанализировал новый минерал и обнаружил, что он состоит из серебра, серы и неизвестного элемента. В 1886 году Винклеру удалось выделить новый элемент и обнаружить, что он похож на сурьму.
Прежде чем опубликовать данные своих экспериментов, Клеменс Винклер решил назвать новый элемент нептунием. Он принял такое решение потому, что открытию планеты Нептун также предшествовали математические расчеты, как в истории с Менделеевым. Как оказалось, это название уже было принято другим элементом, но не тем, который сейчас носит это имя. Современный нептуний был открыт только в 1940 году. Поэтому Винклер решил назвать новый элемент Германией в честь своей родины, так же как и Галлию.
До конца 1930-х годов считалось, что этот элемент практически не электропроводен. В то время мировое производство германия составляло всего несколько килограммов в год. Ситуация кардинально не менялась до 1945 года, когда он был признан важным полупроводником. В 1955 году были получены первые германий-кремниевые сплавы, которые уже имели значительный коммерческий вес. К концу десятилетия мировое производство германия составляло около 40 тонн в год.

Применение германия довольно ограничено из-за его дефицита и высокой стоимости. Основное распределение этого элемента, в зависимости от спроса, выглядит следующим образом. 35 % используется для производства изделий из стекловолокна. 30 % используется в различных типах тепловизионного оборудования. 15% используется в катализаторах полимеризации. Еще 15% разрабатывается для производства электронных и солнечных электронных устройств. Остальные 5% распределены между металлургией, химиотерапией и фосфорами.
Свойства германия, такие как высокий коэффициент преломления и низкая оптическая дисперсия, делают его полезным для производства широкоугольных объективов камер, микроскопов и центрального провода оптических волокон. Поскольку германий прозрачен в инфракрасном диапазоне длин волн, он становится важным оптическим материалом. Он часто используется в качестве передней оптической системы в тепловизионных камерах. Обычно они работают в диапазоне от 8 до 14 микрон.
Он часто используется в приборах ночного видения и системах пожаротушения. Также устройства для измерения температуры. Они используются в технике (датчики температуры антифриза для автомобилей), медицине (датчики температуры тела) и военном деле (самонаводящиеся боеголовки тепловых ракет). В электронике кремний-германиевые сплавы используются в высокоскоростных интегральных схемах. Как показала практика, микропроцессоры с кремний-германиевыми сплавами работают гораздо быстрее, чем чисто кремниевые процессоры.
На солнечные батареи приходится немалая доля применений германия. Германий обычно используется в качестве подложки для пластин высокоэффективных фотоэлектрических элементов с несколькими спаями.
Интересные факты

Есть несколько интересных фактов о германии. Стоит начать с того, что некоторые соединения германия очень активны. В этом отношении они могут взаимодействовать со слизистыми оболочками человека и даже вызывать смерть.
Интересно также отметить, что первый транзистор на основе германия был разработан в 1948 году. Считается, что этот момент положил начало твердотельной электронике. Германий — самый чистый химический элемент, который человек очистил на сегодняшний день. Количество примесей в этом образце составляло 1 часть на 10 10. Это открытие сделало германий первым в мире сверхпроводником в 2005 году, а его применение открыло второй ветер.
Относительная молекулярная масса (Mr) — это число, показывающее, насколько часто масса данной молекулы превышает 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — как часто средняя атомная масса химического элемента больше, чем 1/12 массы атома углерода.
Поскольку германий в свободном состоянии находится в виде молекул, состоящих из одного атома Ge, значения атомной и молекулярной масс совпадают. Их количество равно 72 630.
Известно, что германий встречается в природе в виде пяти стабильных изотопов: 70 Ge (20,55%), 72 Ge (20,55%), 73 Ge (7,67%), 74 Ge (36,74%) и 76 Ge (7,67%) с массовыми числами 70, 72, 73, 74 и 76 соответственно. Ядро изотопа германия 70 Ge содержит тридцать два протона и тридцать восемь нейтронов, а остальные изотопы отличаются только количеством нейтронов.
Существуют искусственно нестабильные радиоактивные изотопы германия с массовыми числами от 58 до 86, включая самый долгоживущий изотоп 68 Ge с периодом полураспада 270,95 дней.
| Задание | Природный германий состоит из пяти изотопов: 70 Ge (20,55%), 72 Ge (20,55%), 73 Ge (7,67%), 74 Ge (36,74%) и 76 Ge (7,67%). Рассчитайте средний относительный атомный вес этого элемента, используя приведенные данные. |
| Решение | Средняя относительная атомная масса химического элемента рассчитывается как: |
Ar = Ar( 70 Ge)×w( 70 Ge) + Ar( 72 Ge)×w( 72 Ge) + … / 100%,
Ar = 70×20,55 + 72×20,55 + 73×7,67 + 74×36,74 + 76×7,67 / 100%,
Ar = 1438,5 + 1479,6 + 559,91 + 2718,76 + 582,92 / 100%,
Ar = 6779,69 / 100% = 67,7969.
| Задание | Вычислите массовую долю элементов в оксиде германия(IV), если его молекулярная формула GeO2. |
| Решение | Массовая доля элемента в составе какой-либо молекулы определяется по формуле: |
ω (X) = n × Ar (X) / Mr (HX) × 100%.
Найдем молекулярную массу оксида германия (IV):
Mr(GeO2) = Ar(Ge) + 2×Ar(O) = 73 + 2×16 = 73 + 32 = 105.
Тогда массовые доли скандия и кислорода равны:
ω (Ge) = Ar (Ge) / Mr (GeO)2ω (Ge) = 73 / 105 × 100% = 69,52%.
ω (O) = 2 × Ar (O) / Mr (GeO)
) × 100%;2ω (Ge) = 73 / 105 × 100% = 69,52%.
История элемента начинается в 1871 году, когда Дмитрий Медделёв «вычислил» его и положил на свою таблицу как Eccasilicium.
Как был открыт

Пятнадцать лет спустя немецкий химик Клеменс Винклер получил новый минерал аргентит из местных шахт для его изучения.
Первооткрыватель выделил из него неизвестный элемент и описал его свойства.
Он планировал назвать свое изобретение нептунием, но это название уже было занято. Затем он окрестил новичка Германом, по названию его родины.
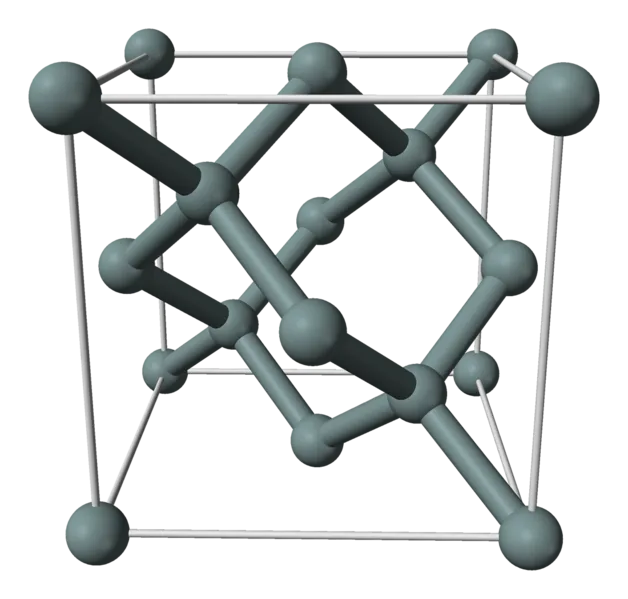
Германий хрупок, хотя его решетчатая структура похожа на структуру алмаза.
Физико-химические характеристики
Наиболее важным его свойством, имеющим практическое значение, является полупроводимость. Это самый распространенный природный полупроводник на Земле.
Твердая форма вещества обладает следующими свойствами:
Большинство кислородных соединений в веществе структурно схожи с кремнием (поэтому Менделеев классифицировал вещество как экауссиликат). Самые плотные из них смоделированы на основе структуры титана.
- Устойчивость к газам, воде, кислотам, щелочам.
- Стабильность при комнатной температуре.
- Быстрая окисляемость при 600+°С.
- Растворяется царской водкой, щелочным раствором перекиси водорода.
- Образует органические и неорганические соединения.
- Соединения имеют показатели окисления 2 и 4, устойчивы четырехвалентные формы.
Имя, символ, номер
| Германий (Ge), 32 | Группа, период, блок |
|---|---|
| Атомная масса (молекулярная масса) | 14, 4,>> |
| 72 630(8) указ. соч. (г/моль) | Электронная конфигурация |
| Ar 3d10 4s2 4p2 | Атомный радиус |
| 122,5 мкм | Химические свойства |
| Ковалентный радиус | |
| 122 мк.м. | Ионный радиус |
| (+4e) 53 (+2e) 73 мк.м. | Электромагнетизм |
| 2,01 (шкала Паулинга) | Электродный потенциал |
| Состояния окисления | 0 |
| -4; -2; -3; -2; -1; 0; +2; +3; +4 | Энергия ионизации |
| 1-й: 761,2 (7,89) кДж/моль (эВ) 2-й: 1537,0 (15,93) кДж/моль (эВ) 3-й: 3301,2 (34,21) кДж/моль (эВ) | Термодинамические свойства простого вещества |
| Плотность (в н.у.м.) | |
| 5,323 г/см³ | Температура плавления |
| 1210,6 K | Температура кипения |
| 3103 K | Удельная теплота плавления |
| 36,8 кДж/моль | Удельная теплота парообразования |
| 328 кДж/моль | Молекулярная теплоемкость |
| 23,32 Дж/(К-моль) | Молекулярный объем |
| 13,6 см³/моль | Кристаллическая решетка одного вещества |
| Решетчатая структура | |
| Алмаз | Параметр решетки |
| 5,660 Å | Температура Дебая |
| 360 K | Другие характеристики |
| Теплопроводность | |
| (300 К) 60,2 Вт/(м-К) | номер CAS |
| 7440-56-4 | Почти весь материал получен из углерода, обогащенного сфалеритом, магнетитом. |
Технология получения
Производственный процесс является многоступенчатым:
Чистый металл получают путем кристаллизации и выплавки.
- Вещество извлекается выщелачиванием, возгонкой, сплавлением с едким натром.
- На раскаленный концентрат воздействуют соляной кислотой.
- Конденсат очищается, разлагается методом гидролиза.
- Полученный диоксид восстанавливается до металлической формы водородом.
Германий относится к группе 14, период 4, таблицы Менделеева. Его серийный номер — 32, а название — Ge. Как простое вещество германий напоминает хрупкий полуметалл стального или серебристого цвета. Для него характерен металлический блеск. Элемент относится к полупроводникам с непрямой щелью.
Физические особенности

Валентность металла в различных соединениях может быть II или IV. Электронная формула германия (конформация) — 1 s 2 2 s 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 2. Атомная структура элемента также должна быть известна. Он состоит из 32 протонов и 41 нейтрона. На четырех орбитах движутся 32 электрона.
В нормальном состоянии атом элемента характеризуется двумя парами отрицательно заряженных частиц s и двумя парами отрицательно заряженных частиц p, так что вещество может образовывать две химические связи. В возбужденном состоянии один из s-электронов покидает свою орбиталь и перемещается в свободное положение на p-основе. Поскольку образуется 4 неспаренных электрона, германий способен образовать 4 связи через механизм обмена.
Основные физические свойства элемента:
При нормальных условиях кристаллическая решетка элемента имеет алмазную или кубическую форму. Полуметалл обладает необычным физическим свойством: германий считается одним из редких аномальных веществ, плотность которых увеличивается при плавлении. Кроме того, удельная проводимость германия увеличивается почти в 13 раз с ростом температуры, но снижается начиная с 1100 °C.
- температура плавления — 938,2 °C;
- температура кипения — 2850 °C;
- плотность — 5,33 г/см³;
- молярный объём — 13,6 см³/моль;
- атомная масса — 72,6 а. е. м.;
- молярная теплоёмкость — 23,32 Дж/К·моль.
В соединениях металл имеет степень окисления +4, +2 ил и-4. Если изучить химические свойства германия, то вещество напоминает кремний. При нормальных условиях он устойчив к воздействию воздуха, воды, щелочей и кислот. Германий можно растворить в водном растворе и в щелочном растворе перекиси водорода.
Химическая природа
Металл окисляется до оксидов при температуре 500-700 °C на воздухе. Кислотные производные этого элемента представляют собой твердые вещества с высокой температурой плавления. Они могут быть получены путем сплавления оксидов германия.
При реакции с галогенами металл образует тетрагалогениды. С фтором и хлором процесс проще. Тетрахлорид получают хлорированием германия в твердом состоянии или путем реакции его оксида (GeO2) с концентрированной соляной кислотой. Гидроксид образуется при гидролизе дигалогенидов этого элемента. Монооксид может быть получен при нагревании металла с его диоксидом.

При реакции с серой при температуре 1000 °C германий образует дисульфид, который представляет собой белое твердое вещество. При нагревании до 1100 °C металл легко вступает в реакцию с водородом. В результате образуется слабоустойчивое соединение под названием германин. Когда германий подвергается воздействию аммиака, он образует нитрид. Он не вступает в реакцию с углеродом. Вещество также способно образовывать металлоорганические (например, тетраэтилгерманат) и комплексные соединения с органическими гидроксильными молекулами (полибазовые кислоты, полиспирты).
Поскольку германий действует как полупроводник, он часто используется в электронике и технике для создания микросхем и транзисторов. Металлические сплавы необходимы для изготовления датчиков и детекторов, а его диоксид используется для изготовления инфракрасно-пропускающего стекла. Элемент используется в качестве резистора в радарных системах.
Сферы использования

Германий используется для изготовления призм и линз для инфракрасных оптических систем. Волоконно-оптические системы и полупроводниковые диоды не могут обойтись без этого материала. Элемент используется для измерений при низких температурах и для обнаружения инфракрасного излучения. Диоды и триоды на основе этого вещества используются в телевизорах, радиоприемниках, измерительном и аналитическом оборудовании.
В химических соединениях германий обычно имеет валентность 4 или 2. Соединения с валентностью 4 более стабильны. При нормальных условиях он устойчив к воздействию воздуха и воды, щелочей и кислот, растворим в водной среде и в щелочном растворе перекиси водорода.
Ковалентный радиус
Основная статья: Металлоорганические соединения
Соединения германия
Неорганические
- Гидриды
- Гермилен GeH2
- Герман GeH4
- Дигерман Ge2H6
- Тригерман Ge3H8
- Оксид германия (II) GeO
- Оксид германия (IV) GeO2
- Гидроксид германия (II) Ge(OH)2
- Гидроксид германия (IV) Ge(OH)4
- Метагидроксид германия (IV) GeO(OH)2
- Галогениды
- Бромид германия (IV) GeBr4
- Йодид германия (II) GeI2
- Йодид германия (IV) GeI4
- Фторид германия (IV) GeF4
- Хлорид германия (IV) GeCl4
Органические
Органометаллические соединения — это металлоорганические соединения, содержащие связь германий-углерод. Иногда так называют все органические соединения, содержащие германий.
Первое металлоорганическое соединение, тетраэтилгерманат, было синтезировано в 1887 году немецким химиком Клеменсом Винклером.
В 2007 году основными потребителями германия были: 35% оптических волокон; 30% тепловизионной оптики; 15% химических катализаторов; 15% электроники; металлургия потребляет небольшое количество германия.
Применение
Пример линзы из кристаллического германия в военных инфракрасных камерах на танке Т-14 «Армата
Оптика


Год
- Благодаря прозрачности в инфракрасной области спектра металлический германий сверхвысокой чистоты имеет стратегическое значение в производстве оптических элементов инфракрасной оптики: линз, призм, оптических окон датчиков. Наиболее важная область применения — оптика тепловизионных камер, работающих в диапазоне длин волн от 8 до 14 микрон. Это диапазон для наиболее популярных инфракрасных матриц на микроболометрах используемых в системах пассивного тепловидения, военных системах инфракрасного наведения, приборах ночного видения, противопожарных системах. Германий также используется в ИК-спектроскопии в оптических приборах, использующих высокочувствительные ИК-датчики. Германий проигрывает по пропускающей способности света в диапазоне от 8 до 14 микрон сульфиду цинка. Однако германий в отличие от сульфида цинка продолжает пропускать порядка 25 % инфракрасного излучения до длины волны 23 микрона, поэтому является одним из основных материалов для длинноволновой инфракрасной оптики, обычно используемой в военных прицелах.
- Оптические детали из Ge обладают очень высоким показателем преломления (4,0) и обязательно требует использования просветляющих покрытий. В частности, используется покрытие из очень твердого алмазоподобного углерода, с показателем преломления 2,0.
- Наиболее заметные физические характеристики оксида германия (GeO2) — его высокий показатель преломления и низкая оптическая дисперсия. Эти свойства находят применение в изготовлении широкоугольных объективов камер, микроскопии, и производстве оптического волокна.
- Тетрахлорид германия используется в производстве оптоволокна, так как образующийся в процессе разложения этого соединения диоксид германия удобен для данного применения благодаря своему высокому показателю преломления и низкому оптическому рассеиванию и поглощению.
- Сплав GeSbTe используется при производстве перезаписываемых DVD. Сущность перезаписи заключается в изменении оптических свойств этого соединения при фазовом переходе под действием лазерного излучения.
Радиоэлектроника
- До 1970-х годов германий был основным полупроводниковым материалом электронной промышленности и широко использовался в производстве транзисторов и диодов. Впоследствии германий был полностью вытеснен кремнием. Германиевые транзисторы и диоды обладают характеристиками, отличными от кремниевых, ввиду меньшего напряжения отпирания p-n-перехода в германии — 0,35…0,4 В против 0,6…0,7 В у кремниевых приборов. Кроме того, обратные токи у германиевых приборов имеют сильную зависимость от температуры, и на несколько порядков больше таковых у кремниевых — скажем, в одинаковых условиях кремниевый диод будет иметь обратный ток 10 пА, а германиевый — 100 нА, что в 10000 раз больше. Также у германиевых приборов значительно выше шум и ниже температура, при которой происходит разрушение p-n-переходов. По советскому ГОСТ 10862-64 (1964 г.) и более поздним стандартам германиевые полупроводниковые приборы имеют обозначение, начинающиеся с буквы Г или цифры 1, например: ГТ313, 1Т308 — высокочастотные маломощные транзисторы, ГД507 — импульсный диод. До того транзисторы имели индексы, начинающиеся с букв С, Т или П (МП), а диоды — Д, и определить материал прибора по индексу было сложнее. Диоды и транзисторы с индексами меньше 100, были германиевыми, от 100 до 199, — кремниевыми. Далее индексы зависели от частоты и мощности, причём, у транзисторов и диодов правила отличались. До конца 1960-х гг. германиевые полупроводниковые приборы использовались повсеместно, в настоящее время германиевые диоды и транзисторы практически полностью вытеснены кремниевыми, как имеющими значительно лучшие эксплуатационные характеристики.
- Сейчас в электронике германий используется в СВЧ-устройствах, как составная часть структур SiGe, позволяя достичь субтерагерцовых частот. Работы Жореса Алфёрова по структурам SiGe, в частности, заложили основу этого направления.
- Теллурид германия применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо-ЭДС 50 мкВ/К).
Экономика
Цены
Цена ($/кг) 1 400 1999 1 250 2000 1 240 2001 890 2002 620 2003 380 2004 600 2005 660 2006 880 2007 1 490 2008 Средние цены на германий в 2007 году 2009 950 - Германий металлический $1200/кг
- Германия диоксид $840/кг








