где E 0 ( 0 ) ^>= −4 а.е. что составляет примерно -108,8 эВ, что соответствует потенциалу ионизации V п ( 0 ) ^>= 2 а.е. (54,4 эВ). Экспериментальные значения E 0>= −2,90 а.е. (≅ −79,0 эВ) и V п>= 0,90 AU (24,6 эВ).
Гелий He
Порядок заполнения оболочек атома гелия (He) электронами следующий: 1s → 2s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Подуровень «с» может вмещать до 2 электронов, «s» — до 6 электронов, «d» — до 10 электронов и «f» — до 14 электронов.
Гелий имеет 2 электрона, которые вставляются в электронные оболочки в порядке, описанном выше:
2 электрона в плоскости 1s
Степень окисления гелия
Атомы гелия в соединениях имеют степень окисления 0.
Состояние окисления — это условный заряд атома в соединении: Связь в молекуле между атомами основана на разделении электронов, поэтому если атом имеет практически возрастающий заряд, то состояние окисления отрицательное (электроны несут отрицательный заряд), если заряд уменьшается, то состояние окисления положительное.
Ионы гелия
Атомы гелия в соединении имеют валентность .
Валентность гелия отражает способность атома гелия образовывать химические связи. Валентная структура вытекает из структуры электронной оболочки атома, электроны, участвующие в образовании химических соединений, называются валентными электронами. Более полное определение валентности следующее:
Количество химических связей, которыми данный атом соединен с другими атомами.
У Валенсы нет знака.
Количество атомных номеров, которые у ряда молекул, имеющих определенное количество валентных элементов, не имеет атомного номера, а количество валентных элементов, имеющих определенное количество валентных элементов, не имеет атомного номера.r— это молекулярная масса молекулы, деленная на 1/12 молекулярной массы атома углерода-12 ( 12 C). Это безразмерная величина.
Относительная атомная масса Ar— это молекулярная масса атома вещества, отнесенная к 1/12 молекулярной массы атома углерода-12 ( 12 C).
Поскольку гелий существует в свободном состоянии в виде одноатомной молекулы He, его атомная и молекулярная массы равны. Они равны 4,003.
Изотопы гелия
Гелий, самый распространенный элемент в космосе после водорода, состоит из двух стабильных изотопов — 4 He и 3 He. Их массовые числа равны 4 и 3. Ядро атома гелия 4 He содержит два протона и два нейтрона, а ядро атома гелия 3 He содержит такое же количество протонов и один нейтрон.
Спектральный анализ показывает его присутствие в солнечной атмосфере, в звездах и метеоритах. Накопление ядер 4 He во Вселенной обусловлено термоядерными реакциями, которые служат источником солнечной и звездной энергии.
Ионы гелия
При нормальных условиях гелий химически инертен, но когда его атомы сильно возбуждены, он может образовывать молекулярный He2+ ss2 ss*1. В нормальных условиях эти ионы нестабильны; они расщепляются на два нейтральных атома, когда захватывают недостающий электрон.
В свободном состоянии гелий состоит из одноатомных молекул He.
1,785-1 0-4 г/см 3 (при 0 °C и других стандартных условиях, газ)
0,125 г/см 3 (пр и-268,928 °C и других стандартных условиях, жидкость)
401* Согласно 1, гелий имеет плотность 1,786-1 0-4 г/см 3 (при 0 °C, стандартные условия, газ).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) гелия после 4 составляет 0,00723 кДж/моль.
408* Удельная теплота парообразования (энтальпия кипения ΔHтемпература кипения) гелия после 4 составляет 0,084 кДж/моль.
410* Молярная теплоемкость гелия после 3 равна 20,79 Дж/(К-моль).
Физические свойства гелия:
При нормальной температуре и давлении гелий представляет собой бесцветный, без запаха, без вкуса, нетоксичный, инертный одноатомный газ с химической формулой He.
При нормальных условиях гелий ведет себя почти как идеальный газ. При любых условиях гелий является одноатомным веществом.
Гелий — легкий газ. Гелий в 7,26 раза легче воздуха, но тяжелее водорода. Например, один кубический метр воздуха, смеси различных газов, весит 1,293 кг, а один кубический метр гелия весит 0,178 кг. Один кубический метр гелия может поднять объект массой 1,115 кг.
Плотность гелия (Ne) составляет 0,00017846 г/см 3 при 20 °C и других стандартных условиях, а плотность жидкого гелия пр и-269 °C и других стандартных условиях составляет 0,13 г/см 3.
Теплопроводность гелия при температуре 300 К составляет 0,152 Вт/м-К. Гелий обладает более высокой теплопроводностью, чем все остальные газы, кроме водорода. Теплопроводность гелия примерно в 6,255 раз больше теплопроводности воздуха, а именно 0,0243 Вт/м-К.
Гелий (Na) практически нерастворим в воде и органических растворителях. Например, растворимость гелия в воде составляет 0,000179 г/100 г (при 30 °C).
Гелий не растворяется в металлах, как, например, водород.
Гелий диффундирует через твердые материалы со скоростью, в три раза превышающей скорость диффузии воздуха, и примерно на 65 % выше, чем у водорода.
При нормальных условиях и температуре выш е-250 °C гелий расширяется и нагревается, а не охлаждается, как большинство газов (ниж е-250 °C он начинает вести себя «нормально»).
Температура кипения гелия (Ne) составляе т-268,928 °C.
Температура кипения гелия (T = 4,222 K для 4 He) является самой низкой среди всех веществ. При атмосферном давлении гелий не становится твердым, даже при абсолютном нуле.
При температуре 2,1768 К (-270,9732 °C, -455,7518 °F) и при атмосферном давлении гелий претерпевает второй тип фазового перехода (от гелия I к гелию II), который сопровождается резким изменением некоторых свойств: теплоемкости, вязкости и плотности. Гелий II (при температуре ниже 2,1768 K) характеризуется сверхтекучестью, т.е. способностью течь без трения через узкие пространства (менее 100 нм). Гелий II не имеет вязкости. Гелий II также обладает огромной теплопроводностью. Поэтому, в отличие от кипящего гелия I, он выглядит как неподвижная жидкость с хорошо видимым мениском. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только квантовой механикой.
Сверхтекучесть жидкого гелия становится понятной, например, в следующем эксперименте. Когда сверхтекучая гелиевая жидкость наливается в контейнер, она начинает вытекать через края в направлении самой высокой температуры, даже если уровень жидкости находится намного ниже края контейнера.
Жидкий гелий практически не растворяет другие вещества.
Гелий — единственное вещество, которое при нормальном давлении не затвердевает даже вблизи 0 К, а кристаллизуется только при давлении более 2,5 МПа. Экстремальные условия также необходимы для образования нескольких химических соединений гелия, все из которых нестабильны в обычных условиях.
Температура плавления гелия (Ne) при давлении 2,5 МПа составляе т-272,2 °C.
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием:
При нормальных условиях гелий химически инертен.
Многие соединения гелия существуют только в газовой фазе в виде так называемых возбужденных молекул, в которых возбужденные электронные состояния стабильны, а основное состояние нестабильно.
Например, гелий образует двухатомные молекулы He+2, фтор HeF и хлор HeCl (эксимерные молекулы образуются, когда смесь гелия и фтора или хлора подвергается воздействию электрического разряда или ультрафиолетового излучения).
Гелий-4 — Helium-4

Гелий-4 (… He.) — стабильный изотоп элемента гелия. Он является самым распространенным из двух встречающихся в природе изотопов гелия и составляет около 99,99986% всего гелия на Земле. Его ядро идентично ядру альфа-частицы и состоит из двух протонов и двух нейтронов.
Альфа-распад тяжелых элементов в земной коре является источником наиболее распространенного на Земле природного гелия-4, который образуется после остывания и затвердевания планеты. Считается, что большая часть гелия-4 в Солнце и Вселенной появилась в результате Большого взрыва и называется «первичным гелием», хотя он также образуется в результате ядерного синтеза в звездах. Однако первичный гелий-4 в основном отсутствует на Земле, поскольку он улетучился во время высокотемпературной фазы формирования Земли.
Гелий-4 составляет около четверти массы обычной материи во Вселенной, в то время как остальная материя почти полностью состоит из водорода.
Когда гелий-4 охлаждается ниже 2,17 Кельвина (-271,17 °C), он становится сверхтекучей жидкостью, свойства которой сильно отличаются от свойств обычной жидкости. Например, когда сверхтекучий гелий-4 хранится в открытом контейнере, тонкая пленка поднимается по стенкам контейнера и переливается через край. В таком состоянии она называется «прокатной пленкой». Это странное поведение является следствием отношения Клаузиуса-Клапейрона и не может быть объяснено ни современной моделью классической механики, ни ядерной или электрической моделями — оно может быть понято только как квантово-механическое явление. Полный спин ядра гелия-4 является целым числом (нулем) и, таким образом, является бозоном (как и нейтральные атомы гелия-4). В настоящее время предполагается, что сверхтекучая среда является проявлением конденсации Бозе-Эйнштейна, которая возникает только в присутствии количества бозонов.
Считается, что твердый гелий-4 может быть сверхтекучим (аморфное твердое вещество, проявляющее сверхтекучесть) при 0,2 К и 50 атм.
Гелий-4 также встречается на Луне и является самым распространенным изотопом гелия, как и на Земле.
Атом гелия — второй по простоте атом (водород — самый простой), но дополнительный электрон вводит третье «тело», так что решение его волнового уравнения становится «проблемой трех тел», не имеющей аналитического решения. Однако численные приближения квантово-механических уравнений дали хорошие оценки основных атомных свойств гелия-4, таких как размер и энергия ионизации.
Стабильность ядра He и электронной оболочки
Ядро атома гелия-4 идентично альфа-частице. Эксперименты с рассеянием высокоэнергетических электронов показывают, что их заряд экспоненциально уменьшается от максимума к центральной точке, подобно плотности заряда собственного электронного облака. Эта симметрия отражает аналогичную физическую основу: пара нейтронов и пара протонов в ядре гелия подчиняются тем же квантовомеханическим правилам, что и пара электронов в гелии (хотя ядерные частицы находятся под действием другого потенциала ядерной связи), так что все эти фермионы полностью занимают орбитали 1s парами, ни один из них не имеет орбитального углового момента и каждый уравновешивает атомный спин другого. Добавление еще одной такой частицы потребует углового момента и выделит гораздо меньше энергии (на самом деле, ни одно ядро с пятью нуклонами не является стабильным). Поэтому такое расположение всех этих частиц энергетически чрезвычайно стабильно, и эта стабильность объясняет многие важные факты о гелии в природе.
Стабильность и низкая энергия электронного облака гелия объясняют, например, химическую инерцию гелия (самую экстремальную среди всех элементов) и отсутствие взаимодействия между атомами гелия (что обуславливает самые низкие температуры плавления и кипения среди всех элементов).
Аналогичным образом, особая энергетическая стабильность ядра гелия-4, обусловленная сходными явлениями, объясняет легкость образования гелия-4 в атомных реакциях, включающих как испускание тяжелых частиц, так и термоядерный синтез. В реакциях водородного синтеза образуется некоторое количество стабильного гелия-3, но это очень малая доля по сравнению с производством высокоэнергетического гелия-4. Стабильность гелия-4 является причиной того, что в реакциях гелиевого синтеза водород превращается в гелий-4, а не в дейтерий (водород-2), гелий-3 или другие более тяжелые элементы. Отчасти поэтому альфа-частица является наиболее распространенным типом барионных частиц, выбрасываемых из ядра; другими словами, альфа-распад встречается гораздо чаще, чем кластерный распад.
Энергия связи на нуклон распространенных изотопов. Энергия связи одной частицы гелия-4 намного выше, чем у всех соседних нуклидов.
Необычная стабильность ядра гелия-4 также важна с космологической точки зрения. Это объясняет тот факт, что в первые минуты после Большого взрыва, когда «суп» из свободных протонов и нейтронов, который первоначально был создан в соотношении примерно 6:1, остыл до такой степени, что стала возможной ядерная связь, были созданы почти исключительно ядра гелия-4. Связь нуклонов в гелии-4 настолько сильна, что при его образовании почти все свободные нейтроны расходуются в течение нескольких минут, не успевая распасться на бета-атомы, оставляя лишь несколько для образования более тяжелых атомов (в основном лития, бериллия и бора). Энергия ядерной связи гелия-4 больше на нуклон, чем у любого другого элемента (см. Нуклеогенез и энергия связи), поэтому после образования гелия не было энергетического «толчка» для образования элементов 3, 4 и 5. Энергетически неэкономично сохранять гелий в следующем элементе с более высокой энергией на нуклон (углерод). Однако из-за отсутствия промежуточных элементов и крайней нестабильности бериллия-8 (продукта слияния двух ядер He), в этом процессе три ядра гелия должны столкнуться почти одновременно (см. Тройной альфа-процесс). Поэтому не было времени для образования сколько-нибудь заметного количества углерода в течение нескольких минут после Большого взрыва, прежде чем ранняя расширяющаяся Вселенная охладилась до температур и давления, при которых слияние гелия и углерода было невозможно. Это привело к тому, что в ранней Вселенной соотношение водорода и гелия было очень похоже на сегодняшнее (3 части водорода к 1 части гелия-4 по массе), и почти все нейтроны во Вселенной были захвачены гелием-4.
Вариационный метод
Для получения более точной энергии используется принцип изменения электрон-электронного потенциала Vеес волновой функцией
ψ 0 ( р → 1, р → 2 ) = 8 π а 3 е − 2 ( р 1 + р 2 ) / а (>_ ,,>_ ) =>>e ^<- 2 (r_ + r_ ) / a>>:
⟨ ЧАС ⟩ = 8 E 1 + ⟨ V е е ⟩ = 8 E 1 + ( е 2 4 π ϵ 0 ) ( 8 π а 3 ) 2 ∫ е − 4 ( р 1 + р 2 ) / а | р → 1 − р → 2 | d 3 р → 1 d 3 р → 2 + langle V_ angle = 8E_ +>>>
После интеграции результат выглядит следующим образом
⟨ ЧАС ⟩ = 8 E 1 + 5 4 а ( е 2 4 π ϵ 0 ) = 8 E 1 − 5 2 E 1 = − 109 + 34 = − 75 эВ +>>>>
Это ближе к экспериментальному значению, но если использовать лучшую тестовую волновую функцию, то можно получить еще более точный ответ. Идеальная волновая функция была бы такой, которая не игнорирует влияние другого электрона. Другими словами, каждый электрон представляет собой облако отрицательного заряда, которое в некоторой степени экранирует ядро, так что другой электрон фактически видит реальный ядерный заряд Z, который меньше 2. Волновая функция такого типа определяется выражением:
ψ ( р → 1, р → 2 ) = Z 3 π а 3 е − Z ( р 1 + р 2 ) / а>_ ,>_ ) =>>>e ^<- Z (г_ + г_ ) / а>>
Рассматривая Z как параметр изменения для минимизации H, гамильтониан, использующий вышеуказанную волновую функцию, имеет вид:
⟨ ЧАС ⟩ = 2 Z 2 E 1 + 2 ( Z − 2 ) ( е 2 4 π ϵ 0 ) ⟨ 1 р ⟩ + ⟨ V е е ⟩ E_ +2 (Z-2)>>>
После расчета математического ожидания 1 р>>и Vеематожидание гамильтониана:
Вам необходимо рассчитать минимальное значение Z. Таким образом, если вы возьмете производную от Z и подставите в уравнение 0, то получите минимальное значение Z:
d d Z ( − 2 Z 2 + 27 4 Z E 1 ) = 0>left (left -2Z ^ +>Zight E_ ight) = 0>
Это показывает, что другой электрон слегка экранирует ядро и уменьшает эффективный заряд с 2 до 1,69. Таким образом, мы получаем максимально точный результат:
где снова E1обозначает энергию ионизации водорода.
Используя более сложные/точные волновые функции, энергия основного состояния гелия рассчитывалась все ближе и ближе к экспериментальному значени ю-78,95 эВ. 7 Вариационный подход был улучшен до очень высокой точности для интегрированной квантовой функции состояния Г.В.Ф. Дрейком и соавторами 8 9 10 и Дж.Д. Морганом III, Джонатаном Бейкером и Робертом Хиллом 11 12 13 с использованием базисных функций Хиллерааса или Франковского-Пекериса. Для достижения полного согласия с экспериментом в плане спектроскопической точности необходимо включить релятивистские и квантово-электродинамические поправки. 14 15
Экспериментальное значение энергии ионизации
Для гелия энергия первой ионизации составляе т-24,587387936 (25) эВ. 16 Это значение было определено экспериментально. 17 Теоретическое значение второй энергии ионизации атома гелия составляе т-54,41776311 (2) эВ. 16 Полная энергия основного состояния атома гелия составляе т-79,005151042 (40) эВ, 16 ил и-2,90338583 (13) атомных единиц а.е., что соответствуе т-5,80677166 (26) Ry.
- Коррекция Араки – Сучера
- Молекулярный ион водорода
- Атом лития
- Список квантово-механических систем с аналитическими решениями
- Квантовая теория поля
- Квантовая механика
- Квантовые состояния
- Теоретическое и экспериментальное обоснование уравнения Шредингера
- «Атом гелия» в Викиверситете
Химический элемент гелий (He) — строение, свойства и общая характеристика инертного газа

Тем, кто интересуется химией, будет интересно узнать, что гелий — это химический элемент, входящий в восемнадцатую группу знаменитой таблицы Менделеева, на вершине группы благородных газов, а на втором месте. Сегодня это вещество имеет широкий спектр применения, поскольку его искусственно синтезируют из природного газа, содержащегося в недрах Земли.

Основная информация об элементе
Это вещество, уникальное в своем роде, считается одним из самых распространенных во Вселенной, поскольку по объему оно уступает только водороду и составляет около 23% от общей массы этого бесконечного пространства. Другие физические свойства гелия, которые близки к рекордным значениям, также заслуживают более пристального изучения.
Физические особенности
Этот химический элемент считается почти полностью инертным газом, который не токсичен, не имеет вкуса и запаха. Однородная структура атома гелия остается неизменной при любых условиях, но другие его свойства зависят от атмосферного давления, температурного режима и многих других параметров. Гелий является самым легким идеальным газом после водорода и обладает следующими физическими свойствами:
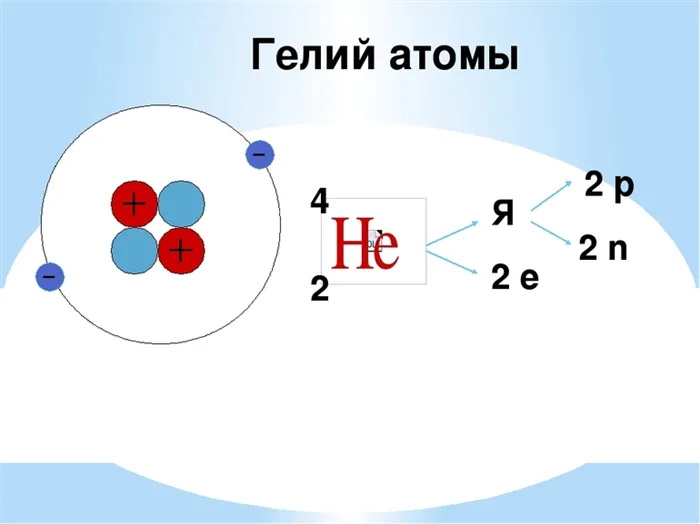
- Молярная масса атома газа составляет 4,002601 грамма на моль. Что касается молярного объема, то этот показатель равен 31,81 сантиметра кубических на моль, тогда как молярная теплоемкость составляет 20,79 Дж/Кмоль.
- Плотность вещества напрямую зависит от температурного режима, соответствуя 0,147 грамма на сантиметр кубический при падении столбика термометра ниже отметки в минус 270 градусов Цельсия и 0,000117846 градуса при нагревании до плюс 20 градусов и выше.
- Температура кипения у гелия является наиболее низкой, если сравнивать его с любым другим химическим элементом. Так, вещество имеет свойство закипать при температуре, равной 4,2152 Кельвина, что эквивалентно минус 268,94 градуса Цельсия.
- Температурный режим плавления соответствует 0,95 Кельвина или минус 272,2 градуса Цельсия при давлении, равном 2,5 МПа. При этом удельная теплота плавления составляет 0,0138 килоДжоуля на моль при удельной теплоте испарения 0, 0829 кДж/моль.
- Получение вещества в твердом виде становится возможным только при атмосферном давлении выше 25 атмосфер, тогда как при любых других показателях (даже нулевых) он не переходит в эту фазу.
- Гелий, найденный в природных условиях, всегда состоит из двух изотопов стабильного типа, один из которых имеет высокий процент распространения, близком к сотне, тогда как другой встречается гораздо реже, причем в совершенно разных естественных источниках (до 0,00014%). Помимо прочего, науке известны еще как минимум 6 радиоактивных гелиевых изотопов искусственного происхождения.
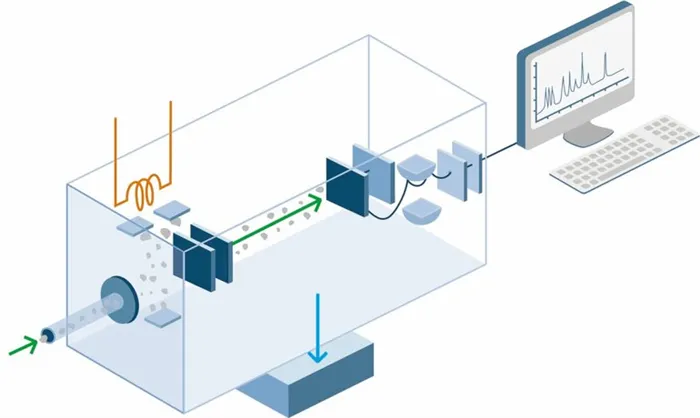
Следует отметить, что эмиссионный спектральный анализ в настоящее время используется для качественной идентификации веществ, в то время как хроматографические и масс-спектрометрические тесты продолжают использоваться для количественной идентификации. Также важны более простые методы идентификации, включающие измерение основных параметров, таких как плотность, молекулярная масса и теплопроводность.
Гелий в газообразном состоянии очень трудно растворить в воде (он намного тяжелее любого другого газа). В литре воды при температуре 20 градусов Цельсия, например, объем растворенного газа составляет не более 8,8 миллилитров в 100. Его растворимость в этиловом спирте еще хуже, не превышая 2,8 мл/л при температуре 15 градусов Цельсия и 3,2 мл/л при нагревании этанола до 25 градусов Цельсия.
Интересные факты о гелии
Название элемента происходит от греческого helios (солнце) и латинского helium, причем последнее название выбрано не случайно. Не секрет, что суффикс «um» используется в металлах, в которых гелий был обнаружен в момент его открытия. И хотя на самом деле вещество не является металлическим, его иногда называют так на латыни, что не является ошибкой.
Немного истории
Сегодня мало кто помнит, что открытие элемента датируется 18 августа 1868 года, когда известный французский ученый решил изучить хромосферу Солнца во время полного затмения в одном из индийских городов. Примечательно, что всего три месяца спустя такое же открытие было сделано в Англии, хотя в то время никто не знал, насколько оно было незначительным из-за более сложного соответствия научных данных.
В 1881 году итальянский вулканолог Луиджи Палмери, исследовавший Везувий, также распознал это вещество и сообщил общественности о своем открытии. Самое важное событие в открытии гелия произошло 27 лет спустя, когда он был впервые обнаружен внутри планеты. Затем газ был извлечен из вездесущего минерала клавита и со временем был использован учеными для определения его удельного веса и других физических параметров.

Со временем ученые научились добывать гелий в жидком виде методом удушения. В отличие от этого, попытки получения твердого гелия долгое время оставались безуспешными. Ситуация не менялась до 1926 года, когда в дополнение к охлаждению было применено критическое снижение атмосферного давления на 35 атмосфер и возникла кристаллическая решетка вещества.
Получение и применение
Несмотря на его широкое распространение во Вселенной, удивительно, что гелий довольно редко встречается на Земле. Образование гелия на Земле и в космосе также отличается, поскольку в первом случае он образуется в результате распада альфа-частиц тяжелых элементов. В результате часть вещества проникает сквозь земные породы, смешивается с газом и имеет концентрацию 7 процентов от общего объема или более.
В настоящее время крупные месторождения гелия имеются в таких странах, как Индия, Бразилия, Россия и Танзания. Это, конечно же, гелийсодержащие газы, используемые в промышленности для извлечения чистого элемента или его производных. Для этого используется процесс охлаждения путем сдавливания, что значительно облегчает трудность разжижения элемента.
В результате получается смесь, состоящая не только из гелия, но и из водорода и неона, которая затем очищается. В результате доля неочищенного гелия составит около 70-90 % от общего количества. После окончательной фильтрации продукт, который, как известно, не воспламеняется и поэтому не представляет опасности, переливается в металлические бутылки, изготовленные в соответствии с ГОСТ 949-73. Если речь идет о транспортировке сжиженного газа, используются специальные баллоны STG-10 и STG-25.

Как был открыт Гелий

Химический элемент гелий был открыт в Индии 18 августа 1868 года. Французский астроном Жюль Янссен наблюдал ярко-желтую линию, исходящую из гелия, во время полного солнечного затмения в Гунтуре. Исследуя хромосферу Солнца, астроном обнаружил, что длина волны составляет 587,49 нм. Ученый сначала принял эту линию за ионы натрия. 20 октября того же 1868 года английский астроном Норман Локьер также обнаружил эту линию в спектре излучения Солнца, но, в отличие от Янссена, он подозревал, что линия обусловлена элементом Солнца, который не присутствует на Земле. Норман Локьер и Эдвард Франкленд назвали этот неизвестный элемент греческим словом «гелий».
В 1881 году итальянский физик Луиджи Пальмиери обнаружил гелий на Земле, изучая вещество после взрыва вулкана Везувий. 26 марта 1895 года шотландский химик Уильям Рамсей впервые получил гелий путем обработки минерала клевеита минеральными кислотами. В том же году два шведских ученых, Теодор Клив и Абрахам Ланглет, сумели собрать достаточное количество газа, чтобы точно определить его атомный вес. В 1908 году голландский физик Хейке Камерлинг Оннес впервые сжижил гелий. Ей удалось понизить температуру д о-5 Кельвинов, ил и-278 °C. В 1926 году студенту Оннеса Виллему Хендрику Киссому удалось затвердеть 1 см3 гелия под высоким давлением. Затем российский физик Петр Леонидович Капица ввел понятие сверхтекучести, изучая изотоп гелия-4. Сверхтекучесть — это состояние, при котором вещество практически не имеет вязкости. Он смог продемонстрировать это при температуре гелия, близкой к 0 Кельвинов.
Читать: Водород как химический элемент в таблице Менделеева.
Интересные свойства гелия
Прежде всего, гелий не может вступать в химические реакции и не имеет окислительных состояний. Гелий является одноатомным газом и имеет только один электронный уровень (оболочку). Это чрезвычайно стабильный газ, поскольку первый уровень полностью заполнен электронами, что говорит о сильном влиянии ядра на электроны. Атомы гелия не только не реагируют с другими веществами, но даже не соединяются друг с другом.
Жидкий гелий обладает рядом особых свойств. В 1930-х годах при еще более низких температурах наблюдалось чрезвычайно странное и невероятное явление: Когда гелий охлаждается всего на 2 градуса выше абсолютного нуля, он претерпевает неожиданную трансформацию. Поверхность жидкости становится совершенно спокойной и гладкой, без единого пузырька или малейшей ряби в жидкости. Жидкий гелий становится сверхтекучим. Этот гелий может подниматься по стенкам и «убегать» из контейнера, в котором он хранится, благодаря нулевой вязкости сжиженного газа. Фонтан можно сделать с нулевым трением, что означает, что такой фонтан может течь бесконечно. Несмотря на теории, ученые обнаружили, что сжиженный гелий — это не просто жидкость. Пример 2He показывает, что сжиженный газ состоит из двух взаимопроникающих жидкостей: нормального (вязкого) компонента и сверхтекучего (вязкого) компонента. Компонент сверхтекучей жидкости является идеальным и не имеет трения при движении в сосудах и капиллярах.
Что касается твердого гелия, то в настоящее время ученые проводят множество экспериментов и испытаний. Твердый 4He обладает квантовым эффектом, таким как волна кристаллизации. Это явление связано с колебанием границы раздела в системе «кристалл-жидкость». Достаточно слегка встряхнуть этот гелий, и фазовая граница между жидкостью и твердым телом становится похожей на границу между двумя жидкостями!
Об элементе
Гелий — второй элемент в периодической таблице элементов Д. И. Менделеева с атомным номером 2. Он находится в 18-й группе (по старой систематике — главной подгруппе восьмой группы), первом периоде периодической таблицы. В периодической системе он находится на вершине группы благородных газов. Он обозначается символом He (лат.: гелий).
Гелий — это простое вещество, инертный одноатомный газ без цвета, вкуса и запаха.
Гелий — один из самых распространенных элементов во Вселенной, сразу после водорода. Гелий также является вторым по легкости химическим веществом (после водорода). Его температура кипения самая низкая из всех известных веществ.
Гелий извлекается из природного газа с помощью низкотемпературного процесса разделения, называемого фракционной дистилляцией.
Гелий был обнаружен на Земле только через 27 лет после его первоначального открытия — в 1895 году шотландский химик Уильям Рамсей проанализировал образец газа, полученного при разложении минерала клевеита, и обнаружил в его спектре ту же ярко-желтую линию, которая ранее была обнаружена в солнечном спектре. Образец был отправлен для дальнейшего изучения известному английскому спектроскописту Уильяму Круксу, который подтвердил, что желтая линия, наблюдаемая в спектре образца, соответствует D3гелиевая линия. 23 марта 1895 года Рамсей сообщил об открытии гелия на Земле Лондонскому королевскому обществу, а также Французской академии через известного химика Марселина Бертло.
Происхождение названия. От греческого helios — «солнце» (см. Гелиос). Интересно, что элемент был назван с характерным металлическим суффиксом «-iii» (лат. «-um» — «гелий»), потому что Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему название «гелион». В современной науке название «гелион» зарезервировано для ядра легкого изотопа гелия — гелия-3.
Физические свойства
Гелий — это практически инертный химический элемент, нетоксичный, бесцветный, без запаха и вкуса. При нормальных условиях это одноатомный газ. Его температура кипения (T = 4 215 K для 4He) является самой низкой из всех веществ, а твердый гелий получается только при давлении выше 25 атмосфер — при атмосферном давлении он не переходит в твердую фазу даже при абсолютном нуле. Экстремальные условия также необходимы для образования нескольких химических соединений гелия, все из которых нестабильны в обычных условиях.

Химические свойства
Гелий — наименее реактивный элемент в группе 18 (благородные газы) и вообще во всей таблице Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, в которых возбужденные электронные состояния стабильны, а основное состояние нестабильно. Гелий образует две атомные молекулы, He+2, фтор HeF и хлор HeCl (эксимерные молекулы образуются под воздействием электрических разрядов или ультрафиолетового излучения в смеси гелия и фтора или хлора) Энергия связи молекулы He+2 иона гелия составляет 58 ккал/моль, равновесное расстояние между ядрами — 1,09 Å.








