При нормальных условиях он представляет собой бледно-желтый газ. При низких концентрациях в воздухе он пахнет озоном и хлором одновременно. Он очень агрессивен и токсичен.
Формула плавиковой кислоты
Фтористоводородная кислота представляет собой 40%-ный раствор плавиковой кислоты. При нормальных условиях это бесцветная жидкость с плотностью 1,693 г/л (н.у.к.).
Он термически стабилен и лишь частично разлагается при очень высоких температурах. Нерастворим в воде, слабокислотный. Образует кристаллические гидриды с составом HF×H2O и HF×2H2О. Нейтрализуется щелочами. Это типичный неводный протонный растворитель.
Графическая (структурная) формула плавиковой кислоты
Структурная формула (диаграмма) фтористоводородной кислоты более проста для понимания. Она показывает, как атомы связаны между собой в молекуле (см. рис. 1).
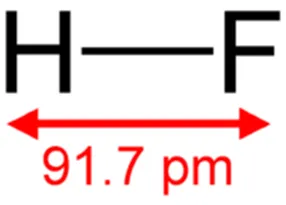
Рисунок 1: Графическая формула фтористоводородной кислоты.
Ионная формула
Плавиковая кислота является электролитом, который растворяется в ионах в водном растворе в соответствии со следующим уравнением реакции:
В 1771 году Карл Вильгельм Шееле приготовил водный раствор плавиковой кислоты в больших количествах, хотя плавиковая кислота была известна и раньше в стекольной промышленности. Французскому химику Эдмону Фреми (1814-1894) приписывают открытие безводного фтористого водорода (HF) в попытке выделить фтор.
Структура и реакции
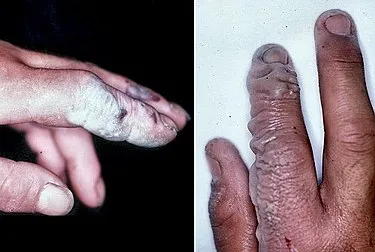
Хотя HF является молекулой с двумя атомами, он образует относительно прочные межмолекулярные связи. Твердый HF состоит из зигзагообразных цепочек молекул HF. Молекулы HF с короткими связями H — F 95 пм соединяются с соседними молекулами с межмолекулярным расстоянием H — F 155 пм. 4 Жидкий HF также состоит из цепочек молекул HF, но цепочки короче и состоят в среднем из пяти или шести молекул. 5
Сравнение с другими галогенидами водорода
Фтористый водород не кипит при 20 °C, в отличие от более тяжелых галогеноводородов, которые кипят при температуре о т-85 °C д о-35 °C. 6 7 8 Эти водородные связи между молекулами HF приводят к высокой вязкости в жидкой фазе и более низкому ожидаемому давлению в газовой фазе.
Водные растворы
HF смешивается с водой (растворяется в любом соотношении). В отличие от них, другие галогеноводороды имеют ограниченную растворимость в воде. Фтористый водород образует моногидрат HF. ЧАС2O с температурой плавлени я-40 °C (-40 °F), что на 44 °C (79 °F) выше температуры плавления чистого HF. 9
| HF и H2O похожи | |
| Точки плавления галогенидов водорода (синий) и халькогенидов водорода (красный): HF и H2Разрушить напряженность. | Точка замерзания HF/H2O: Стрелки указывают на соединения в твердом состоянии. |
Водные растворы HF называются плавиковой кислотой. В разбавленном виде плавиковая кислота ведет себя как слабая кислота, в отличие от других галогеновых кислот, благодаря образованию водородных связей. CHAS 3 O + — F -. Однако концентрированные растворы являются сильными кислотами, поскольку в дифториде преобладают анионы, а не пары ионов. Автоионизация наблюдается в жидком безводном HF: 10 11
который образует сильнокислую жидкость (CHAS0= -11).
Реакции с кислотами Льюиса
Использовать
В целом, безводный фтористый водород чаще используется в промышленности, чем его водный раствор — плавиковая кислота. Его основное применение — в качестве прекурсора для фторорганических углеводородов и в качестве прекурсора криолита при электролизе алюминия. 14
Прекурсор фторорганических соединений
HF реагирует с хлорированными углеводородами с образованием фторированных углеводородов. Важным применением этой реакции является производство тетрафторэтилена (ТФЭ), предшественника тефлона. Хлороформ фторируется HF для получения хлордифторметана (R-22): 14
CHCl3+ 2 HF → CHClF2+ 2 HCl
Пиролиз хлордифторметана (при 550-750 °C) дает ТФЭ.
HF является активным растворителем при электрохимическом фторировании органических соединений. При таком подходе HF окисляется в присутствии углеводородов, и фтор заменяет связи C-H на связи C-F. 15
1,1-Дифторэтан получают путем добавления HF к ацетилену с использованием ртути в качестве катализатора. 15
HC≡CH + 2 HF → CH3швейцарский франк2
Промежуточным продуктом этого процесса является винилфторид или фторэтилен, мономерный предшественник поливинилфторида.
Прекурсор фторидов металлов и фтора
Электролиз алюминия основан на электролизе фторида алюминия в расплавленном криолите. На тонну алюминия расходуется несколько килограммов HF, с использованием HF производятся и другие фторированные металлы, включая гексафторид урана. 14
HF является прекурсором элементарного фтора, F2при электролизе раствора HF и дифторида калия. Дифторид калия необходим, поскольку безводный HF не проводит электричество. Несколько тысяч тонн F2производятся каждый год. 16
Катализатор
HF служит катализатором в процессах алкилирования на нефтеперерабатывающих заводах. Он используется на большинстве установленных в мире мощностей по производству линейного алкилбензола. Процесс включает дегидрирование п-парафинов до олефинов и последующую реакцию с бензолом с использованием HF в качестве катализатора. На нефтеперерабатывающих заводах, например, «алкилат», компонент высокооктанового бензина, производится на установках алкилирования, в которых C3и C4олефины и изобутан. 14
Растворитель
Фтористый водород является отличным растворителем. Благодаря способности HF участвовать в образовании водородных связей, даже белки и углеводы растворимы в HF и могут быть извлечены из него. В отличие от этого, большинство нефторированных неорганических химикатов реагируют с HF, а не растворяются. 17
Из Википедии — свободной энциклопедии
Не следует путать с Hf.
Фтористый водород (фтористый водород, фтористый водород, HF) — это бесцветный токсичный газ (при нормальных условиях) с резким запахом; при комнатной температуре он существует в основном в виде димера H2F2; ниже 19,9 °C он представляет собой бесцветную летучую жидкость. Ее можно смешивать с водой в любом соотношении для получения плавиковой кислоты (HF); при концентрации 35,4 % HF она образует с водой азеотропную смесь.
Блок: 2/10 | Количество символов: 1174 Источник: https://wiki2.org/ru/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Строение молекулы
Молекула фтористого водорода сильно полярна, μ = 0,64⋅10-29 кл-м. В жидком и газообразном состоянии фтористый водород очень восприимчив к связыванию из-за образования сильных водородных связей. Энергия водородной связи FH—FH составляет около 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Также в газообразном состоянии фтористый водород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют только при температуре выше 90 °C. Из-за высокой прочности связи термическое разложение фтористого водорода заметно только при температуре выше 3500 °C (это выше температуры плавления вольфрама, самого тугоплавкого металла). Для сравнения, термическое разложение воды заметно при температурах выше 2000 °C.

В кристаллическом состоянии HF образует орто-ромбические кристаллы, состоящие из цепочечных структур: Угол HFH = 116°, d(F-H) = 95 пм, d(F—H) = 155 пм. Аналогичные сломанные конструкции
Цепи с углом HFH = 140°) имеют такие же разрушенные структуры, как и HF-полимеры в газовой фазе.
Блок: 2/10 | Количество символов: 1067 Источник: https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Хлеб
«Хлеб» (украинское «Хліб») — одна из самых известных картин украинской советской художницы Татьяны Яблонской, созданная в 1949 году, за которую она была удостоена Сталинской премии второй степени в 1950 году. Картина была удостоена бронзовой медали на Всемирной выставке в Брюсселе в 1958 году и демонстрировалась на нескольких крупных международных выставках.
При работе над полотном художник использовал эскизы, сделанные им летом 1948 года в одном из самых процветающих колхозов Советской Украины — колхозе имени В.И. Ленина Чемеровецкого района Каменец-Подольской области, в котором в то время было одиннадцать героев социалистического труда. Яблонская была очарована масштабами сельскохозяйственных работ и людьми, которые там работали. Советские искусствоведы отмечали, что на картинах Яблонской изображены «молодые люди», которые могли существовать только в социалистическом государстве. Они становятся настоящими хозяевами своей жизни, по-новому воспринимая свою жизнь и деятельность. Работа была задумана и создана художником как «обобщенный образ счастливого, свободного творческого труда». По мнению французского искусствоведа Марка Дюпети, картина была программным произведением для своего времени и примером украинской реалистической живописи 20-го века.
Блок: 3/6 | Количество символов: 1297 Источник: http://ru.wikipedia.green/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Применение фтора
Фторид натрия NaF и фторид кремния Na2SiF6токсичны и использовались для борьбы с вредителями и консервации древесины.
Фтор является компонентом CCl2F2применяется в холодильной технике, используется для синтеза полимерного материала — фторопласта (тефлона), устойчивого к кислотам и щелочам.
Среди кислородных соединений фторид кислорода F2O и диоксид фтора F2O2. Фторид кислорода получают путем пропускания фтора через 2%-ный раствор натрия:
Структура молекулы фтористого кислорода F- O — O — O — F аналогична структуре молекулы пероксида водорода.
История открытия фтора Фтор или фтор? Фтор, разрушительный, — удивительно меткое название. Однако за рубежом чаще встречается другое название.
Простые эфиры Простые эфиры — это органические соединения, молекулы которых состоят из двух углеводородных радикалов, соединенных с атомом кислорода. Примером может быть.
Галогены — это элементы фтор, хлор, бром, йод и астат, которые относятся к группе VIIA, называемой галогенами, что в переводе с греческого означает «делатели соли». К ним относятся.
КАКИЕ ХИМИЧЕСКИЕ ГАЗЫ Уже в экспериментах Рамсея с открытыми им газами было предпринято много попыток получить сильные газы.
Вам понравилась эта статья, поделитесь ею








