Негативные изменения происходят в сердечно-сосудистой системе: снижается артериальное давление, возникает брадикардия (снижение частоты сердечных сокращений) из-за токсического повреждения сердечной мышцы. Поражается щитовидная железа, из которой фтор вытесняет йод, необходимый для синтеза тиреоидных гормонов.
Фтор
Почти бесцветный газ (зеленовато-желтый в толстых слоях) 1
Фтор/Флуорум (F), 9
3,98 (шкала Полинга)
(пр и-188,14 °C, г) 1,108 г/см³
a = 5,50 b = 3,28 c = 7,28 b = 90,0 Å
(300 K) 0,028 Вт/(м-K)
Фтор — элемент 17 группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), второго периода, с атомным номером 9 3. Фтор — химически очень активный неметалл и сильнейший окислитель; это самый легкий элемент группы галогенов. Простое вещество фтор (CAS номер: 7782-41-4) при нормальных условиях представляет собой двухатомный газ (формула F2) имеет бледно-желтый цвет и сильный запах, напоминающий озон или хлор.
Первое соединение фтора, флюорит (плавиковый шпат) CaF2— был описан как флюорит в конце XV века. В 1771 году Карл Шееле выделил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а в свободном виде получен только 76 лет спустя, в 1886 году, электролизом жидкого безводного фтористого водорода с примесью кислого фтористого калия KHF.2.
Происхождение названия
Название фтор (от греческого fluoros — разрушение), предложенное Андре Ампером в 1810 году, используется в русском и некоторых других языках; во многих странах название происходит от латинского fluorum (которое в свою очередь происходит от fluere — течь, от свойства соединения фтора — флюорита (CaF2) для снижения температуры плавления руды и повышения текучести расплава).
Распространение в природе
Атомная доля фтора в природе показана в таблице ниже:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Речная вода | 0,00002 |
| Морская вода | 0,0001 |
| Зубы человека 4 | 0,01 |
В природе значительные концентрации фтора встречаются в основном в минерале флюорите (CaF2), который содержит 51,2 % Ca и 48,8 % F по весу. Кларк в земной коре 650 г/т.
Чечевица и лук относительно богаты фтором.
Наличие фтора в почве обусловлено его содержанием в вулканических газах, поскольку они обычно содержат большое количество фтористого водорода.
История
Первое соединение фтора, флюорит (плавиковый шпат) CaF2— был описан как флюорит в конце XV века. В 1771 году Карл Шееле выделил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, но выделен в свободном виде лишь семьдесят шесть лет спустя Анри Муассаном в 1886 году путем электролиза жидкого безводного фтористого водорода с примесью кислого фтористого калия KHF.2.
Происхождение названия
Название «фтор» (fluoros — разрушение), предложенное Андре Ампером в 1810 году, используется в русском и некоторых других языках; во многих странах названия происходят от латинского «fluorum» (которое в свою очередь происходит от fluere — «течь», от свойства фтора соединения флюорита (CaF2) для снижения температуры плавления руды и повышения текучести расплава).
Распространение в природе
В природе значительные концентрации фтора встречаются только в минерале флюорите.
Чечевица и лук в некоторой степени богаты фтором
Появление фтора в почве связано с вулканическими газами, поскольку они обычно содержат большое количество фтористого водорода.
Изотопный состав
Фтор является моноизотопным элементом, поскольку в природе существует только один стабильный изотоп фтора — 19 F. Существует 17 других радиоактивных изотопов фтора с массовыми числами от 14 до 31 и один ядерный изомер — 18 F m. Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, который является важным источником позитронов, используемых в позитронно-эмиссионной томографии.
Ядерные свойства изотопов фтора
| изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17 F | 17,0020952 | 64,5 c | b + распад на 17 O | 5/2 | 4.722 |
| 18 F | 18,000938 | 1.83 h | бета+ распад в 18 O | 1 | |
| 19 F | 18,99840322 | Исправлено | — | 1/2 | 2.629 |
| 20 F | 19,9999813 | 11 c | b-распад при 20 Не | 2 | 2.094 |
| 21 F | 20,999949 | 4,2 c | β-распад при 21 Ne | 5/2 | |
| 22 F | 22,00300 | 4,23 c | β-распад при 22 Ne | 4 | |
| 23 F | 23,00357 | 2,2 c | β-распад при 23 Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому эти ядра можно использовать для ЯМР-исследований молекул. Спектры ЯМР 19 F достаточно характерны для фторированных соединений.
Пищевые источники
Спаржа, авокадо, брюссельская капуста, морковь, тмин, цветная капуста, огурцы, финики, лемонграсс, петрушка, свекла, одуванчик, семена подсолнечника, чеснок, шпинат, помидоры, зеленые листовые овощи, орехи (особенно миндаль), репа, морская капуста.
Кстати, интересно отметить, что фтор обладает способностью «мигрировать» в воде, что особенно полезно для настоев и чаев. Например, при заваривании черного чая около 70-90 процентов фторида из листьев переходит в жидкость. Мята оставляет около 30 процентов, роза — около 20 процентов, а ромашка — всего 5 процентов.
Таблица содержания фтора в некоторых продуктах| Продукт (200 г) | Фторид (мг) |
|---|---|
| Чай (черный, зеленый, белый) | 20 |
| Скумбрия | 3 |
| Тунец | 2 |
| Минеральная вода | 1,5 |
| Хек | 1,4 |
| Поллак | 1,4 |
| Треска | 1,4 |
| Уайтинг | 1,4 |
| Грецкие орехи | 1,3 |
| Ставрида | 1 |
| Пузырь | 0,9 |
| Групер | 0,86 |
| Скумбрия | 0,86 |
| Лосось | 0,86 |
| Форель | 0,86 |
| Раки | 0,86 |
| Морские гребешки | 0,86 |
| Устрицы | 0,86 |
| Cephalus | 0,86 |
| Баранина | 0,3 |
| Свинина | 0,3 |
| Птицеводство | 0,28 |
| Куриные яйца | 0,18 |
| Гречневая крупа | 0,1 |
| Манька | 0,1 |
| Молоко | 0,1 |
| Картофель | 0,1 |
| Лапша | 0,1 |
| Говядина | 0,032 |
| Редис | 0,012 |
| Морковь | 0,006 |
Топ-10 продуктов, необходимых для детей
О важности фтора для детей напоминать не нужно. Развивающийся организм нуждается в этом микроэлементе больше, чем в любом другом, для формирования здоровых костей и зубов, укрепления зубной эмали и профилактики стоматологических заболеваний.
Дефицит фтора, как и дефицит кальция у детей, приводит к серьезным проблемам в развитии — от искривления позвоночника до потери зрения.
Однако это не означает, что ребенка следует кормить F-добавками с самого раннего возраста. В качестве источника питательных веществ для детей следует использовать только натуральные продукты. Избыток этого минерала также не самое приятное, что может случиться с человеком. Потребление более 0,5 мг фтора на 1 кг массы тела ребенка вызывает флюороз (проявляется белыми и темными пятнами на эмали). Большая передозировка вызывает боль в костях и пятна на зубах (белые и коричневые). Те же признаки отравления фтором могут наблюдаться и у взрослых. Однако они также ассоциируются с шишками в суставах, быстрым старением костей, морщинами и склеродермией (твердые участки кожи).
Составляя список продуктов, богатых фтором, важно в первую очередь думать о воде, которая является лучшим источником этого минерала. Также важно включать в рацион детей чай, орехи, семена подсолнечника, фрукты и овощи. Особенно следует отдать предпочтение моркови, свекле, репе, чесноку, шпинату и листовым овощам.

Лучшие источники фтора для детей:
- Чай. Этот продукт можно вводить в рацион детей с относительно раннего возраста.
- Соленья. Соленый огурец, добавленный в салат, обеспечит ребенка значительной порцией фтора.
- Виноградный сок. Этот любимый многими напиток также позаботится о необходимом количестве F в детском организме. Конечно, речь идет исключительно о полезных соках, без консервантов и химических добавок.
- Шпинат. Этот, а также другие зеленые листовые овощи придадут ребенку силы и послужат источником не только фтора, но и большинства необходимых растущему организму микро-, макроэлементов элементов и витаминов.
- Томаты. Вся пища, в состав которой входят помидоры, содержит в себе фтор. Салат или томатный сок – именно то, что необходимо детям.
- Морковь. Приготовленная без соли, но с небольшим добавлением растительного масла, – питательный гарнир или салат для перекуса. Важно, что этот оранжевый овощ также является мощным источником каротина, отвечающего за остроту зрения и правильную работу внутренних органов.
- Апельсиновый сок. Трудно найти ребенка, которому бы не нравился этот кисло-сладкий витаминный напиток. Если нет пищевой аллергии на цитрусы, как минимум несколько раз в неделю можно побаловать детей фрешем из апельсина и быть уверенными, что они получили много необходимых полезных веществ, в том числе и витамин С – известный антиоксидант и защитник иммунитета.
- Спаржа. Поданная целиком, нарезанная кусочками или измельченная до состояния пюре. Неважно, в каком виде, главное, чтобы ребенок съел порцию этого полезного овоща, богатого не только фтором.
- Свекла. Борщи, салаты, соки… Готовьте из этого овоща все, что позволяет фантазия. И как можно чаще. Свекла – настоящий кладезь витаминов и минералов, жизненно важных для людей в любом возрасте.
- Чернослив. Его можно употреблять в пищу целиком, в компотах, в качестве ингредиента десертов – в любом случае он принесет пользу организму.
Другие гастрономические рекомендации

Составление меню с высоким содержанием фтора не должно быть сложным. Важно знать, в каких продуктах содержится этот металл и в какой концентрации.
Все костные бульоны и бульоны из птицы (мясо также должно быть без костей) являются не только сытным блюдом, но и высококонцентрированным источником F. Однако здесь есть оговорка. Если вы хотите быть уверены в пользе такого бульона, убедитесь, что мясо высокого качества. И если вы не можете есть домашнюю птицу, по крайней мере, покупайте продукт у проверенных производителей.
Конечно, свежеприготовленная пища — самая вкусная и полезная. Но консервы тоже не всегда вредны. Например, рыбные консервы (особенно с костями) являются одним из лучших источников F. Но даже в этом случае важно проверить качество и свежесть продукта.
Вы категорически не принимаете консервированные продукты? Нет проблем. Самостоятельно приготовленная рыба не менее вкусна. А по вкусовым качествам — во много раз лучше. Единственное правило — варить, запекать или жарить рыбу с костями. Этот продукт содержит во много раз больше фтора, чем филе того же вида. Продолжая тему морепродуктов, помните, что моллюски также оказывают благотворное влияние на кости и зубы.
Овсянка — один из продуктов, богатых микроэлементами, особенно фтором. Тем не менее, предупреждение. Лучше отдать предпочтение обычной «овсянке», чем современной каше быстрого приготовления, которая напичкана усилителями вкуса и химическими добавками «Е». Любителям проросших зерен повезло, потому что они получают лучшее из своих зерен.
Фруктовые и овощные соки относятся к продуктам, содержащим фтор. Но опять же, здоровыми можно считать только свежевыжатые фруктовые и овощные соки из качественных продуктов. Химикаты» не следует выбирать в качестве сырья для витаминного напитка. Эти соки приносят больше вреда, чем пользы. И, конечно, лучше навсегда забыть о концентратах напитков.
Изотопный состав
Фтор является моноизотопным элементом, поскольку в природе существует только один стабильный изотоп, а именно фтор 19F. Существует еще 17 радиоактивных изотопов фтора с массовыми числами от 14 до 31, а также ядерный изомер — 18Fm. Самым долгоживущим радиоактивным изотопом фтора является 18F с периодом полураспада 109,771 минуты, который является важным источником позитронов, используемых в позитронно-эмиссионной томографии.
Ядерные свойства изотопов фтора
| изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 |
| 18F | 18,000938 | 1.83 h | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Исправлено | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 c | b — распад при 20Не | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | Бета-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | Бета-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому эти ядра можно использовать для ЯМР-исследований молекул. Спектры ЯМР 19F достаточно характерны для фторированных соединений.
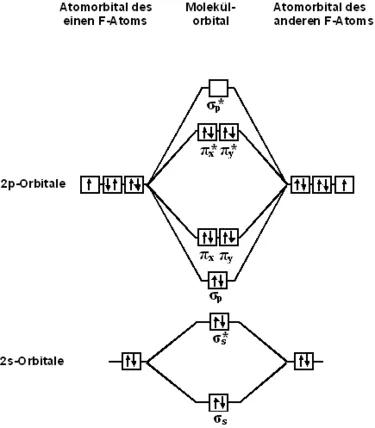
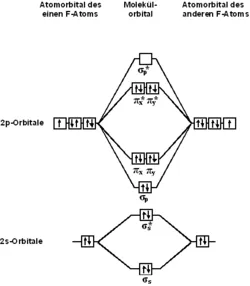
Применение метода МО к молекуле F2 Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут иметь степень окислени я-1. Положительные степени окисления невозможны в соединениях, поскольку фтор является наиболее электрически заряженным элементом.
Квантовый химический член атома фтора равен ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, структура двухатомной молекулы фтора может быть охарактеризована следующей схемой. В молекуле имеется 4 связывающие орбитали и 3 открывающие орбитали. Очевидно, что порядок связей в молекуле равен 1.
Примечания
- Фтор. Проверено 14 марта 2013. Архивировано 15 марта 2013 года.
- ↑ 1 2 Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2021. — Vol. 88, no. 3. — P. 265–291. — DOI:10.1515/pac-2015-0305.
- ↑ 1 2 3 4 5 6 7 8 9 Раков Э. Г. Фтор // Химическая энциклопедия: в 5 т / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Три—Ятр. — С. 197—199. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Таблица Менделеева на сайте ИЮПАК
- Главным образом в эмали зубов
- Ахметов Н. С. «Общая и неорганическая химия».
- Pauling L., Keaveny I., Robinson A. B. J. Solid State Chem., 1970, Vol. 2, Issue 2, p. 225—227.
- J. Chem. Phys. 49 (1968) 1902.
- Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- Гринвуд Н., Эрншо А. «Химия элементов» т. 2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147—148, 169 — химический синтез фтора
- Фтор в Популярной библиотеке химических элементов
- По данным National Toxicology Program
- Справочник потребителя
- в виде фторидов и фторорганических соединений
- Н. В. Лазарев, И. Д. Гадаскина. «Вредные вещества в промышленности». Том 3, страница 19.
Источником получения фтора является фтористый водород HF, который получают либо действием серной кислоты H2SO4 на флюорит CaF2, либо переработкой апатита и фосфата.
Лабораторный метод
Лабораторные условия — Фтор можно получить на химических заводах. Медный сосуд 1, заполненный расплавом KF-3HF, помещается в медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещается толстый никелевый анод. Катод находится в сосуде 1. Таким образом, в процессе электролиза из трубки 3 выделяется газ фтор, а из трубки 4 — водород. Важным требованием является обеспечение герметичности системы. Для этой цели используются пробки из фторида кальция, смазанные оксидом свинца (II) и глицерином.
В 1986 году, готовясь к конференции, посвященной 100-летию открытия фтора, Карл Кристе открыл метод чисто химического получения фтора путем реакции в растворе фтористого водорода K2MnF6 и SbF5 при 150 °C. Метод заключается в следующем
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 Хотя этот метод не имеет практического применения, он показывает, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплавленного фторида калия KF-3HF (часто с добавлением фторида лития), полученного путем насыщения расплава KF фтористым водородом в 40-41% HF. Процесс электролиза проводится при температуре около 100 °C на стальных электролитах со стальными катодами и углеродными анодами.
Читайте также: Киноа: как ее приготовить — 8 быстрых и простых блюд из зерна.
Фтор и его характеристики
Фтор — девятый элемент в периодической таблице элементов. Название — F от латинского «fluorum». Он относится ко второму периоду, группе VIIA. Он классифицируется как неметалл. Заряд его ядра равен 9.
Из-за своей высокой химической активности фтор встречается в природе только в связанной форме. Чаще всего он встречается в виде минерала фторида натрия CaF2Криолит Na3AlF6и фторопатит Ca5F(PO4)3.
Как простое вещество, фтор представляет собой бледно-зеленоватый газ или бледно-желтую жидкость (рис. 1). Температура плавления — (-219,6 °C), температура кипения — (-188,1 °C). Он токсичен.

Рисунок 1: Фтор. Внешний вид (жидкое состояние).
Атомная и молекулярная масса фтора
Относительная молекулярная масса (Mr) — это число, показывающее, насколько часто масса данной молекулы превышает 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) показывает, как часто средняя атомная масса химического элемента превышает 1/12 массы атома углерода.
Относительная атомная масса атомарного фтора составляет 18,9984 а.е.м. Известно, что молекула фтора является двухатомной — F2. Относительная молекулярная масса молекул фтора одинакова:
Фтор польза и вред

Фтор (лат. Fluorum, F) — микроэлемент, укрепляющий зубы и защищающий их от кариеса. Он также укрепляет кости, повышает иммунную систему и стимулирует кровообращение.
- История открытия
- Физические и химические свойства
- Физиологическое действие
- Суточная потребность
- Причины и признаки дефицита
- Источники поступления
- Синтетические аналоги
- Метаболизм
- Взаимодействие с другими веществами
История открытия
Первое соединение фтора было описано еще до открытия самого элемента. Соединение представляет собой минерал флюорит, также известный как фторид глины, фторид кальция, CaF2. Флюорит был описан еще в 16 веке немецким ученым Агриколой. В то время фторид железа использовался в металлургии.

Минерал повышает текучесть и снижает температуру металлических шлаков. Это облегчило отделение шлака от металлов в процессе плавки.
Название флюорита происходит от латинского fluo, что означает поток.
Замечательным свойством флюорита является то, что он начинает светиться при нагревании ультрафиолетовым светом. Отсюда происходит термин «флуоресценция».
В 1771 году шведский химик Шееле заставил флюорит реагировать с серной кислотой. В результате была получена плавиковая кислота — водный раствор фтористого водорода (HF).
Некоторые ошибочно полагали, что это оксид неизвестного вещества, называемого флюоритом или фтором. Позже, в 1810 году, английский химик Дэви выделил хлор путем электролиза соляной кислоты (HCl). И тогда он резонно предположил, что плавиковая кислота — это соединение водорода и фтора.
И если да, то это вещество может быть выделено аналогично хлору. Известный французский ученый Ампер, узнав о свойствах плавиковой кислоты, предложил заменить название «фтор» на «флюорин» (от греческого φθόρος — смерть, разрушение), но это долгое время не удавалось.
Причиной этого является высокая химическая активность вещества. Только в 1886 году французскому химику Муассану удалось выделить чистый F путем электролиза фтористого водорода. Поскольку его было трудно добывать и долго хранить, он не нашел практического применения. Во второй половине XX века он использовался в промышленных целях и для разделения изотопов урана для производства ядерного оружия.
В природе значительные концентрации фтора встречаются главным образом в минерале флюорите (CaF2), который содержит 51,2% Ca и 48,8% F по массе. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
Фтор накапливается в почве в результате вулканической деятельности, а вулканические газы обычно содержат большое количество плавиковой кислоты.
Получение
На первой стадии производства фтора получают фтористый водород HF. Фтористый водород и плавиковая кислота обычно производятся одновременно с переработкой фторапатита на фосфорные удобрения. Газообразный фтористый водород, образующийся при обработке фторопатита серной кислотой, собирается, сжижается и используется для электролиза. Электролиз можно проводить с жидкой смесью HF и KF (при 15-20 °C), а также с расплавом KH2F3 (при 70-120 °C) или расплавом KHF2 (при 245-310 °C). В лаборатории для получения небольшого количества свободного фтора можно использовать либо нагревание MnF4, которое извлекает фтор, либо нагревание смеси K2MnF6 и SbF5: 2K2MnF6 + 4SbF5 = 4KSbF6 + 2MnF3 + F2.
Применение фтора очень разнообразно. Ежегодное производство фтористой руды составляет около 6 миллионов тонн. Большая часть добываемого фтора используется в металлургии. Фтористые флюсы используются для плавки железа и алюминия. Например, для производства одной тонны алюминия требуется около 23 килограммов фтора. Фтор также используется в ядерной промышленности для обогащения урана методом ядерной диффузии. Другое применение — в энергетической промышленности. Около 6 тысяч тонн фтора ежегодно используется в качестве диэлектрика в высоковольтных трансформаторах. Фтор также широко используется в медицине. Около 20 % всех медицинских препаратов содержат этот химический элемент. Другой широко используемый продукт, содержащий фтор, — это охлаждающая жидкость различных видов. Это вещества, используемые в системах кондиционирования воздуха. В целом, фторсодержащие элементы имеют широкий спектр применения.
Интересные факты
Существует также много интересных фактов о фторе. Как уже упоминалось, чистый фтор является чрезвычайно токсичным элементом. Несмотря на свою токсичность, этот химический элемент оказывает положительное влияние на зубную эмаль. Благодаря этому открытию фтор стали добавлять в зубные пасты. В такой концентрации, как в зубной пасте, он безвреден для взрослого здорового человека, но для детей он может быть даже смертельным. Многие зубные пасты сегодня содержат следы фтора, который оказывает положительное влияние на зубную эмаль. У взрослого человека при проглатывании такой зубной пасты может возникнуть несварение или просто боль в желудке, но у детей, особенно в раннем возрасте, это может привести к тяжелому отравлению фтором. Проблема в том, что отравление фтором у детей иногда не распознается даже опытными врачами. Поэтому будьте осторожны при выборе зубной пасты, особенно для детей.
Еще одна интересная вещь — глобальное потепление. Ионы фтора являются одной из причин этого явления. Всем известно, что глобальное потепление почти достигло масштабов экологической катастрофы, и в последнее время оно становится все более частым явлением. Дело в том, что крупномасштабная добыча фтора и производство фторсодержащих продуктов начались только в 1980-х и 1990-х годах. Все было хорошо, пока фторсодержащие продукты не начали разрушаться. Ионы фтора начали достигать озонового слоя и реагировать с O3. Это разрушает озоновый слой настолько, что потребуется около 200 лет, чтобы он вернулся к своему первоначальному состоянию.
- https://wiki2.org/ru/%D0%A4%D1%82%D0%BE%D1%80
- http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-ftora/
- https://znaniya.guru/himiya/ftor.html
- http://ru.solverbook.com/spravochnik/ximiya/molyarnaya-massa/molyarnaya-massa-ftora/
- https://k-tree.ru/tools/chemistry/periodic.php?element=F
- https://megabook.ru/article/%D0%A4%D1%82%D0%BE%D1%80
- http://ru.solverbook.com/spravochnik/ximiya/ximicheskie-elementy/ftor-i-ego-xarakteristiki/
- https://k-tree.ru/tools/chemistry/periodic.php?element=F&oxidation=-1
- https://biobloger.ru/ftor.html








