При изучении этой темы на чистом листе классификации обычно обобщаются в виде списков или сравнительных таблиц, показывающих все сходства и различия.
Классификация дисперсных систем
Дисперсные системы — это гетерогенные смеси двух или более составляющих, между которыми существует высокоразвитая граница раздела.
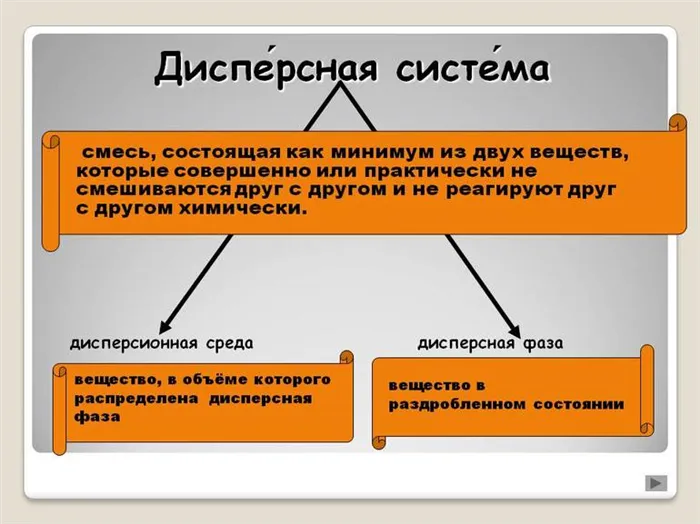
Особенностью дисперсных систем является малый размер частиц и наличие большой границы раздела. Поэтому наибольшее значение имеют свойства поверхности и процессы, происходящие на ней, а не свойства частиц в целом. Таким образом, эти системы состоят из двух или более фаз, одна из которых находится в мелко раздробленном состоянии (дисперсная фаза) в среде другой фазы (дисперсионная среда).
Классификация дисперсных систем различна:
По агрегатному состоянию дисперсной фазы и дисперсионной среды
Для простоты дисперсные системы обычно обозначают дробью, при этом числитель указывает на кумулятивное состояние дисперсной фазы, а числитель — на дисперсионную среду:
| Дисперсная фаза | Средняя дисперсия | Название подразделения | Имя |
| Газ | Газ | Г/Г | Дисперсные системы не образуются |
| Газ | Жидкость | Г/Ж | Газовые эмульсии |
| Газ | Твердые вещества | Г/Т | Пористые твердые вещества |
| Жидкость | Газ | Ж/Г | Аэрозоли |
| Жидкость | Жидкость | Ж/Ж | Молочные продукты |
| Жидкость | Твердые вещества | Ж/Т | Капиллярные системы |
| Твердые вещества | Газ | Т/Г | Пыль, порошок |
| Твердые вещества | Жидкость | Т/Ж | Взвеси и твердые вещества |
| Твердые вещества | Твердые вещества | Т/Т | Твердые тела Гетерогенные системы |
По кинетическим свойствам дисперсной фазы
— лиофильный — значительное взаимодействие частиц дисперсной фазы с молекулами дисперсионной среды. Лиофобный — слабое взаимодействие частиц дисперсной фазы с молекулами дисперсионной среды. Это коллоидные растворы металлов, их оксидов, гидроксидов и солей.
-Грубодисперсные – размер частиц>дисперсная фаза — размер частиц от 0,1 до 10 микрон; — мелкодисперсная — размер частиц от 1 до 100 нм; — наноразмерная — размер частиц от 1 до 10 нм. Предметом коллоидной химии являются высокодисперсные или коллоидные системы (10-9-10-7 м).
Коллоидные системы
Коллоидные системы — это гетерогенные системы, в которых дисперсная фаза отделена от дисперсионной среды границей раздела. Когда дисперсионная среда жидкая, а дисперсная фаза твердая, коллоидная система называется золем; когда дисперсная фаза жидкая, коллоидная система называется эмульсией. Наиболее важными коллоидными системами являются те, в которых дисперсионной средой является вода. Они делятся на гидрофильные и гидрофобные коллоиды.
Гидрофильные коллоиды напоминают реальные растворы, которые являются однородными. Гидрофобные коллоиды могут быть получены только в том случае, если они каким-либо образом стабилизированы. Гидрофобные коллоиды могут быть стабилизированы путем адсорбции ионов на их поверхности. Адсорбированные ионы стабилизируют коллоид, взаимодействуя с водой. Укрупнение и слипание частиц не происходит из-за отталкивания частиц адсорбированными на них ионами с одинаковым зарядом.
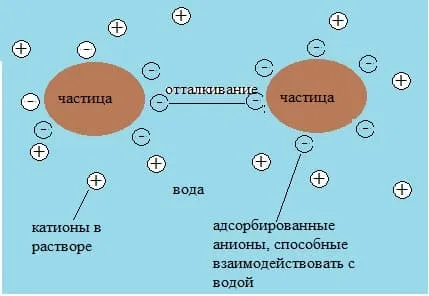
Гидрофобные коллоиды также могут быть стабилизированы в присутствии других гидрофильных групп. Масло, например, гидрофобно, и капли масла, смешиваясь с водой, отделяются от нее. Таким образом, на поверхности воды образуется нефтяное пятно. Однако такая система может быть стабилизирована путем добавления, например, стеарата натрия или других поверхностно-активных веществ (поверхностно-активных веществ):
Молекула стеарата натрия состоит из двух частей: одна часть полярная или заряженная (гидрофильная), а другая — неполярная (гидрофобная). При добавлении в масло гидрофильные концы взаимодействуют с водой, а гидрофобные — с маслом.
Дисперсная система

Чистое вещество встречается в природе довольно редко. Большинство из них не являются однородными, а состоят из смеси различных атомов и молекул. Эта статья рассказывает о том, как вещества могут быть диспергированы в другом веществе без смешивания, и дает определение этого явления.
Что это такое дисперсная система?
Дисперсная система — это гетерогенная структура, в которой мелкие частицы одного вещества равномерно распределены в другом веществе, не смешиваясь и не вступая в химический контакт. Компонент, занимающий наибольший объем, называется «средой». Компонент, занимающий наименьший объем, называется «дисперсной фазой». Частицы фазы и среды имеют границу раздела между собой. Именно по этой причине рассредоточенные системы являются гетерогенными, т.е. неоднородными.

Дисперсные частицы определяются как частицы с размером от 1 нм до 10 мкм.
Дисперсные системы (фазы и дисперсные частицы) могут находиться в любом агрегатном состоянии: жидком, твердом или газообразном. Мир вокруг нас состоит из множества разрозненных систем. Примерами являются почва, морская вода, продукты питания и многие другие.
В дисперсной системе может быть более двух фаз. В этом случае их отделяют друг от друга путем сепарации или центрифугирования.

Классификация дисперсных систем
Как известно, дисперсные системы могут находиться в трех общих состояниях. Комбинации этих состояний позволяют выделить 9 типов двухфазных дисперсных систем (3 агрегатных состояния фаз и 3 агрегатных состояния среды). Давайте посмотрим на таблицу «Распределенная система»:
| Типы дисперсных систем | Дисперсная фаза | Средняя дисперсия | Название и пример |
| Газ на газ | Газы | Газы | не образуются дисперсные системы |
| жидкость — газ | жидкость | Газы | аэрозоли: Туман, облака |
| Твердое тело в газ | твердый | Газы | Аэрозоли: пыль, дым |
| Из газа в жидкость | Газы | жидкость | Газовые эмульсии, пены |
| Жидкость к жидкости | жидкость | жидкость | эмульсии: масло, молоко |
| твердое вещество в жидкость | твердый | жидкость | Суспензии, твердые вещества: осадок, жидкий навоз |
| газ в твёрдое вещество | Газы | твердый | пористые тела: пемза |
| твёрдая жидкость | жидкость | твердый | капиллярные системы: почва, земля |
| твердое в твердом | твердый | твердый | сплавы, бетон, композиты. |
В зависимости от наличия или отсутствия взаимодействия между частицами в дисперсной фазе можно выделить два типа дисперсных систем:

- свободнодисперсные системы. Сюда относятся коллоидные растворы, суспензии, взвеси, разнообразные растворы, для которых характерна текучесть.
- связнодисперсные системы. Сюда относятся структурированные системы, которые имеют свойства полутвердого тела. Например, если у золей некоторых веществ понизить температуру или увеличить концентрацию, то они утратят свою текучесть. Также в эту группу относятся концентрированные пасты, аморфные осадки.
Х и м и я

В предыдущем разделе мы говорили о решениях, и здесь мы кратко напомним это понятие.
Растворы — это гомогенные (подобные) системы, состоящие из двух или более компонентов.
Гомогенная система — однородная система, химический состав и физические свойства которой одинаковы или постоянно изменяются во всех частях, без скачков (отсутствуют интерфейсы между частями системы).
Такое определение решения не совсем корректно. Скорее, это относится к реальным решениям.
Однако существуют также коллоидные растворы, которые являются не гомогенными, а гетерогенными, т.е. растворы, состоящие из различных фаз, разделенных границами раздела.
Для достижения более единообразного определения также используется термин «распределенные системы».
Прежде чем приступить к рассмотрению дисперсных систем, мы кратко опишем историю их изучения и происхождение термина «коллоидные растворы».
История
Еще в 1845 году химик Франческо Сельми, изучая свойства различных растворов, заметил, что биологические жидкости — сыворотка и плазма крови, лимфа и другие — сильно отличаются по своим свойствам от обычных реальных растворов, поэтому он назвал эти жидкости псевдорастворами.
Коллоиды и кристаллоиды
Дальнейшие исследования в этом направлении, проводившиеся с 1861 года английским ученым Томасом Грэхемом, показали, что некоторые вещества, которые быстро диффундируют и проходят через растительные и животные мембраны, легко кристаллизуются, а другие имеют низкую диффузионную способность, не проходят через мембраны и не кристаллизуются, а образуют аморфные осадки.
Первые Грэхем назвал кристаллоидами, а вторые — коллоидами (от греч. kolla — клей и eidos — вид) или клеящими веществами.
В частности, было установлено, что вещества, способные образовывать аморфные осадки, такие как альбумин, желатин, камедь арабика, гидроксиды железа и алюминия и некоторые другие вещества, медленно диффундируют в воде по сравнению со скоростью диффузии кристаллических веществ, таких как поваренная соль, сульфат магния, тростниковый сахар и др.
В следующей таблице приведены коэффициенты диффузии D для некоторых кристаллоидов и коллоидов при температуре 18 °C.
Кристаллоиды
Молекулярная масса
D-10 7 см 2 /сек.
Коллоиды
Молекулярная масса
D-10 7 см 2 /сек.
Из таблицы видно, что существует обратная зависимость между молекулярным весом и коэффициентом диффузии.
Кроме того, кристаллоиды могут не только быстро диффундировать, но и растворяться, т.е. проходить через мембраны, в отличие от коллоидов, которые имеют большие молекулы и поэтому диффундируют медленно и не проходят через мембраны.
В качестве мембран используются стенки бычьего мочевого пузыря, целлофан, мембраны из железо-синей меди и т.д.
Основываясь на своих наблюдениях, Грэм заявил, что все вещества можно разделить на кристаллические и коллоидные.
Русские с этим не согласились.
Профессор Киевского университета И. Г. Борщев (1869) не был согласен с таким строгим делением химических веществ. Позднее мнение Борщева было подтверждено исследованиями другого российского ученого, Веймарна, который доказал, что одно и то же вещество может обладать коллоидными или кристаллическими свойствами в зависимости от условий.








