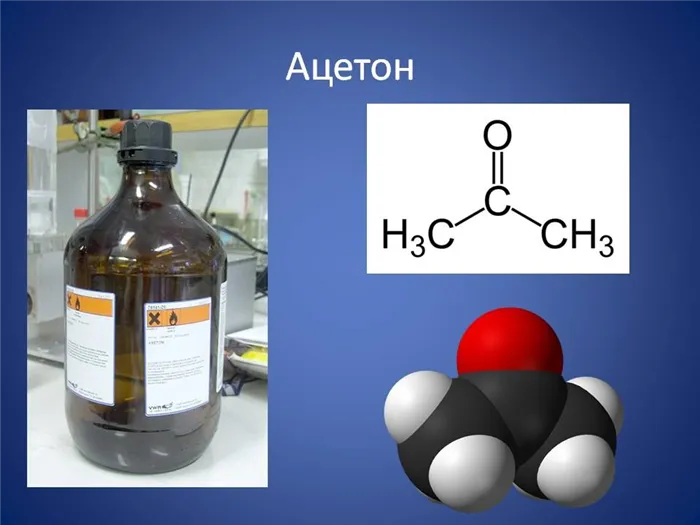
Ацетон — это бесцветная жидкость, используемая в качестве растворителя и являющаяся одним из основных веществ в органической химии. Его характерной структурной особенностью является карбонильная группа, которая соединена с двумя метильными группами.
Ацетон
Ацетон (диметилкетон, систематическое название: пропан-2-он) является простейшим представителем кетонов. Тип: CH3-C(O)-CH3. Это бесцветная, летучая жидкость с характерным запахом. Он полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, воск, резину и т.д.) и некоторые соли (хлорид кальция, йодид калия). Это один из метаболитов, вырабатываемых человеческим организмом.
- 1 Получение
- 1.1 В промышленности
- 4.1 Лабораторное применение
- 5.1 Пожароопасность =
- 5.2 Токсичность
- 5.3 Экология
Получение
Мировое производство ацетона составляет более 6,9 млн тонн в год (по состоянию на 2012 год1 ) и неуклонно растет. 1
В промышленности
В промышленности его получают прямо или косвенно из пропена.
Большая часть ацетона получается в качестве побочного продукта из бензола в процессе производства кумола на следующих трех этапах: 2
Прямое окисление пропена в жидкой фазе в присутствии PdCl2в растворах солей Pd, Cu и Fe при температуре 50-120 °C и давлении 50-100 атм:
Определенное значение имеет метод ферментации крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола 3. Метод характеризуется низким выходом. Также используются процессы производства изопропилового спирта и ацетилена.
Химические свойства
Ацетон — один из самых активных кетонов. Например, это один из немногих кетонов, образующих дисульфитное соединение.
Он преобразуется в диацетоновый спирт путем щелочной автоконденсации.
При пиролизе (700 °C) образует кетен.
Он легко связывает цианоген с образованием цианогидрина ацетона.
Атомы водорода в ацетоне могут быть легко заменены галогенами. Под воздействием хлора (йода) в присутствии щелочей образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, может быть изомеризован в щелочной среде в пропаналь, а тот — в пропеновый спирт. В кислой среде и в присутствии ионов двухвалентной ртути пропеновый спирт немедленно изомеризуется в ацетон. Между этими веществами всегда существует таутомерное равновесие:

Особенности производства ацетона
Ацетон можно получить различными способами:
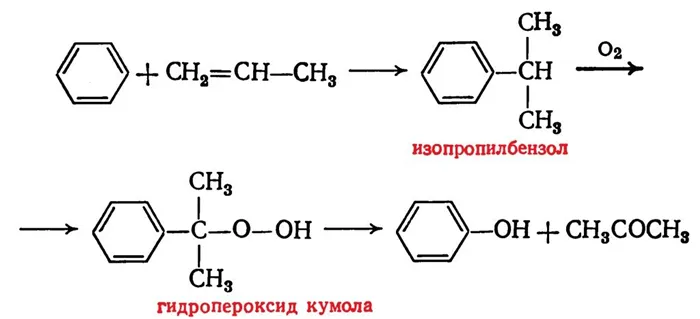
- Кумольный способ – сначала выполняется алкирование бензола пропеном с образованием кумола, затем проводится окисление кумола воздухом с образованием гидропероксида, распадающегося при добавлении серной кислоты на фенол и ацетон;
- Из изопропанола – базовый состав, в виде пара, окисляется в условиях от +450 до +650 °C на катализаторе, где появляется ацетон;
- Из пропена – жидкая основа окисляется с добавлением PdCl2и растворов солей Pd, Cu, Fe в условиях от +50 до 120 °C и при давлении 50-100 атм.Ацетон получают в виде ацетона при температуре 50-50°C и 50-50°C..
Химические свойства
Химические свойства ацетона следующие:
- Может восстанавливаться, присоединяя водород;
- Образует диацетоновый спирт при альдольной самоконденсации в щелочной среде;
- Образует пинакон при восстановлении цинком;
- При реакции с гидросульфитом натрия ацетон способен формировать бисульфитное соединение;
- Преобразуется в кетен и метан при пиролизе в условиях от 500°C;
- Взаимодействует с циановодородом, образуя ацетонциангидрин;
- Превращается в хлороформ (йодоформ) при воздействии хлора (йода) в щелочной среде;
- Образует ацетонциангидрин при реакции с синильной кислотой.
Применение ацетона
Использование ацетона в промышленности важно для производства различных химических веществ, таких как уксусный ангидрид, диацетоновый спирт, метилметакрилат и т.д. Сырье широко используется для производства поликарбоната, полиуретана, эпоксидных смол и для других целей.
Растворяющие свойства технического ацетона позволяют использовать его в производстве красок, метилметакрилата и бисфенола А, в фармакологии, в производстве стекловолокна и искусственных волокон (для обезжиривания поверхностей), в производстве составов для очистки различных поверхностей и во многих других областях. Он также используется для хранения ацетилена в баллонах.
В лабораториях он используется в реакциях алкилирования и окисления спиртов. В сочетании с сухим льдом и жидким аммиаком он используется для изготовления охлаждающих ванн. Вещество хорошо растворяется в воде, поэтому его активно используют для мытья химической посуды.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов
Ацетон, как и все кетоны, не приводит ни к реакции «серебряного уровня», ни к полимеризации. В этом заключается отличие от альдегидов.
1. гидрогенизация (восстановление)
В тех же условиях, что и формальдегид, ацетон связывает водород:
Водород добавляется путем разрыва двойной связи карбонильной группы.
2. взаимодействие с сероводородом натрия
Ацетон — один из немногих кетонов, образующих дисульфидные соединения:

3. альдольная конденсация
Под действием щелочей ацетон подвергается альдольной самоконденсации, давая спирт «ацетон» (диацетон):

4. взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение пруссиковой кислоты к цианогидрину ацетона:

5. пиролиз ацетона
При нагревании выше 500 0 C ацетон разлагается на кетен и метан:

6. Реакция галогеноформа (йодоформная реакция или тест Люголя).
Качественная реакция на ацетон!
В результате реакции ацетона с избытком йода в щелочной среде образуется йодоформ — желтое вещество с характерным запахом:

Аналогичные реакции происходят с хлором и бромом, но только реакция с йодом приводит к образованию нерастворимого йодоформа.
7. взаимодействие с нитропруссидом натрия.
Качественная реакция на ацетон!
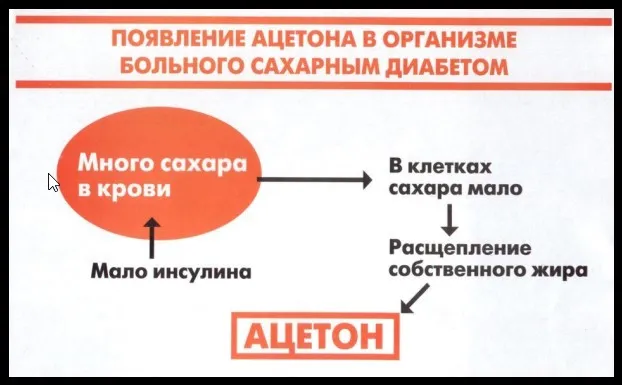
Ацетон с нитропруссидом натрия в щелочной среде дает ярко-красный цвет. При подкислении уксусной кислотой CH3COOH цвет меняется на фиолетово-красный:

Реакция с йодоформом и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче диабетиков.
Получение
Ацетон получают в больших количествах различными процессами: сухой перегонкой древесины, разложением ацетата кальция, окислением пропена, кумольным методом, окислением изопропилового спирта, гидратацией ацетилена с водяным паром.
1.кумольный процесс
Этот метод производства фенола основан на окислении кумена (изопропилбензола). В качестве исходных продуктов используются бензол и пропилен.
Процесс осуществляется в три этапа. На первой стадии бензол алкилируется пропиленом для получения кумена, а на второй и третьей стадиях (реакция Удриса-Сергеева) полученный кумен окисляется кислородом до гидропероксида, который разлагается под действием серной кислоты на фенол и ацетон:
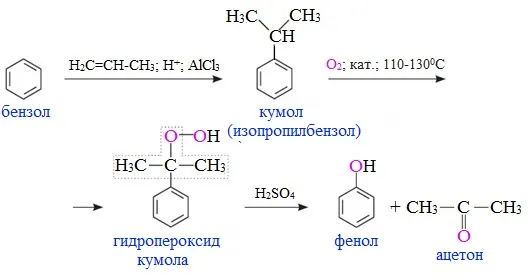
Окисление кумена является экономически эффективным методом, так как вместе с фенолом позволяет извлечь другой важный продукт — ацетон (1 кг фенола эквивалентен 0,6 кг ацетона). Сегодня этот метод является наиболее широко используемым в промышленности и позволяет производить более 80% синтетического фенола.
2 Окисление изопропилового спирта
Ацетон получается в больших количествах при окислении изопропилового спирта:

В качестве катализаторов используются медь, серебро, никель, платина и т.д. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-650 0 С. Затем катализатор используют для процесса окисления.
Если процесс окисления происходит в жидкой фазе, в качестве побочного продукта образуется перекись водорода:

3. каталитическое окисление пропена атмосферным кислородом.
В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2и CuCl2при 100 0 C:

4. ферментация крахмала
Меньшее значение имеет метод ферментации крахмала бактериями до ацетона и бутанола. Метод характеризуется низким выходом.
5. пиролиз ацетата кальция
Ацетон может быть получен пиролизом ацетата кальция:
6. гидратация ацетилена с водяным паром
Реакция протекает при температуре 400-460 0С на катализаторе, содержащем оксиды железа и марганца:
Применение
В качестве растворителя ацетон используется в производстве красок, лаков и масел, резины, пластмасс, красителей, взрывчатых веществ и в фотографии.
Ацетон используется в производстве искусственного шелка и искусственной кожи, в производстве смазочных масел, бездымных порохов и пленок.
В химической промышленности ацетон является промежуточным продуктом для производства многих химических веществ, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ и витамин С.
Метилметакрилат в основном используется в виде пластиковых листов, формовочных смесей и формовочных порошков, поверхностных покрытий, эмульсионных полимеров, волокон, печатных красок и пленок.
Метилметакрилат также используется в производстве материалов, известных как плексиглас или люцит. Они используются в зубных протезах, жестких контактных линзах и клеях.
Метилметакрилат является мономером для синтеза полиметилметакрилата («органическое сырье»).
Теги: альдегиды и кетоны
В быту
Пятновыводитель, который стоит дешевле пятновыводителя, можно использовать для очистки пятен краски на коврах, ковровых покрытиях, одежде, силиконе, засохшем клее и воске. Вместо дорогих растворителей ацетон используется для обезжиривания металлических поверхностей, керамики перед покраской, бетона и дерева перед покраской. Чтобы удалить царапины на плитке и ламинате, смочите бумажное полотенце и аккуратно протрите. Чтобы удалить пятна от кофе или чая, налейте 2 чайные ложки растворителя в чашку и протрите губкой.
Владельцы автомобилей помещают пропанон в бензобак для улучшения работы двигателя. Ацетон используется для оттирания нагара на свечах зажигания и поверхностях форсунок, а также для удаления конденсата. Поскольку этот продукт имеет высокую концентрацию кислорода, он улучшает сгорание топлива и снижает расход бензина.








