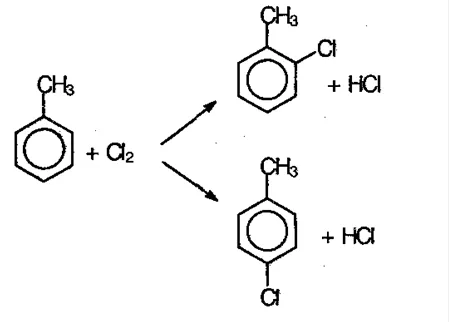
При обработке бензола концентрированной азотной кислотой в присутствии серной кислоты (катализатора) атом водорода замещается нитрогруппо й-NO2. Происходит реакция нитрификации, в результате которой образуется органическое вещество нитробензол и вода:
Формула и строение бензола
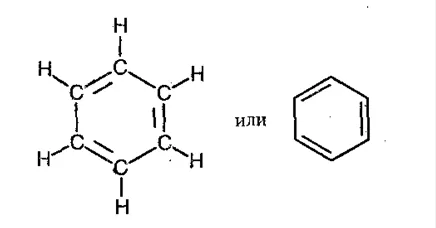
Бензол — простейший ароматический углеводород с формулой C6H6. В 1865 году немецкий химик Фридрих Кекуле предложил структурную формулу бензола в виде шестиугольника с черточками внутри.
Согласно формуле, бензол имеет кратные связи. Наличие двойных связей указывает на возможность присоединять атомы других веществ к местам их разрыва, то есть вступать в реакции присоединения. Однако для бензола и других аренов характерны реакции замещения водорода.
Чтобы понять, почему это так, следует более подробно рассмотреть структуру молекулы бензола.
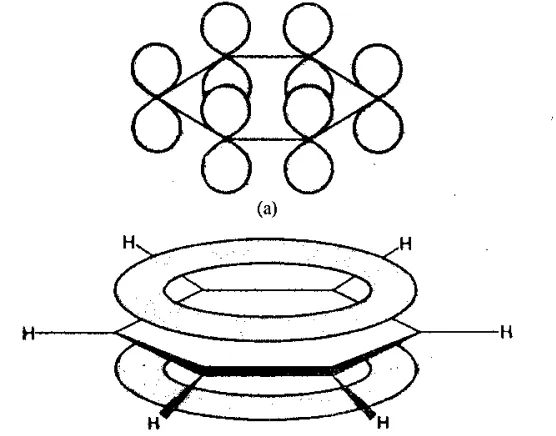
Атомы углерода находятся в состоянии sp 2-гибридизации. Это означает, что в атоме углерода одна s-орбиталь и две p-орбитали связаны (гибридизированы). Все орбитали лежат в одной плоскости и соединены с соседними атомами углерода σ-связями (концы p-орбиталей перекрываются), образуя условный шестиугольник. Вторая σ-связь образуется с помощью атомов водорода.
Перпендикулярно плоскости, содержащей гибридизированные орбитали атомов углерода, связанных с атомами водорода, расположены третьи негибридизированные p-орбитали. Концы p-орбиталей всех атомов углерода в шестиугольнике взаимодействуют друг с другом: электроны p-орбиталей принадлежат одновременно всем атомам углерода в бензольном кольце. Такая сильная связь называется связанной ароматической p-системой или облаком p-электронов.
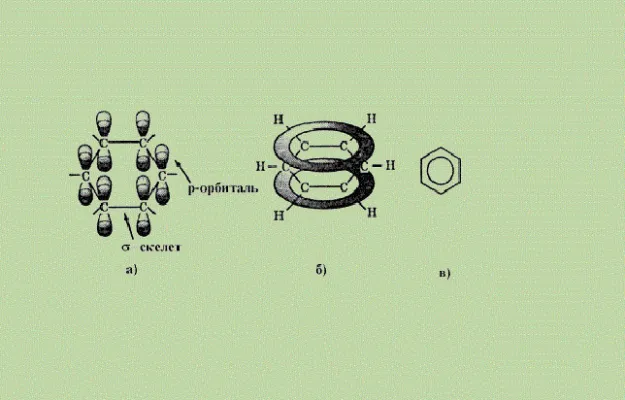
Оказалось, что ароматические углеводороды не имеют двойных связей, поэтому реакция сложения невозможна.
Более правильная формула была предложена Лайнусом Полингом. В нем вместо внутренних черточек я рисую круг, обозначающий соотношение атомов углерода друг к другу.

Гомологи и изомерия
Бензол образует гомологический ряд. Помимо бензольного кольца, гомологи бензола также содержат односвязные углеводородные радикалы:
Гомологи бензола характеризуются двумя типами изомерии:
- по строению радикала;
- по положению заместителей в бензольном кольце.
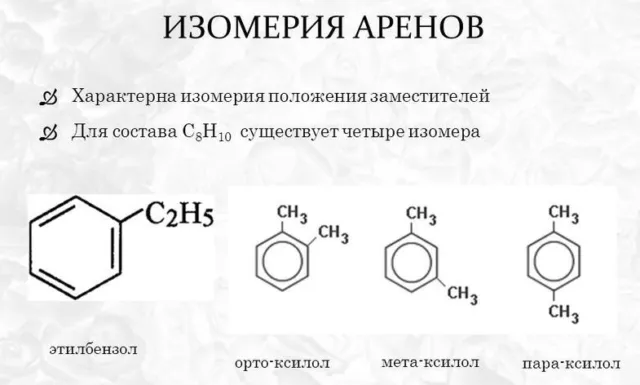
При изменении структуры углеводородного радикала метильные группы могут «смещаться» или присоединяться к другим атомам углерода в цепи. Чем сложнее радикал, тем больше изомеров имеет вещество. Пропилбензол, например, содержит радикал с тремя атомами углерода. Он образует один изомер — изопропилбензол или кумен. Бутилбензол образует три изомера.
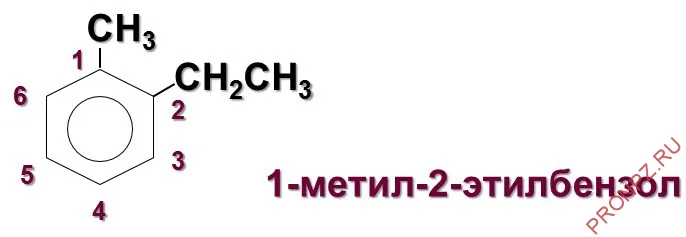
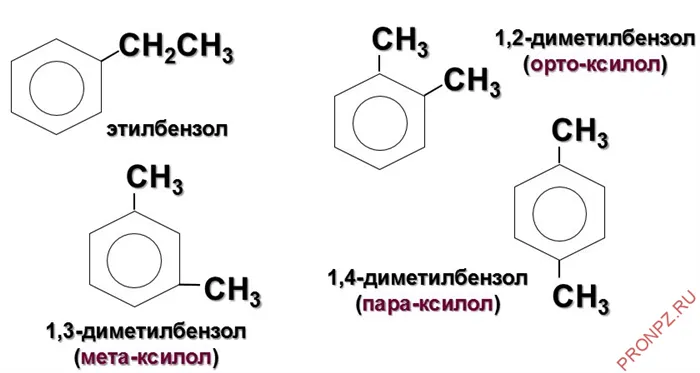
При изменении положения метильной группы указываются номера атомов углерода, к которым присоединен радикал. Группы перечислены от самой низкой до самой высокой связи. Например, 1-метил-2-этилбензол, 1,2,4-триметилбензол.
Если соединение содержит две метильные группы, используются три префикса для обозначения положения радикалов между двумя группами:
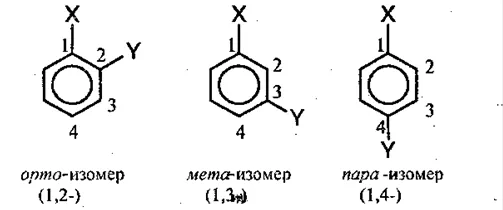
- орто- (о-) – находятся у соседних атомов;
- мета- (м-) – разделяются одним атомом углерода;
- пара- (п-) – расположены друг напротив друга.
Например, название мета-диметилбензол означает, что две метильные группы в бензольном кольце находятся на расстоянии одного атома углерода друг от друга.
Радикалы, содержащие двойные связи, могут быть присоединены к бензольному кольцу. Некоторые соединения имеют перекрывающиеся кольца. В этих случаях соединения относятся к аренам, но не являются гомологами бензола, поскольку не обладают сходными свойствами.
Строение
Основное название ароматического углеводорода с небольшим заместителем — бензол. Атомы в ароматическом кольце нумеруются от самого старого заместителя к самому молодому по кратчайшему пути.
Структура аренов представлена бензолом и его гомологами — продуктами замещения одного или нескольких атомов водорода в молекуле бензола углеводородными радикалами.
Гомологи — это вещества, которые принадлежат к одному классу соединений, имеют сходные химические свойства и отличаются одной или несколькими группами CH2.
Существуют также соединения, молекулы которых содержат много циклических структур:
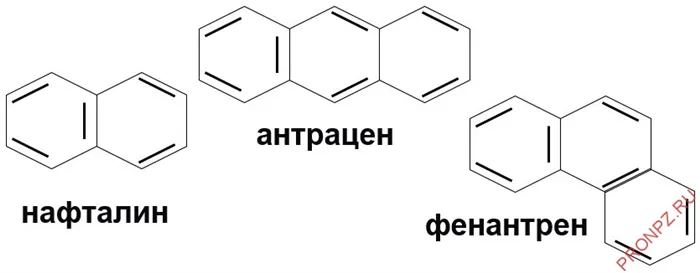
Изомеры
Гомологи бензола характеризуются изомерией в положении различных заместителей.
Свойства
Физические
Характерные свойства включают:
- высокую плотность (880 – 900 кг/м 3 ),
- большой показатель преломления (1,5 – 1,55)
- минимальное соотношение Н:С (5 – 8 %), т.е. низкие энергетические свойства.
Кстати, прочитайте также эту статью: Типы газоанализаторов и принцип их работы
Физические свойства ароматических углеводородов в значительной степени зависят от числа, положения и молекулярной массы боковых заместителей и количества циклов. Это заметное различие в их свойствах часто используется для разделения этих углеводородов физическими методами.
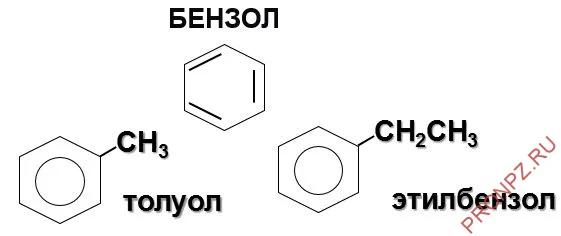
Бензол и его более простые гомологи являются токсичными жидкостями с характерным запахом при нормальных условиях. Они мало растворимы в воде, но легко растворяются в органических растворителях.
Первые представители ряда гомологов бензола (например, толуол, этилбензол и т.д.) представляют собой бесцветные жидкости с характерным запахом. Бензол и его гомологи являются хорошими растворителями для многих органических веществ.
Все арены горят коптящим пламенем из-за высокого содержания углерода в их молекулах.
Химические
Арены в основном характеризуются реакциями электрофильного замещения -.
- галогенирование,
- нитрование,
- сульфирование,
- алкилирование (получение хлорбензола, нитробензола, этилбензола др. соединений).
При высоком парциальном давлении водорода в присутствии катализаторов арены насыщаются, образуя нафтены.



Получение
Ароматические углеводороды из нефти (содержащиеся в природной нефти и получаемые во вторичных процессах термокаталитической переработки нефтяных фракций) являются основным сырьем для целого ряда нефтехимических производств, выпускающих ценные продукты.
Общее мировое производство аренов составляет 29 миллионов тонн в год. (2005), 87-92 % получают из нефти.


Строение молекулы бензола
Бензол является первым членом гомологического ряда ароматических углеводородов и был открыт Майклом Фарадеем в 1825 году. Его молекулярная формула — C6Н6означает, что в его основе лежат двойные связи. Поэтому предполагалось, что бензол характеризуется своей ненасыщенностью. В 1865 году Фридрих Кекуле предложил структурную формулу бензола.
Однако эксперименты показали, что бензол участвует в реакциях присоединения только в жестких условиях и устойчив к реакциям окисления. Замещение здесь наиболее типично, что доказывает, что оно является одним из лимитирующих соединений.
Парадоксальная электронная структура была продемонстрирована при получении бензола из ацетилена. Его особенность в том, что все атомы кольца эквивалентны и имеют характер одно- и многократных связей. Это может быть представлено формулой с равномерным распределением электронной плотности.
Атомы углерода в кольце имеют по четыре валентных электрона и характеризуются sp 2-гибридизацией. Атомы расположены в плоскости. Особенностью структуры бензола является то, что электроны образуют единую π-систему и все связи эквивалентны. Это означает, что формула Кекуле неточна, поскольку она отражает наличие двойных связей. Бензольное кольцо представляет собой циклически связанную систему с перекрывающимися связями.

Пространственная структура бензола Источник
Изомерия и номенклатура аренов
Бензол и его гомологи характеризуются только структурной изомерией, к которой они относятся:
- изомерию углеродного скелета боковой цепи,
- изомерию положения заместителей в кольце.

Источник
Основная цепь в названии арена — это ароматическое кольцо, от которого исходят заместители. В следующем члене гомологического ряда, ксилоле (диметилбензоле), важно положение заместителей в кольце. Для их различения используются различные префиксы:
- орто- (о-) – заместители находятся у соседних углеродных атомов в кольце,
- мета- (м-) – заместители находятся через один атом,
- пара- (п-) – заместители находятся через два атома.
Методы получения аренов
В промышленности бензол и его гомологи могут производиться различными способами.
- Из каменноугольной смолы.
- Дегидрирование и циклизация алканов при катализаторе и под действием высоких температур.
- Дегидрирование циклоалканов при катализаторе и под действием высоких температур
В лаборатории моноциклические соединения также получают различными способами.
- Циклотримеризация ацетилена и его гомологов при катализаторе и под действием высоких температур (реакция получения бензола)
- Реакция Вюрца-Фиттига – взаимодействие галогеналканов и арилгалогенидов с металлическим натрием
- Алкилирование галогеналканами, алкенами и спиртами в присутствии кислот Льюиса
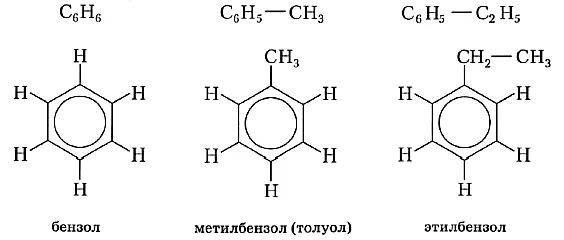
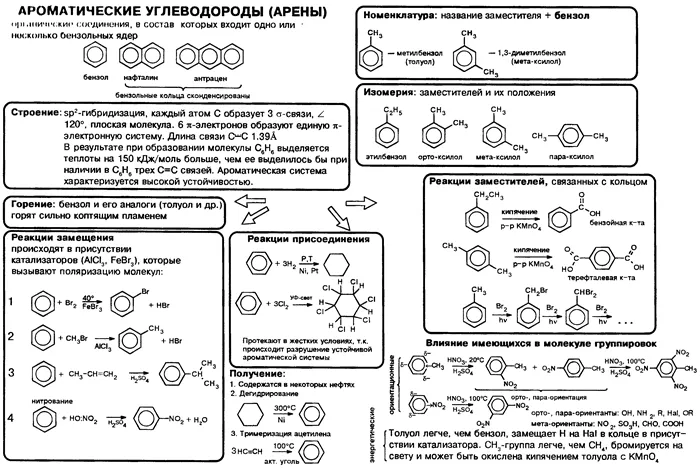
Таблица «Ароматические углеводороды (арены)»
Конспект урока химии «Ароматические углеводороды (Арены)». Для учебных целей взяты выдержки из книги «Химия. 10 класс : учебник для общеобразовательных школ : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — M. : Просвещение. Выберите другие меры:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии








