Этот процесс происходит, когда жидкие или газообразные частицы задерживаются на поверхности твердых тел. Если твердые частицы пористые, адсорбционная способность еще больше увеличивается.
Адсорбция также может быть нежелательным свойством, так как соединение может полностью адсорбироваться на стенках сосуда при низких концентрациях, так что при высоких разведениях следы аналита не могут быть обнаружены. Поэтому для получения точных результатов аналитики используют инертные материалы, такие как политетрафторэтилен (PTFE) (известный под различными торговыми названиями, такими как «Teflon»), если это возможно, или они предварительно обрабатывают контейнеры, например, силицируя стекло. (инактивация кремния диметилдихлорсиланом).
Процесс разделения
Физическое поглощение твердых веществ используется для разделения и очистки газов, а также для отделения растворителей от жидкостей. Для газов адсорбционное разделение представляет собой циклический процесс, в котором адсорбция газа на твердом теле или жидкости при определенном давлении и температуре чередуется с последующей десорбцией. В зависимости от процесса адсорбции процесс разделения может быть различным:
- Адсорбция при переменном давлении (PSA): десорбция происходит при более низком давлении;
- Адсорбционно-модулированная температура (ATM) (адсорбция с колебанием температуры, TSA, на английском языке): десорбция происходит при более высокой температуре.
- адсорбция в жидкой фазе с последующим элюированием путем изменения pH и / или ионной силы
- адсорбция в жидкой фазе на активированном угле с последующей регенерацией в печи (например, обесцвечивание глюкозных сиропов)
Другие приложения
Другими практическими применениями адсорбции являются:
- гетерогенный катализ : адсорбция явление является первым шагом реакции, требующие использование катализатора твердого вещества. Это явление может затем играть главную роль в кинетике в химической реакции ;
- адсорбционной хроматографии ;
- измерение удельной поверхности пористых твердых тел и порошков;
- стабилизация коллоидов ;
- членство ;
- аккумулирование тепла (за счет адсорбции цеолитами).
Примечания и ссылки
↑ ^ и (ru) F. Rouqueroll, J. Rouqueroll, KSW Sing et al, Adsorption of powders and porous solids: principles, methodology and applications, Academic Press, 2nd edition, 2014.
↑ ^ и L. M. Sun, F. Meunier, N. Brodu, and M. H. Manero, «Адсорбция — теоретические аспекты», Технические методы, J2730 V2, 2016.
P. Ле Клоар, «Адсорбция в очистке воздуха», Технические методы, G1770 V1, 2003.
↑ ^ и (en) J. Ruckerall, D. Avnir, C. W. Fairbridge, D. H. Everett, et al, «Рекомендации по определению характеристик пористых твердых тел», Чистая и прикладная химия, том 66, № 8, 1994, стр. 1739-1758.
(en) Kaiser, Heinrich, On condensation of lanes on surfaces in their dependence on pressure and temperature, Annalen der Physik und Chemie, τόμος 248, számú 4, 1881, σσ. 526-537. doi: 10.1002/ andp.18812480404 .
CW Scheele «Chemische Adhandlung von der luft und dem feuer» (1777).
Химические анналы том 2 Т. Ловиц Крель, страница 36 (1788)
Н.Т. Соссюр «Наблюдения над поглощением газов различными телами» Анналы физики Гилберта, т. 47, с. 113-183
↑ и Z. А. Домбровски «Адсорбция — от теории к практике» Advances in Colloid and Interface Science, vol. 93, pp. 135-224 (2001).
↑ ^ и С. Брунауэр, П. Х. Эмметт, Е.
Теллер «Адсорбция газов в мультимолекулярных пленках», Журнал Американского химического общества, том 60(2), страницы 309-319 (1938).
NR Laine, FJ Vastola, PL Walker «Важность активной площади поверхности в реакции углерода и кислорода» Журнал физической химии, том 67, страницы 2030-2034 (1963).
J. Crini, «Нетрадиционные недорогие адсорбенты для удаления красителей — обзор» BioresourceTechnology, vol. 97(9), pages 1061-1085
Подкошельни, З. Хубицки, М. Барчак, «Адсорбция фенольных соединений активированным углем — критический обзор», Химмосфера, том 58, страницы 1049-1070
С. Brunauer, L.S. Deming, W.S. Deming, and E. Теллер «О ван-дер-ваальсовой теории адсорбции газов» Журнал Американского химического общества, том 62, стр. 1723-1732 (1940).
CH Giles, D. Smith, and A. Huitson, «Общая обработка и классификация изотерм адсорбции растворенных веществ. I. Теория» Журнал коллоидной и межфазной науки, том 47 (3), стр. 755-765 (1974).
CH Giles, TH MacEwan, SN Nakhwa, D. Smith «Адсорбционные исследования. Часть XI: Система классификации изотерм адсорбции растворов и ее использование для диагностики механизмов адсорбции и измерения удельной поверхности твердых тел» Журнал химического общества, страницы 3973-3993 (1960).
K. Салех, П. Гигон «Характеристика и анализ порошков — физические свойства разделенных твердых веществ» Инженерные технологии J2251 V1 (2009)
L.-M. Sun, F. Meunier, N. Brodoux, M.-H. Manero «Adsorption — Theoretical Aspects» Engineering Techniques, J2730 V2 (2016).
J. Pikunic, C. Clinard, N. Cohaut, KE Gubbins, et al. «Structural modeling of porous carbon: an inverse Monte Carlo method with constraints» Langmuir, vol. 19, pages 8565-8582.
Х. Friendly «Capillary chemistry, an exposition of the chemistry of colloids and related fields» Academic Publishing Company (1909).
И. Ленгмюр, «Адсорбция газов на плоских поверхностях стекла, слюды и платины» Журнал Американского химического общества, том 40 (9), страницы 1361-1403 (1918).
R. Сайпс, «О структуре поверхности катализатора» Журнал химической физики, том 16 (5), страницы 490-495 (1948).
Измерение изотерм адсорбции
Существует множество методов определения характеристических кривых адсорбции:
- в состоянии равновесия необходимо измерять два параметра: количество адсорбированного материала и концентрацию или парциальное давление адсорбата;
- он должен находиться в равновесии, что может потребовать значительного количества времени: несколько часов в газовой фазе и несколько дней в жидкой фазе. Это часто связано с небольшим размером пор адсорбентов, что приводит к очень значительному снижению скорости диффузии молекул адсорбата к поверхности твердого тела;
- во время измерений необходимо точно контролировать температуру.
Методы различаются в зависимости от того, изучается ли адсорбция в газовой фазе или в растворе.
Изотермы адсорбции N2при 77 К для двух активированных углей. Изотерма красного цвета относится к типу 1 (микропористый углерод), а изотерма зеленого цвета — к типу 4 (микропористый и мезопористый углерод). На диаграмме в логарифмическом масштабе показана площадь адсорбции на микропорах, а в линейном масштабе — площадь адсорбции на мезопорах.
Манометрия
Этот метод используется для газовой фазы. Первым шагом является очистка образца путем удаления всего, что может адсорбироваться на его поверхности. Этот этап, известный как дегазация, выполняется путем помещения образца в высокий вакуум (10-6 мм рт. ст.), при необходимости слегка нагревая образец. Фактическое измерение выполняется следующим образом:
- объемная проба помещается в вакуумную объемную ячейку, а другой объем заполняется под давлением адсорбата;Vепротивчас>V>V1>п1>
- клапан между двумя ячейками открывается, и давлению позволяют уравновеситься, если нет адсорбции, конечное давление будет, если есть адсорбция, давление будет и количество адсорбированного материала пропорционально разнице наблюдаемых давлений;пВзнак равноп1(V1+V-Vепротивчас) = P_ / (V_ + V_ -V_ )>пВ>
- чтобы сделать следующую точку, мы снова начинаем с более высокого давления .п1>
Преимущество этого метода заключается в том, что он позволяет рассчитать два необходимых значения при одном измерении давления. Его также можно легко автоматизировать, и несколько компаний предлагают полностью автоматические устройства.
Изотермы адсорбции в растворе
Принцип состоит в том, чтобы привести массу адсорбента в контакт с объемом раствора адсорбата при начальной концентрации, адсорбция вызовет уменьшение этой концентрации. Поэтому при достижении равновесия необходимо отделить твердое вещество от свободного раствора (который называется супернатантом) и измерить его концентрацию адсорбата. Количество адсорбированного составляет. мепротивчас>VПРОТИВВ,>ПРОТИВВнетВзнак равноV×(ПРОТИВВ,-ПРОТИВВ) -C_ )>






Характеристики адсорбции
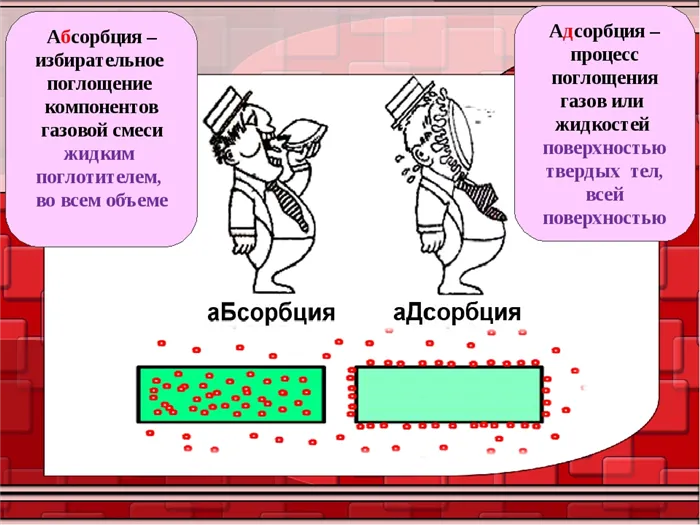
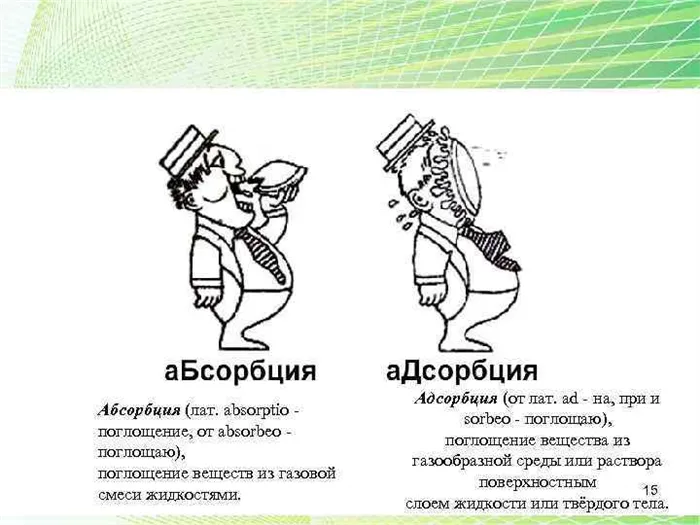
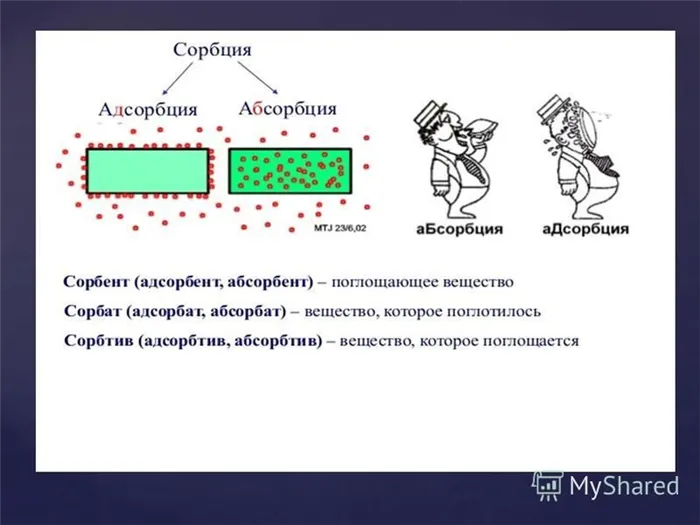
Адсорбция — это накопление веществ на поверхности или в объеме микропор твердого тела, адсорбента. Адсорбированное вещество в газовой или жидкой фазе называется адсорбентом, а когда оно переходит в адсорбированное состояние, его называют адсорбированным.
Адсорбция является частным случаем абсорбции, а процесс, противоположный адсорбции, называется десорбцией.
Различают физическую адсорбцию и хемосорбцию. Процессы адсорбции являются селективными и обычно обратимыми. Их обратимость позволяет высвободить адсорбированные вещества из адсорбента (процесс десорбции).
Физическая адсорбция обусловлена силами молекулярного взаимодействия. Если происходит химическая реакция адсорбента с адсорбентом, то этот процесс называется хемосорбцией.
Большинство промышленных адсорбентов имеют внутреннюю структуру с порами разного размера. В зависимости от размера пор они делятся на три типа:
- микропоры, имеющие размеры, соизмеримые с размерами молекул (эффективные радиусы – радиусы эквивалентных модельных адсорбентов с цилиндрическими порами – составляют преимущественно 0,5-1,0 нм, верхняя граница 1,5 нм, суммарный объем микропор промышленных адсорбентов обычно не превышает 0,5 см 3 /г)
- переходные поры, иногда называемые мезопорами (эффективные радиусы составляют примерно от 1,5 до 100-200 нм, удельная поверхность – поверхность адсорбента, отнесенная к единице его массы, – 10-400 м 2 /г)
- макропоры (эффективные радиусы больше 100-200 нм, удельная поверхность 0,5-2 м 2 /г, объем макропор у активных углей – 0,2-0,8 см 3 /г)
Все адсорбенты можно разделить на три категории в зависимости от преобладающего размера пор: макропористые, переходно-пористые и микропористые.
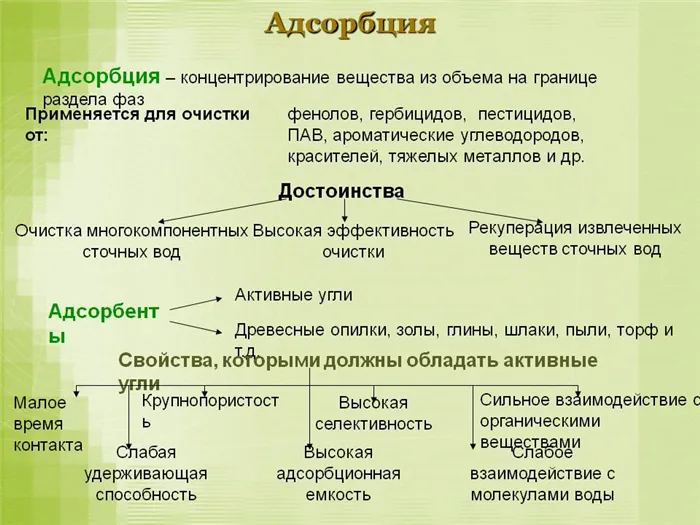
Виды промышленных адсорбентов
К наиболее важным промышленным адсорбентам относятся активированный уголь, силикагель, активированный глинозем, цеолиты, природные глинистые породы и пористые стекла.
Поскольку промышленные адсорбенты имеют разнообразную пористую структуру, это определяет особенности механизма переноса в пористом теле. В крупных порах, где диаметр пор больше средней длины свободного пробега адсорбционных молекул, преобладающим способом переноса является нормальная или объемная диффузия.
Активированные угли — это пористые углеродные адсорбенты. Они производятся из торфа, бурого угля, антрацита, древесных материалов (древесина, древесный уголь, опилки), отходов кожевенного производства и животного сырья. Древесный уголь с высокой механической прочностью получают из скорлупы кокосовых и других орехов, а также из фруктовых косточек. Характерными свойствами активированного угля являются гидрофобность и воспламеняемость.

Силикагель — один из самых распространенных минеральных адсорбентов с ярко выраженной пористостью. Его основными преимуществами являются низкая температура регенерации (110-200ºC), низкая стоимость в промышленном производстве и высокая механическая прочность. Силикагель химически представляет собой гидратированный аморфный кремнезем (nSiO2*mH2O), который выглядит как прозрачные или матовые, бесцветные или светло-коричневые твердые гранулы.

Цеолиты — это алюмосиликаты, которые содержат щелочные и щелочноземельные оксиды, имеют четко выраженную структуру пор и при нормальной температуре заполнены молекулами воды. При нагревании цеолиты выделяют воду и закипают.

Х и м и я

Абсорбция (от лат. sorbeo — брать, выводить) — это любой процесс поглощения одного вещества (абсорбента) другим (абсорбентом), независимо от механизма поглощения.
В зависимости от механизма поглощения различают адсорбцию, абсорбцию, хемосорбцию и капиллярную конденсацию.
Адсорбция — это процесс, происходящий на границе раздела фаз. Он воздействует только на поверхностные слои взаимодействующих фаз и не распространяется на более глубокие слои этих фаз.
Адсорбция — это явление прикрепления одного вещества к поверхности другого. Под адсорбцией обычно понимают изменение концентрации вещества на границе раздела фаз.
В отличие от адсорбции, адсорбция — это процесс, который не ограничивается границей раздела фаз, а распространяется на весь объем адсорбента.
Примером адсорбционного процесса является растворение газа в жидкости.
Химическая сорбция — это поглощение одного вещества другим с участием химического взаимодействия.
Капиллярная конденсация — это сжижение паров в капиллярах, трещинах или порах твердых тел.
Явление конденсации отличается от физической адсорбции.
Поэтому процессы абсорбции различаются по своему механизму. Однако любой процесс абсорбции начинается с адсорбции на границе раздела между соседними фазами, которые могут быть жидкими, газообразными или твердыми.
При хемосорбции, например, вещество вступает в химическую реакцию с адсорбентом:
Когда вновь образованные молекулы в процессе хемосорбции диффундируют вглубь адсорбента, равновесие поглощения достигается медленнее, поскольку оно зависит от скорости диффузии.
Если в процессе хемосорбции на поверхности адсорбента образуются молекулы, которые не могут диффундировать, т.е. образуется пленка, то процесс хемосорбции тормозится и в конечном итоге прекращается.
Например, поглощающая кислород алюминиевая пластина покрывается слоем оксида алюминия, который быстро останавливает процесс хемосорбции:
4Al + 3O 2 = 2Al 2 O 3 .
Химическая абсорбция, как и любая другая химическая реакция, может быть экзотермической или эндотермической. Поэтому повышение температуры усиливает одни процессы хемосорбции и ослабляет другие.
Адсорбцию и хемосорбцию нельзя полностью отличить друг от друга. Эти два процесса обычно происходят вместе.
Адсорбенты
Характеристики и общие требования

Активированный уголь используется в качестве адсорбента
Адсорбенты обычно используются в виде сферических гранул, стержней, отливок или монолитов с гидродинамическим радиусом от 0,25 до 5 мм. Они должны обладать высокой стойкостью к истиранию, высокой термической стабильностью и малым диаметром пор, что приводит к большой площади открытой поверхности и, следовательно, высокой адсорбционной способности. Адсорбенты также должны иметь ярко выраженную пористую структуру, чтобы обеспечить быстрый перенос паров газов.
Большинство промышленных адсорбентов делятся на три категории:
- Кислородсодержащие соединения — обычно гидрофильные и полярные, включая такие материалы, как силикагель и цеолиты.
- Соединения на основе углерода — обычно гидрофобны и неполярны, включая такие материалы, как активированный уголь и графит.
- Соединения на основе полимеров — являются полярными или неполярными, в зависимости от функциональных групп в полимерной матрице.
Силикагель
Силикагель химически инертен, нетоксичен, полярен и стабилен в размерах ( Последнее редактирование 2021-05-03 11:58:14








