В 1859 году на основе экспериментальных данных немецкий ученый Густав Роберт Кирхгоф сформулировал закон спектральной обратимости. Линии поглощения соответствуют эмиссионным системам.
Спектры и спектральный анализ
Спектр — это последовательность спектральных цветов, классифицированных по возрастанию длины волны. Это происходит, когда луч света проходит через преломляющую среду.
Эксперименты по разложению света в спектр, включая призмы, интерференцию и дифракцию, показывают различные зрительные процессы. Таким образом, они подтверждают, что источник не производит монохромный свет, длина волны которого строго определена.
Свет передает определенную энергию от источника теплового излучения, которая неравномерно распределена по всем длинам волн или частотам в световом пучке. В качестве альтернативы эта энергия распределяется по одной длине волны.
Интенсивность электромагнитного потока определяется одной энергией. Для описания частотного распределения излучения вводится новая величина — спектральная плотность потока.
Спектральная плотность потока — это интенсивность излучения на единицу диапазона частот.
Он получается из суммы уравнений, описывающих интенсивность излучения в коротких спектральных интервалах.
Обычно спектральная плотность излучения на разных частотах является экспериментальной. С помощью призмы в эксперименте снимается спектр излучения конкретного объекта и измеряется плотность потока излучения в коротком общем спектральном интервале.
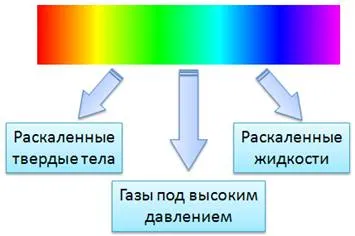
Поскольку человеческий глаз избирательно чувствителен к ярким волнам, невозможно определить распределение энергии путем наблюдения. Наша зрительная система сосредоточена в желто-зеленой области спектра. Лучший вариант — использовать фундаментальное свойство абсолютно черного тела, т.е. поглощение света на всех длинах волн.
Световая энергия (излучение), падающая на поверхность тела, нагревает его. Это означает, что, измерив температуру этого тела, можно определить количество энергии, излучаемой телом.
После завершения эксперимента построили кривую спектральной плотности интенсивности излучения частоты.
Это визуальное представление дает представление о распределении энергии по видимой части спектра тела.
Спектральные аппараты
Спектральный орган — это инструмент, который дает четкий спектр. Он предполагает правильное разделение различных волн и отсутствие покрытия какой-либо части спектра. Основной частью спектрального органа является призма или различительная решетка.
Чтобы понять принципы построения и работы, рассмотрим принципиальную схему устройства спектральной призмы.
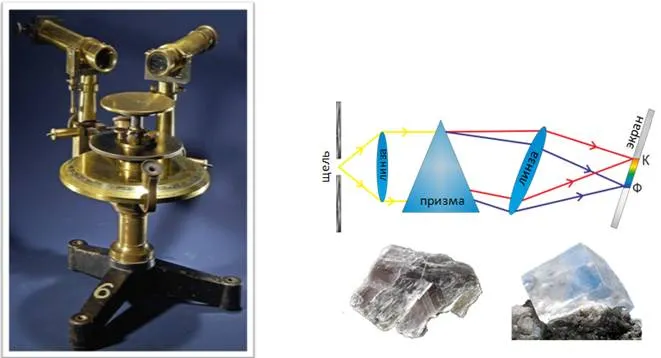
При проведении теста излучение попадает в трубку. Один конец представлен узким щелевым экраном, а другой — коллекционным объективом L1. Эта часть спектрального прибора называется симбометром, а его коэффициентом является фокусное расстояние от объектива. Этот фактор гарантирует, что расходящийся луч света падает на P
Параллельные потоки, выходящие из призмы, имеют различные направления, соответствующие различным частотам и знакам преломления. Все направления в конечном итоге ведут к объективу L2 и к фокусному расстоянию (замороженному стеклу или фотопластинке), где находится экран. Поэтому фокусировка световых лучей дает множество различных изображений, образующих спектр.
Второе название представленного прибора — спектрограф. Замена второй линзы и экрана на телескоп, визуальное наблюдение спектра меняет название на спектрограф.
Виды спектров
Все спектры бывают трех типов.
Непрерывные (компактные) спектры — это спектры, которые представляют все длины волн в определенной области. Типичными примерами являются солнечный спектр и спектр лампы-бабочки. В них нет разрывов — на экране спектрографа наблюдаются сплошные зоны разного цвета.

Появление таких переходов объясняется кривой спектральной интенсивности излучения как функции частоты.
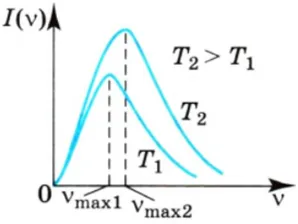
Обратите внимание, что частотное распределение энергии (спектральная плотность интенсивности излучения) варьируется от тела к телу. Возьмите тело с очень темной поверхностью (предпочтительно черное тело). Тело испускает электромагнитное излучение всех частот, но показанная здесь кривая достигает кульминации только на определенных частотах. Остальная часть частотного индекса стремится к нулю или бесконечности, поэтому излучаемая энергия очень мала. При повышении температуры исследуемого тела максимум спектральной плотности излучения смещается в сторону более коротких длин волн.
Когда речь идет об общем состоянии материи, дающем непрерывный (сплошной) спектр, следует упомянуть твердые тела, жидкости и очень сжатые газы. Высокотемпературные существа также дают именно такие спектры.
Поэтому непрерывный спектр сильно зависит от индивидуальных взаимодействий. Для его получения тело должно быть нагрето до высокой температуры. Общий коэффициент излучения тела прямо пропорционален четвертой силе абсолютной температуры.
Отметим, что согласно Федеральному закону n 273-ФЗ в организациях, осуществляющих образовательную деятельность «об образовании в Российской Федерации», обучение и воспитание обучающихся с ограниченными возможностями здоровья организуется как совместно с другими обучающимися, так и отдельными классами или группами.
Полосатые и линейчатые спектры
Когда солнечный свет проходит через стеклянную призму или разделительную решетку, появляется известный всем спектр (рис. 1).

Изображение 1. Непрерывный спектр.
Спектр называется непрерывным, потому что он содержит все длины волн в видимом диапазоне, начиная с красного конца и заканчивая фиолетовым. Непрерывный спектр можно рассматривать как компактную зону цвета.
Солнечное излучение также имеет непрерывный спектр, например, при освещении электрической лампой. Ведь при нагревании до высоких температур твердые или влажные тела (даже плотные газы) испускают непрерывное спектральное излучение.
Ситуация меняется, когда наблюдается свет разреженных газов. Из-за разрывов в спектре спектр больше не является непрерывным. Он увеличивается по мере разбавления газа. В предельном случае чрезмерно разбавленных индивидуальных газов спектр становится линейчатым. То есть он состоит из четких довольно тонких линий.
Рассмотрим два типа линейных эмиссионных спектров: эмиссионный и абсорбционный.
Индивидуумы излучают свет, переходя из стимулированной ситуации в базовое состояние. Однако вещества могут как поглощать свет, так и излучать его. У тех, кто поглощает свет, происходит обратный процесс — стимулированное состояние трансформируется в основное.
Снова рассмотрим разбавленный индивидуальный газ, но в холодном состоянии (т.е. при гораздо более низкой температуре). Поскольку очень немногие люди находятся в стимулированном состоянии для этой цели, газ не светится, так как в незаметном состоянии газ не излучает свет.
Если свет с непрерывным спектром проходит через холодный газ, то изображение получается таким, как на рис. 3.

Рис. 3. Линейный диапазон.
На фоне непрерывного спектра падающего света появляются темные линии, образующие так называемый спектр поглощения.
Откуда берутся эти строки?
Падающий свет приводит людей в состояние возбуждения. Не все длины волн подходят для стимуляции индивидуумов, а только определенные, которые строго определены для данного типа газа. Именно эти длины волн «проглатывают» газ из света.
Важно отметить, что газ извлекает из себя те же самые длины волн и те же самые длины волн, которые излучает сам газ! Темные линии в спектре поглощения газа точно соответствуют лучам света в его спектре излучения. На рисунке 4 сравниваются спектры испускания и поглощения разреженного пара натрия.
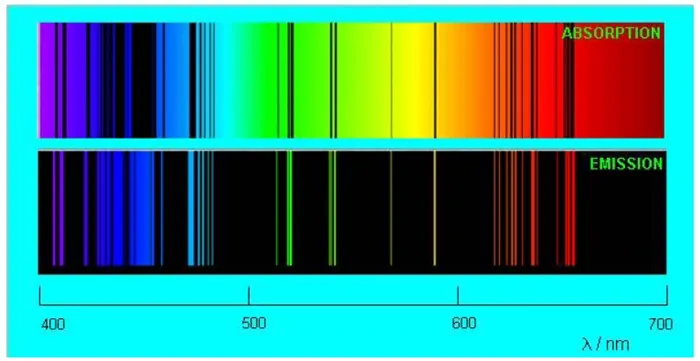
Рисунок 4. Натрий — спектры поглощения и испускания паров
Совпадение линий поражает.
Рассматривая спектры поглощения и испускания, физики XIX века пришли к выводу, что особи представляют собой различные частицы и имеют какую-то внутреннюю структуру. Что-то должно работать в механизмах освещения и поглощения внутри человека!
Кроме того, уникальность индивидуального спектра означает, что этот механизм различен для разных химических индивидуумов. Поэтому различные химические индивиды должны иметь различную внутреннюю структуру.
Держите кусочек асбеста, предварительно смоченный раствором обычной поваренной соли, в небольшом пламени газовой горелки. Если вы наблюдаете за пламенем через спектроскоп, то увидите на экране ярко-желтые линии. Такие цвета соответствуют парам натрия, образующимся при расщеплении молекул поваренной соли (хлорида натрия) в пламени.
Спектр поглощения
Проходя через возбужденное состояние основного состояния, люди излучают свет. Однако вещества не только излучают свет, они также могут его поглощать. Те, кто поглощает свет, совершают обратный процесс, переходя из основного состояния в возбужденное.
Снова рассмотрим разбавленные отдельные газы, но на этот раз в холодных условиях (при гораздо более низкой температуре). Не видно, чтобы газ светился — его не нагревают и не транслируют — и поэтому мало кто находится в стимулированном состоянии.
Если вы пропустите свет через холодный газ в непрерывном спектре, вы увидите такие вещи (рис. 3):.

Рисунок 3. Линейный диапазон поглощения.
Темные линии появляются на фоне непрерывного спектра падающего света и образуют то, что называется спектром поглощения. Откуда берутся эти строки?
Люди в газе переключаются на стимуляцию падающим светом. Не все длины волн подходят для стимуляции индивидуумов, только определенные длины волн, которые строго определены для конкретного типа газа. Эти длины волн «поглощают» газ из распространяющегося света.
Кроме того, газ удаляет из непрерывного спектра именно те длины волн, которые он излучает!ガス吸収スペクトルの暗い線は、その発光スペクトルの光線に正確に対応しています。4 сравниваются спектры испускания и поглощения разбавленного пара натрия (изображение с сайта www.nt.ntnu.no):
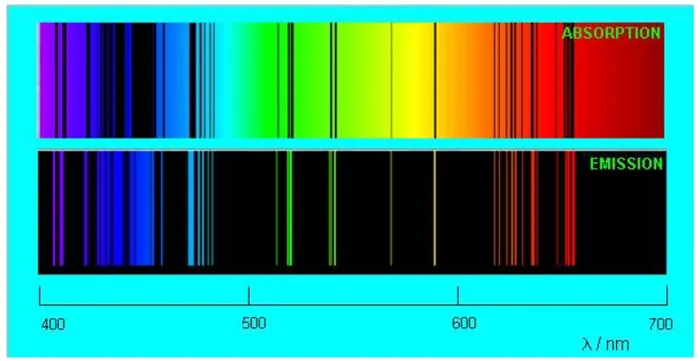
Рис. 4. Спектры поглощения и испускания натрия
Впечатляющее совпадение линий, не правда ли?
Изучая спектры испускания и поглощения, физики XIX века пришли к выводу, что атом не является неделимой частицей и имеет какую-то внутреннюю структуру. Действительно, что-то внутри атома должно обеспечивать механизм для испускания и поглощения света!
Более того, уникальность атомных спектров предполагает, что этот механизм отличается в атомах разных химических элементов; следовательно, атомы разных химических элементов должны отличаться по своей внутренней структуре.
Структура атома будет рассмотрена в следующем раздаточном материале.
Спектральный анализ
Использование спектров линий в качестве уникальных «паспортов» химических элементов составляет основу спектрального анализа — метода исследования химического состава вещества через его спектр. Идея спектрального анализа проста: спектр излучения исследуемого вещества сравнивается с эталонными спектрами химических элементов, и делается вывод о наличии или отсутствии того или иного химического элемента в конкретном веществе. При определенных условиях можно определить химический состав не только качественно, но и количественно, путем спектрального анализа.
В результате наблюдения различных спектров были открыты новые химические элементы.
Первыми из этих элементов были цезий и рубидий; они названы по цвету их спектральных линий (в спектре цезия наиболее выражены две линии небесно-голубого цвета, по-латыни он называется цезием. ) Рубидий, с другой стороны, дает две характерные линии рубиново-синего цвета.
В 1868 году в спектре Солнца были обнаружены линии, которые не соответствовали ни одному из известных химических элементов. Новый элемент был назван гелием (от греческого helios — солнце). Позднее гелий был обнаружен в атмосфере Земли.
В целом, спектральный анализ излучения Солнца и звезд показал, что все элементы, входящие в их состав, присутствуют и на Земле. Таким образом, создавалось впечатление, что все объекты во Вселенной собраны из одного и того же «набора кирпичей».
Между 1664 и 1668 годами. Исаак Ньютон провел серию экспериментов по изучению солнечного света и причин возникновения цветов с помощью стеклянной призмы. Когда белый свет, т.е. свет в видимой области, содержащий длины волн в диапазоне 380-760 нм, разделяется треугольной призмой, появляется радужная полоса, называемая спектром Ньютона.
Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров
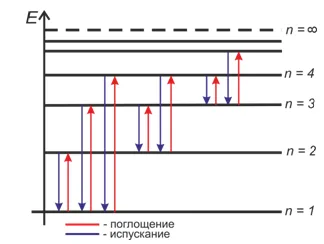
В этом видеоуроке мы поговорим о типах оптических спектров. Мы рассмотрим, как свет поглощается и излучается атомами. Мы также поговорим о происхождении линейчатых спектров. Рассмотрите две аксиомы Бора и узнайте, где и почему используется спектральный анализ.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим учебным видео в комплекте, вы должны добавить его в свой личный кабинет, купив в каталоге.