Кристаллическая решетка — это пространственное расположение индивидов или ионов в кристалле. Индивиды или ионы называются узлами кристаллической решетки, точками в кристаллической решетке.
Кристаллические решетки. Типы кристаллических решеток.
Кристаллическая решетка создается потому, что большинство твердых тел имеют кристаллическую структуру, и частицы, которые «строятся» из нее, располагаются в определенных колонках.
Большинство твердых тел имеют кристаллическую структуру, и частицы, которые «строятся» из них, располагаются в определенных столбцах, создавая кристаллическую решетку. Он состоит из повторяющихся одинаковых структурных единиц, т.е. ячеек, соединенных с соседними единицами, образуя дополнительные единицы. В результате существует 14 различных структур сетки.
Металлическая связь в кристаллических решетках.
Отдельные особи располагаются как можно ближе друг к другу и очень плотно. Промежутки между индивидами (сферами) очень малы, отсюда и название — плотные структуры. Существует три основных типа таких структур: гексагональная упаковка плотности (HDP), кубические центральные стороны (GCP) и кубическая упаковка объемов (VCCP). Последний имеет меньшую плотность.
Гексагональные кристаллические решетки.
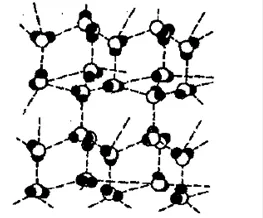
Каждая сфера соприкасается с шестью соседними сферами, причем центр каждой из них образует равносторонний треугольник.
Квадратная кристаллическая решетка.
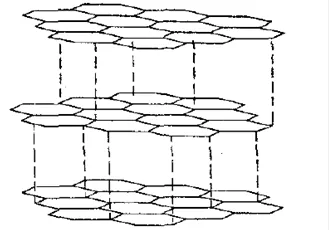
Соседние сферы образуют квадрат.
Как «упаковываются» слои кристаллической решетки?
Представьте, что существуют слои A и B. При гексагональной компоновке слои могут быть уложены различными способами, образуя плотное расположение шестиугольников или кубическую компоновку. Согласно терминологии, каждый шар в верхнем слое касается трех шаров в нижнем слое. Пули в слое 3, очевидно, находятся поверх пуль в слое 1, а пули в слое 4 — поверх пуль в слое 2.
Гексагональный кубический пакет (HCP) имеет более сложную структуру — между слоями C и A существует значительная разница, поскольку сфера в слое 3 находится над зазором в слое 2.
Объемно-центрированная кубическая упаковка складывается одним способом. Каждая сфера находится в центре куба, вершины которого заняты другими сферами. Это означает, что каждая сфера касается соседней 8 — числа, равного 8, где принято говорить, что каждый человек имеет настройку.
Шестиугольный плотный пакет
Гранецентрированный гранецентрированный кубический пакет
Кубический пакет, ориентированный на объем
Если речь идет о гранецентрированном кубическом пакете, то регулировочное число, а о шестиугольном плотном пакете — 12.
В пространстве эти типы настроек можно представить следующим образом
Шестиугольный плотный пакет

Гранецентрированный гранецентрированный кубический пакет

Кубический пакет, ориентированный на объем

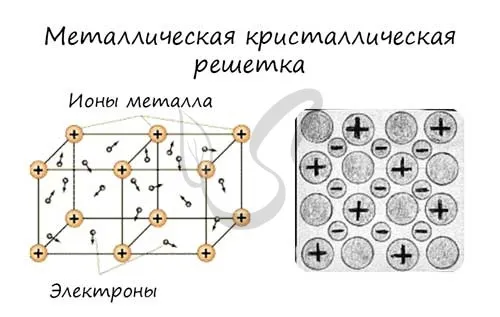
В металлической решетке материала имеются металлические связи. Ионы металла и свободные электроны расположены на пересечениях этой решетки. Поэтому материал с таким типом связи является гибким, тупым, металлическим, блестящим, электро- и теплопроводным.
Кристаллические решетки
Кристаллическая решетка — это пространственное расположение индивидов или ионов в кристалле. Индивиды или ионы называются узлами кристаллической решетки, точками в кристаллической решетке.
Различают кристаллические решетки, молекулярные решетки, индивидуальные решетки, ионные решетки и металлические решетки.
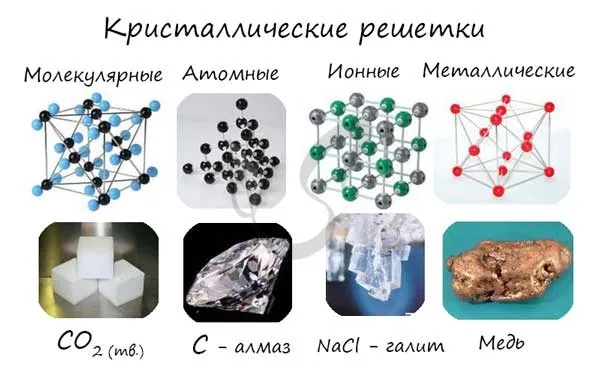
Очень важно не путать тип химической связи с типом кристаллической решетки. Помните, что кристаллическая решетка отражает пространственное расположение индивидуумов.
Молекулярные кристаллические решетки.
Узлы молекулярной решетки содержат молекулы. В нормальных условиях большинство газов и жидкостей имеют молекулярную решетку. Связи обычно бывают ковалентными, полярными или неполярными.
Типичным примером вещества с молекулярной решеткой является вода, поэтому свойства этих веществ объединяются с водой. Вещества с молекулярными решетками характеризуются хрупкостью, низкой твердостью, летучестью, растворимостью, возможностью быть оставленными и низкой температурой кипения.
Примеры включают NH3, H2O, Cl2, CO2, N2, Br2, H2, I.2. Особого внимания заслуживают белый фосфор, ромбоэдрический, пластик, моносульфа и фуллерен. Эти аллотропные модификации подробно рассматриваются в статье о классификации веществ.
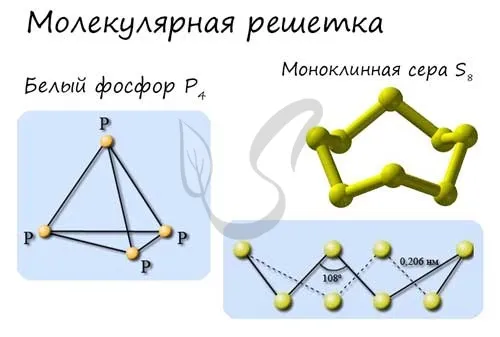
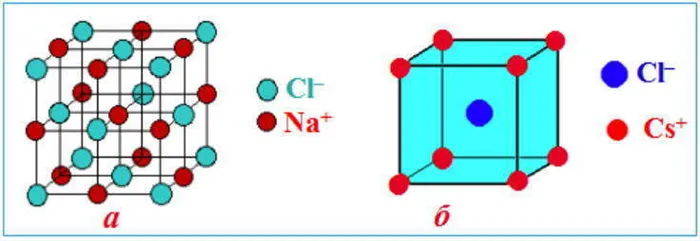
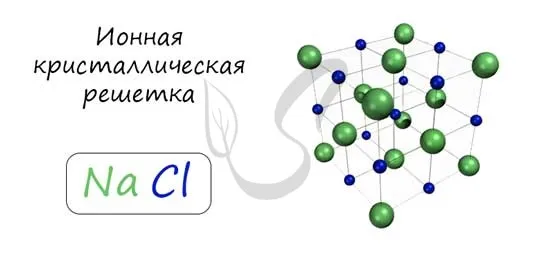
Ионные кристаллические решетки
Узлы ионной решетки содержат атомы, соединенные между собой ионными связями. Такой тип решетки характерен для веществ с ионными связями: солей, оксидов и гидроксидов металлов.
Этот ряд веществ объединяет поваренная соль — NaCl. Ионно-решетчатые вещества имеют высокие температуры плавления и кипения, растворимы в воде, хрупкие и твердые, а их растворы и расплавы проводят электричество.
Металлические кристаллические решетки
Узлы проволочной сетки содержат атомы металла. Этот тип решетки характерен для веществ, образованных металлическими связями.
Свойства этих веществ сочетаются с медью. Они имеют характерный металлический блеск, легко растекаются, хрупки, теплопроводны, имеют высокую температуру плавления и кипения.
Примеры включают Cu, Fe, Zn, Al, Cr и Mn.
Индивидуальные кристаллические решетки
Узлы атомной решетки содержат атомы, соединенные ковалентными или неполярными связями.
Эти материалы соединяются с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные и нерастворимые в воде.
Примеры: SiO2B, Ge, SiC, Al2O3. Особое внимание следует уделить алмазу и графиту (С), красному и черному фосфору (Р).

©Белевич Юрий Сергеевич 2018-2022
Эта статья написана ЮриемСергеевичемБеллевичем и является его интеллектуальной собственностью. Любое копирование, распространение (включая копирование на другие сайты или ресурсы в интернете) или иное использование информации или объектов без предварительного согласия правообладателя карается законом. Чтобы получить лицензию на данный материал и получить лицензию, свяжитесь сБерезовские лилии. .
Свойства внешней формы и внутренней структуры кристалла определяются принципом высокоплотного «накопления». Наиболее вероятной структурой является та, которая соответствует наиболее плотному расположению частиц внутри кристалла, так как она наиболее стабильна. Остаются самые маленькие свободные участки.
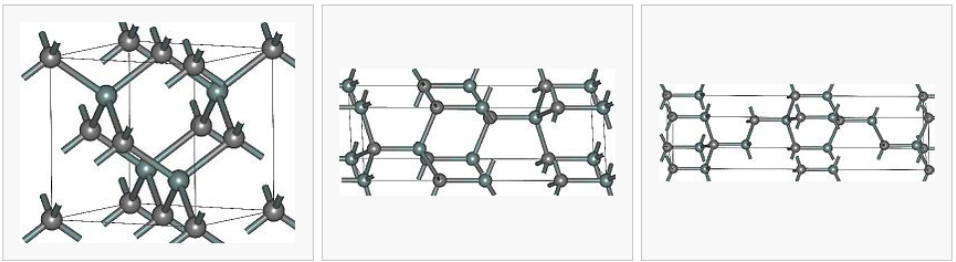
Атомные решетки
Эти решетки состоят из особей, соединенных ковалентными связями. Их можно разделить на три типа структур: каркасные структуры, иерархические структуры и цепные структуры.
Например, алмаз, одно из самых твердых веществ, имеет каркасную структуру. Гибридизация sp3 атомов углерода приводит к образованию трехмерной решетки, полностью состоящей из атомов углерода, соединенных ковалентными неполярными связями, оси которых расположены под углом равной силы (109,5 o).
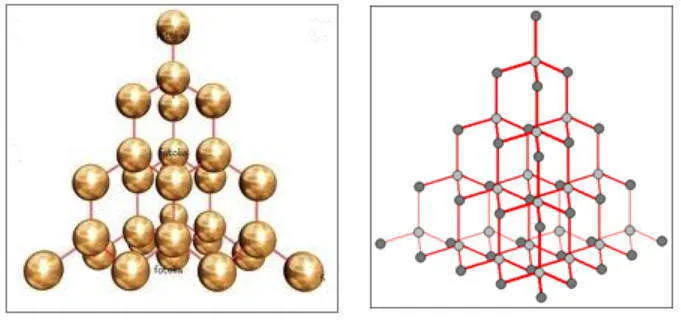
Каркасная структура атомной кристаллической решетки алмаза
Слоистые структуры можно представить себе как гигантские двумерные молекулы. Слоистые структуры характеризуются ковалентными связями внутри каждого слоя и слабыми ван-дер-ваальсовыми взаимодействиями между соседними слоями.
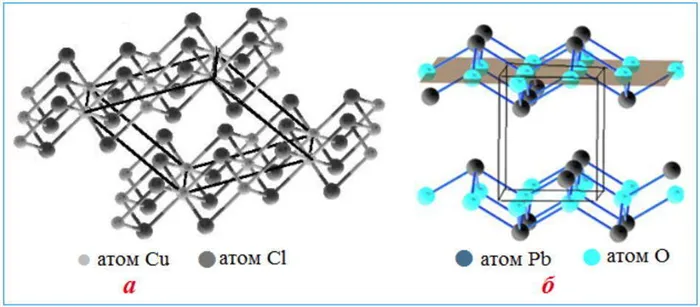
Слоистая структура отдельных кристаллических решеток: a) cucl2 (a) cucl- (b) pbo. элементарные клетки обозначены моделями с параллельной пикселизацией.
Классическим примером слоистой структуры является графит. Каждый атом углерода находится в состоянии управления Sp 2 и образован одной ковалентной связью уровня 3. Слой. Таким образом, по крайней мере, при небольшом усилии отдельные слои легко скользят друг по другу. Этим объясняется, например, способность писать графитом. В отличие от алмаза, графит хорошо проводит электричество: под воздействием электрического поля незатопленные электроны перемещаются по уровню слоя и наоборот. Графит с трудом проводит электричество по вертикали.
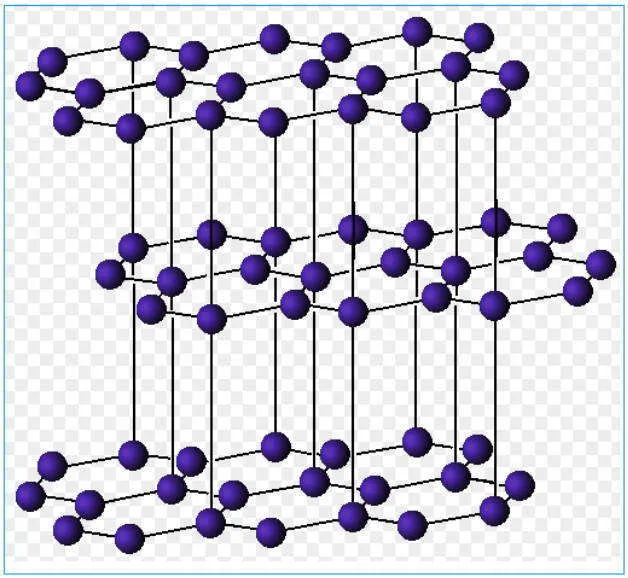
Слоистая структура отдельных кристаллических решеток графита.
Например, цепная структура характерна для оксида серы (таким образом3)n, HGS CINNABY, BECLIL CHRORIDE2То же самое относится ко многим аморфным полимерам и некоторым силикатным материалам, таким как асбест.
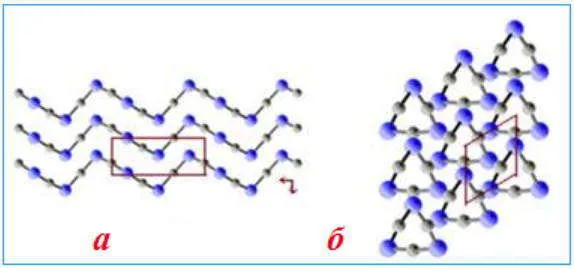
Цепная структура отдельных кристаллических решеток HGS: a) Поперечный вид b) Фронтальный вид
Относительно небольшое количество материалов имеет индивидуальные решетчатые структуры. Как правило, это простые вещества, образованные элементами подгрупп IIIA и IVA (SI, Ge, B, C). Нередко соединения двух различных неметаллических элементов имеют индивидуальные решетки. Например, некоторые полиморфные модификации кварца (оксид оксида сио2 ) и карборен (sic Carbide).
Все атомные кристаллы характеризуются высокой интенсивностью, злоупотреблением, показателем преломления и нерастворимостью почти во всех растворителях. Эти свойства обусловлены эффективностью их ковалентных связей. Материалы с индивидуальными кристаллическими решетками имеют широкий диапазон электропроводности — от изоляторов и полупроводников до электронных проводников.
Металлические решетки
Эти кристаллические решетки содержат отдельные узлы, содержащие электроны (электронный газ) и ионы металлов, которые образуют металлические связи и свободно перемещаются вместе со всеми. Особенностью кристаллического металлометра является большое количество резонансов (8-12), что указывает на высокую плотность упаковки атомов металла. Это объясняется тем, что отдельные «ядра» без внешних электронов расположены в пространстве в виде сфер одинакового радиуса. Для металлов наиболее распространены три типа кристаллических решеток. Появление кубического центра с резонансным числом 12, кубического тела с резонансным числом и шестиугольного числа, стянутого координационным числом 12.
Металлическая связь и специфические свойства металлов определяют важные свойства металлов, такие как высокая температура плавления, электрическая и тепловая проводимость, фальшь, рабство и жестокость.
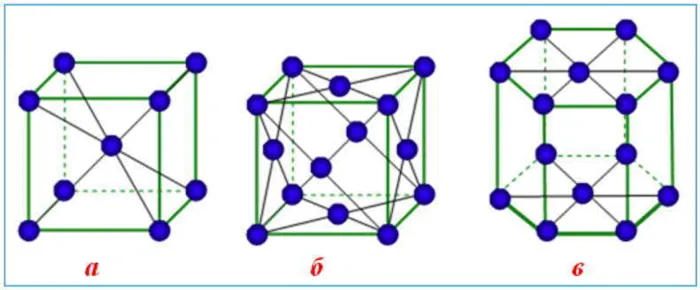
Кристаллические металлические решетки: a) кубические ножки с опухолевыми центрами (Fe, V, Nb, Cr) b) кубические с граневыми центрами (al, ni, ag, cu, au) c) гексагональные (ti, zn, mg, cd )
Молекулярные решетки
Молекулярные кристаллические решетки содержат молекулы, удерживаемые вместе слабыми межмолекулярными силами (вандерваальсовыми или водородными связями). Например, лед состоит из молекул воды, удерживаемых водородными связями. Кристаллические решетки многих веществ, переходящих в твердые тела, относятся к одному типу. Примеры: простые вещества H2, О2, N2, O3, P4, S8Галогены (F), Галогены (F, Cl)2F, Cl2, Br2, I.2), «сухой лед» CO2, все благородные газы и большинство органических соединений.
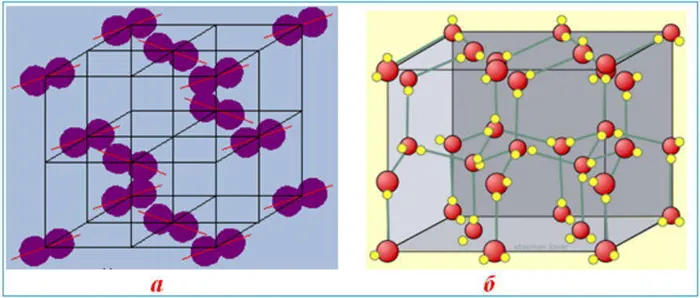
Молекулярная кристаллическая решетка: a) йод I2- b) лед H2O
Поскольку силы межмолекулярных взаимодействий слабее сил ковалентных и металлических связей, молекулярные кристаллы менее жесткие, огнеопасные, летучие, нерастворимые в воде и непроводящие.
Типичным примером вещества с молекулярной решеткой является вода, поэтому свойства этих веществ объединяются с водой. Вещества с молекулярными решетками характеризуются хрупкостью, низкой твердостью, летучестью, растворимостью, возможностью быть оставленными и низкой температурой кипения.
Молекулярная кристаллическая решётка
Узлы этой структуры содержат молекулы, которые плотно упакованы друг с другом. Для этих веществ характерны ковалентные и неполярные связи. Интересно, что независимо от ковалентных связей, между частицами существует незначительное притяжение (из-за слабых ван-дер-ваальсовых сил). Поэтому эти вещества очень хрупкие, имеют низкие температуры кипения и плавления и являются летучими. К таким веществам относятся вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, вещества 2 (водород, кислород, хлор, азот, йод), 3 (озон), 4 (фосфор) и 8 (сера).
Одной из выдающихся особенностей является то, что структурные и пространственные закономерности сохраняются во всех фазах (твердой, жидкой и газовой).
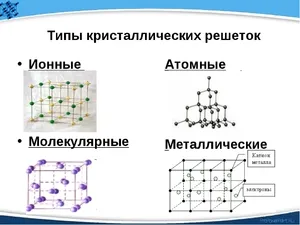
Металлическая кристаллическая решётка
Из-за наличия ионов в узлах металлические решетки могут напоминать ионные решетки. На самом деле, это два совершенно разных узора с разными свойствами.
Металлы гораздо более гибкие, пластичные и прочные, чем ионы, характеризуются высокой электро- и теплопроводностью, хорошо плавятся и являются отличными проводниками электричества. Это объясняется тем, что узлы содержат положительно заряженные ионы металлов (катионы), которые позволяют потоку электронов перемещаться по всей структуре. Частицы движутся вокруг узлов беспорядочно (у них недостаточно энергии, чтобы выйти за пределы узлов), но как только появляется электрическое поле, электроны текут и устремляются из положительных областей в отрицательные.
Металлические кристаллические решетки характерны для металлов, например, свинца, натрия, калия, кальция, серебра, железа, цинка и платины. В частности, существуют различные типы устройств. Они шестиугольные, объемно-центрированные (наименее плотные) и гранецентрированные. Для первого типа характерны цинк, кобальт и магний; для второго — барий, железо и натрий; для третьего — медь, алюминий и кальций.
Таким образом, многие свойства, а также структура вещества зависят от типа решетки. Например, когда известна формула, можно предсказать прочность и долговечность изделия.
С помощью доступных видеоклипов учащиеся узнают о различиях между аморфными и кристаллическими материалами, о различных типах кристаллических решеток и многочисленных примерах кристаллических решеток.
Металлическая кристаллическая решетка

Наконец, металлы характеризуются особым типом пространственной структуры — металлической кристаллической решеткой. Это происходит благодаря металлическим химическим связям. Металлы значительно ослабляют свои валентные электроны. Следующие этапы происходят одновременно в кристаллах, образованных металлами. Некоторые особи запускают электроны и становятся положительно заряженными ионами? Являются ли эти электроны спутанными отическими к кристаллу? Некоторые электроны притягиваются к ионам. Эти процессы в то же время конфотичны. Это приводит к образованию ионов, например, к образованию ионных связей, и общих электронов, например, к образованию ковалентных связей. Свободные электроны, как смешарики, постоянно перемещаются в объеме кристалла, например, как газ. По этой причине их иногда называют «электронными газами». Металлы, способствующие возникновению электрического тока и тепла из-за наличия многочисленных подвижных заряженных частиц. Температуры плавления металлов варьируются в широких пределах. Металлы характеризуются собственным металлическим блеском, фальшью, то есть способностью изменять форму, не ломаясь при сильном механическом воздействии, поскольку химические связи не нарушаются.
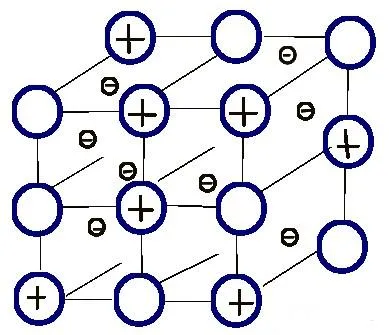
Соединения между частицами: металлические химические связи.
Ионы металлов и индивидуумы находятся в узлах кристалла металлической решетки.
Фазовое состояние металлов при нормальных условиях: как правило, в твердом состоянии (исключение: ртуть, жидкость при нормальных условиях).
Химические вещества с металлическими кристаллическими решетками являются простыми металлическими веществами.
Природные вещества с металлическими кристаллическими решетками:.
— Теплопроводность и электропроводность,.
— Глупость и пластичность,.
— Металлический блеск,.
— Металлы, как правило, нерастворимы в растворителях.
— Большинство металлов при нормальных условиях являются твердыми веществами.
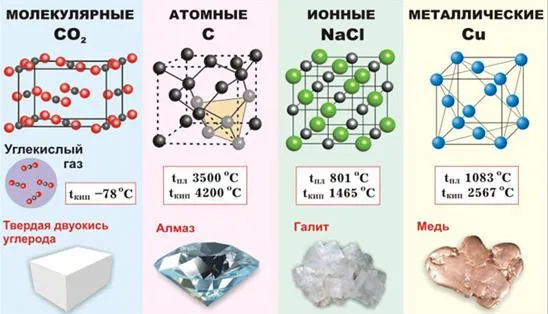
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные природные свойства вещества. Для приблизительного сравнения типичных природных свойств соединений с различными типами сеток очень полезно использовать химические вещества с характерными свойствами. Для молекулярных решеток, например, углекислого газа, индивидуальных решеток, алмаза, металлических решеток, меди, ионных сеток, поваренной соли, хлорида NaCl.
Сводная таблица строения простых веществ, образованных химическими элементами главных подгрупп таблицы Менделеева (имеется металлическая кристаллическая решетка, так как элементы внешних подгрупп являются металлами).