Если физические нагрузки легкие, организм может выводить 1-2 литра воды в час. Более интенсивные физические нагрузки, особенно если температура окружающей среды превышает 25°C, увеличивают интенсивность испарения, и может быть выведено 3-6 литров воды. Выделение через пот.
От чего зависит испарение жидкости
Ежедневные наблюдения показывают, что количество жидкости в открытых емкостях со временем уменьшается. Однако жидкость не исчезает так легко. Что с этим происходит? Он преобразуется в пар.
Испарение — это явление превращения жидкости в пар.
Существует два способа превращения жидкостей в газы.
В этом уроке мы рассмотрим первый метод — испарение.
Испарение
Испарение — это образование пара с поверхности жидкости.
Молекулы жидкости находятся в постоянном движении. Они движутся с разной скоростью.
Очень «быстрые молекулы» можно найти на поверхности жидкости. Затем они преодолевают притяжение соседних молекул и выпрыгивают из жидкости. Эти молекулы образуют пары на жидкости (рис. 1).
При движении другие молекулы сталкиваются друг с другом и со стенками контейнера. По мере того, как они это делают, их скорость меняется. В результате образуются новые «быстрые» молекулы, которые могут вырваться из жидкости.
Поскольку этот процесс происходит непрерывно, жидкость постепенно испаряется.
Скорость испарения и род жидкости
Очевидно, что жидкости не всегда испаряются одинаково. Иногда быстрее, иногда медленнее. Скорость испарения зависит от многих факторов.
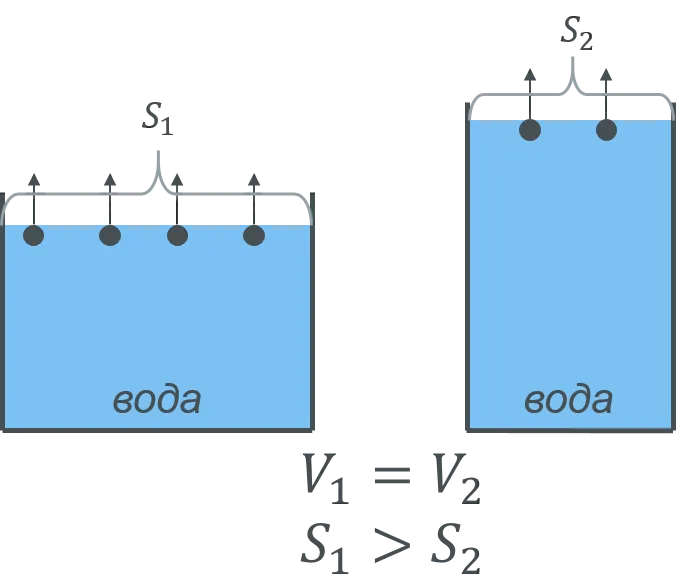
Поместите одинаковые массы воды и эфира в два одинаковых открытых контейнера (рис. 2).
Видно, что эфир испаряется гораздо быстрее, чем вода. Это изменение может быть зарегистрировано путем взвешивания воды или записи ее объема.
Скорость испарения зависит от типа жидкости.
Там, где молекулы притягиваются друг к другу с меньшей силой, жидкость испаряется быстрее. В таких жидкостях большее количество молекул может легко преодолеть сопротивление и вырваться наружу.
Когда пар конденсируется, выделяется некоторое количество тепла. Это соответствует количеству тепла, которое необходимо затратить для превращения жидкости в пар при той же температуре.
Испарение и конденсация. Кипение жидкости

1.Явление превращения вещества из жидкости в газ называется испарением. Образование пара может происходить в виде двух процессов: испарения и кипения.
Испарение может происходить с поверхности жидкости при любой температуре. Например, лужа высыхает при температуре 10°C, 20°C или 30°C. Таким образом, испарение — это процесс, который переводит вещество из жидкого состояния в газообразное и может происходить с поверхности жидкости при любой температуре.
С точки зрения молекулярно-кинетической теории строения вещества, испарение жидкостей можно описать следующим образом Молекулы жидкости, участвующие в непрерывном движении, имеют разные скорости. Более быстрые молекулы, которые находятся на границе раздела между водой и воздухом и обладают относительно высокой энергией, преодолевают гравитационное притяжение соседних молекул и покидают жидкость. Следовательно, поверх жидкости образуется пар.
Поскольку во время испарения из жидкости выходят молекулы с большей внутренней энергией, чем у оставшихся в жидкости, средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются.
Скорость испарения жидкостей зависит от типа жидкости. Например, скорость испарения эфира выше, чем у воды или растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством этого является то, что при одинаковых условиях на открытом воздухе одежда быстрее сохнет на ветру, чем в его отсутствие.
Скорость испарения зависит от температуры жидкости. Например, вода при температуре 30°C испаряется быстрее, чем вода при температуре 10°C.
Известно, что вода, налитая в блюдце, испаряется быстрее, чем та же масса воды, налитая в стакан. Поэтому скорость испарения зависит от поверхности жидкости.
2.Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, которые выходят из жидкости и находятся над ее поверхностью, участвуют в неупорядоченном движении. Они сталкиваются с другими молекулами, и в какой-то момент их скорость направляется к поверхности жидкости, и молекулы могут вернуться к поверхности жидкости.
Если емкость открыта, процесс испарения происходит быстрее, чем конденсация, и масса жидкости в емкости уменьшается. Пар, образующийся на жидкости, называется ненасыщенным паром.
Если жидкость находится в закрытом контейнере, количество молекул, выходящих из жидкости, первоначально будет больше, чем количество молекул, возвращающихся в жидкость, но со временем плотность пара на жидкости становится настолько высокой, что количество молекул увеличивается. Число молекул, выходящих из жидкости, равно числу молекул, возвращающихся в жидкость. В этом случае между жидкостью и ее паром возникает динамическое равновесие.
Пар, находящийся в динамическом равновесии с жидкостью, называется насыщенным паром.
При нагревании сосуда, содержащего жидкость с насыщенным паром, первоначально из жидкости выходит больше молекул, чем возвращается в нее. Со временем баланс восстанавливается, но плотность пара на жидкости и ее давление соответственно увеличиваются.
ПРИМЕРЫ ЗАДАНИЙ
Испарение и кипение — это два процесса, которые переводят вещество из одного кумулятивного состояния в другое. Общей чертой этих процессов является то, что оба
А. процесс перехода из жидкого состояния в газообразное В. происходит при определенной температуре 1) Только А 2) Только В 3) Только С 3) Только С 4) Только А
1) Только A 2) Только B 3) Только A и B 4) Ни A, ни B
Испарение и кипение — это два процесса, с помощью которых вещества переходят из одного кумулятивного состояния в другое. Разница между ними заключается в следующем.
А. Кипение происходит при определенной температуре, в то время как испарение происходит при любой температуре. B. Испарение происходит с поверхности жидкости, в то время как кипение происходит во всем объеме жидкости.
Правильные утверждения следующие.
1) Только A 2) Только B 3) Только A и B 4) Ни A, ни B
3. при нагревании воды она превращается в пар при той же температуре. Мне кажется, что
1) среднее расстояние между молекулами увеличивается 2) средняя скорость молекул уменьшается 3) средняя скорость молекул увеличивается 4) среднее расстояние между молекулами уменьшается
4. При конденсации водяного пара при определенной температуре выделяется некоторое количество тепла. Что произошло с энергией молекул водяного пара?
1) изменилась как динамическая, так и кинетическая энергия молекул пара 2) изменилась только динамическая энергия молекул пара 3) изменилась только кинетическая энергия молекул пара 4) внутренняя энергия молекул пара не изменилась изменилась изменилась изменилась изменилась изменилась изменилась изменилась изменилась
5.На следующем графике показана временная зависимость температуры воды при ее охлаждении и последующем нагревании. Первоначально вода была газообразной. Какая часть диаграммы соответствует процессу конденсации?
6.График на диаграмме показывает температуру воды как функцию времени. Первоначально вода находилась в газообразном состоянии. Каково состояние воды в момент времени ⌘ (⌘ tau_1 \)?
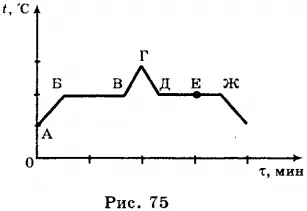
1) только в газообразном состоянии 2) только в жидком состоянии 3) часть воды в жидком состоянии, часть воды в газообразном состоянии 4) часть воды в жидком состоянии, часть воды в кристаллическом состоянии
7.На следующем графике показана температура спирта в зависимости от времени при нагревании и охлаждении. Первоначально спирт находился в жидком состоянии. Какая часть диаграммы представляет процесс кипячения спирта?
8. какое количество тепла необходимо для перевода 0,1 кг спирта в газообразное состояние при температуре кипения?
1) 240 Дж 2) 90 кДж 3) 230 кДж 4) 4500 кДж
9.В понедельник абсолютная влажность воздуха составляла 12,8 г/см3, а днем было 20°C. Во вторник он увеличился до 15,4 г/см3. Если температура понизилась до 16°C, а плотность насыщенного пара при этой температуре составила 13,6 г/см 3, выпала ли роса?
1) Не выпало на понедельник или вторник 2) Не выпало на понедельник и вторник 3) Не выпало на понедельник и вторник 4) Не выпало на понедельник и вторник
Там, где молекулы притягиваются друг к другу с меньшей силой, жидкость испаряется быстрее. В таких жидкостях большее количество молекул может легко преодолеть сопротивление и вырваться наружу.
Молекулярный уровень
Рассмотрим этот процесс на молекулярном уровне. Молекулы, обладающие достаточной энергией (скоростью), чтобы преодолеть притяжение соседних молекул, выходят за пределы вещества (жидкости). Таким образом, жидкость теряет часть своей энергии (охлаждение). Примером может служить очень горячая жидкость. Распыление на поверхность и ее охлаждение ускоряет процесс испарения.
Нарушение термодинамического равновесия между жидкостью и паром в пароводяной смеси объясняется скачком температуры на границе раздела фаз. Однако обычно этим скачком можно пренебречь, и парциальное давление и концентрацию пара на границе раздела фаз можно рассматривать как соответствующие значению насыщенного пара при температуре влажной поверхности. Если смесь жидкость-газ-пар неподвижна и эффекты свободной конвекции пренебрежимо малы, то удаление образовавшегося при испарении пара с поверхности жидкости в газообразную среду происходит в основном за счет молекулярной диффузии и возникновения потоков массы (последних на полупроницаемой (газонепроницаемой) поверхности раздела, направленных от поверхности жидкости в газообразную среду). Вызванное так называемое стефановское течение парогазовой смеси (см. диффузия). Распределение температуры при различных методах охлаждения жидкостей испарением. Тепловой поток направлен следующим образом: a — от жидкой фазы к поверхности выхлопа, к паровой фазе — b — от жидкой фазы только к поверхности выхлопа — c — от обеих фаз к поверхности выхлопа — d — от паровой фазы только к поверхности испарения.
Баро-, термодиффузии
Эффекты веса и диффузии обычно не учитываются в механических расчетах, но эффекты термической диффузии могут быть важны, когда смесь пара/газа сильно неоднородна (большие различия в молекулярном весе компонентов) и при высоких температурах. Градиенты. Роль переноса массы и энергии в парогазовых смесях и жидкостях путем конвекции возрастает при переносе одной или обеих фаз, связанных с границей раздела фаз.
Если в систему жидкость-газ не поступает энергия из внешнего источника, тепло отработанных газов подводится к поверхности жидкости одной или обеими фазами. В отличие от результирующего потока массы, который всегда идет в направлении испарения от жидкости к газообразной среде, поток тепла может принимать различные направления в зависимости от массы жидкости tg, границы раздела tgr и соотношения температур газообразной среды. tg. Когда постоянный объем жидкости находится в контакте с потоком газа в половину жидкости или среды, окружающей ее поверхность, и когда температура жидкости выше температуры газа (tj> tgr> tg), поток тепла от жидкости к границе раздела: (Qjpg = Qj-Qi, где Qi — теплота пара, а Qjpg — теплопередача от жидкости к газовой среде. Qjj = Qj-Qi, где Qi — теплота пара, а Qjpg — теплопередача от жидкости к газовой среде. Это охлаждает жидкость (так называемое испарительное охлаждение). Когда уравнение tgr = tg, передача тепла от жидкости к газу прекращается (Qjg = 0) и все тепло, подводимое жидкостью к границе раздела фаз, расходуется на испарение (Qj = Qi).
В случае газообразной среды, не насыщенной паром, испарение и охлаждение жидкости не прекращаются, поскольку парциальное давление последней на границе раздела фаз и Qж = Qi остается больше, чем объем газа. И tgr будет ниже, от tgr и tg. В то же время тепло подводится к границе раздела фаз от обеих фаз, и в результате уменьшения tg достигается уравнение tg = tg, тепловой поток со стороны жидкости прекращается, а Qg со стороны газа становится равным Ци. Дальнейшее испарение жидкости происходит при постоянной температуре tm = tg = tgr. Это называется испарительным охлаждением или пределом охлаждения жидкости при температуре жидкой сферы (как показывает измеритель сухости жидкости). Значение tm зависит от параметров парогазовой среды и условий тепломассообмена между жидкой и газовой фазами.
Если жидкая и газообразная среды разной температуры находятся в ограниченном объеме, не получают энергию извне и не возвращаются наружу, испарение происходит до тех пор, пока между двумя фазами не будет достигнуто термодинамическое равновесие. Обе фазы равны при постоянной энтальпии системы, а газообразная фаза насыщена паром при небольшой температуре системы. Последняя, называемая адиабатической температурой насыщения газа, определяется исключительно начальными параметрами обеих фаз и не зависит от условий тепло- и массообмена.
Скорость испарения
Скорость изотермического испарения кг / (м 2 -с) при однонаправленной диффузии пара в неподвижном слое парогазовой смеси толщиной d, м с поверхности жидкости может быть определена по формуле Стефана. ширина = «» высота = «» />, где D — коэффициент интердиффузии, м 2 / с- «ширина =» «высота =» «/>- парциальное давление слоя пара на границе раздела фаз и внешней границе смеси, Па.
В общем случае (движущиеся жидкость и газ, неизотермические условия), в ограничивающем слое жидкости рядом с границей раздела фаз, импульс сопровождается переносом тепла в окружающем слое. Экспериментальные коэффициенты тепло- и массопередачи используются для расчета скорости испарения и, в относительно простом случае, приближенных методов численного решения систем дифференциальных уравнений для комбинированных газовой и жидкой фаз периферийного слоя.
Интенсивность массопереноса при испарении зависит от химической динамики пара в интерпретации и основного вещества парогазовой смеси. Однако если гравиметрией можно пренебречь, то различия в химической динамике заменяются некоторыми различиями в давлении или концентрации — YUP, RN) или JN = BC (SP, Gr -SP, RN), BP, BC — коэффициент массопередачи BC, p — давление смешения, pn — парциальное давление пара, yup = rp/p — молекулярный пар. концентрация, sp = gp/r — масса пара, gp, r — локальная плотность пара и смешения, индекс. Среднее ‘GR’ — интерпретация, ‘OSN’ — основная масса смеси. Плотность теплового потока, обусловленного отводом тепла от жидкости, составляет дж/(м2 -с): q = azh(tj -tgg) = gjn + ag(tg -tg). Где azh — ag — коэффициент теплопередачи. Стороны жидкости и газа, w/(m 2 -k) — R — теплота выхлопа, Дж/кг.
При очень малых радиусах кривизны поверхности испарения (например, при испарении мелких капель жидкости) учитывается влияние поверхностного натяжения жидкости, приводящего к тому, что равновесное давление пара над поверхностью раздела выше давления насыщенных паров той же жидкости над плоской поверхностью. Если tгр ~ tж, то при расчете испарения могут приниматься во внимание только тепло- и массообмен в газовой фазе. При относительно малой интенсивности массообмена приближенно справедлива аналогия между процессами тепло- и массопереноса, из которой следует: Nu/Nu0 = Sh*/Sh0, где Nu = aг l/lг — число Нуссельта, l — характерный размер поверхности испарения, lг — коэффициент теплопроводности парогазовой смеси, Sh* = bpyг, грl/Dp = bccг, грl/D — число Шервуда для диффузионной составляющей потока пара, Dp = D/RпT -коэффициент диффузии, отнесенный к градиенту парциального давления пара. Значения bp и bс вычисляют по приведенным выше соотношениям, числа Nu0 и Sh0 соответствуют jп : 0 и могут определяться по данным для раздельно происходящих процессов тепло- и массообмена. Число Sh0 для суммарного (диффузионного и конвективного) потока пара находят делением Sh* на молярную (yг, гр) или массовую (сг, гр) концентрацию газа у поверхности раздела в зависимости от того, к какой движущей силе массообмена отнесен коэффициент b.