Перенаправленные реакции — это реакции, в которых отдельные молекулы одного и того же химического вещества с одинаковой степенью окисления входят в разные вещества и образуют новые молекулы того же продукта.
Реакции окислительно-восстановительные (часть С)
Многообразие классификации химических реакций по различным признакам (количество и природа реакторов, образующиеся вещества, направление, фазовый состав, тепловые эффекты, использование катализаторов) можно дополнить еще одним признаком. Эта характеристика представляет собой изменение степени окисления отдельных химических веществ, образующих реакцию.
Состояние окисления людей химических элементов после реакции не изменилось. Однако в реакции между соляной кислотой и цинком
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород — с 35001$ на
Окислитель и восстановитель. Окисление и восстановление
Под восстановлением понимается процесс соединения электронов индивидами, ионами или молекулами.
В этом процессе степень окисления снижается.
Например, неметаллические индивиды могут приобретать электроны, которые преобразуются в отрицательные ионы, т.е. путем восстановления.
Электроны также могут присоединяться к катионам, превращая их таким образом в персоны.
Катионы могут набирать электроны и поэтому имеют более низкую степень окисления.
Лица, ионы или молекулы, получившие электроны, называются окисленными веществами.
Окисление — это процесс, в ходе которого человек, ион или молекула отдают электроны.
Например, атом металла теряет электрон и становится положительным ионом. Другими словами, они окисляются.
Отрицательные ионы могут отдавать электроны:.
Некоторые положительные ионы с более низкой степенью окисления также могут терять электроны.
Обратите внимание, что это увеличивает степень окисления.
Лицо, ион или молекула, передающие электроны, называются восстановителями.
За окислением всегда следует восстановление и наоборот. Другими словами, реакция окисления-элиминирования — это объединение двух противоположных процессов: окисления и восстановления. Как показано на схеме ниже, можно представить картину взаимосвязи между процессами окисления и восстановления и изменениями в окислительной ситуации.

Зная тип вещества и определив степень окисления входящих в него химических людей, нетрудно предсказать, какими свойствами обладает каждый элемент и вещество в целом. Например, азот и азотная кислота обладают только окислительными свойствами, поскольку азот в азотной кислоте $ HO_3 $ имеет максимальную степень окисления $ 35005 $, т.е. все электроны теряются.
Азот $$$ аммиака имеет минимальную степень окисления $ -3. Это означает, что никакие другие электроны не могут быть задействованы, поэтому аммиак обладает только восстановительными свойствами.
Оксид азота (II)$$$. Азот в этом соединении имеет промежуточную степень окисления и поэтому обладает окислительными (например, $ n^+2ē→n^0 $ или $ n^+5ē→n^$$) и восстановительными (например, $ n^-2ē→n^$$) свойствами.
$, а цинк — с
Метод электронного баланса
В окислительно-восстановительных реакциях число электронов, отнесенных к восстановителю, равно числу электронов, принятых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса используется для записи электронных уравнений процессов окисления и восстановления.
Например, реакция алюминия с хлоридом меди(II) показана на рис.
Электронное уравнение имеет вид.
Молекулярное уравнение для этой реакции:.
Покажите, как метод электронного равновесия можно использовать для корректировки коэффициентов в сложных окислительно-восстановительных уравнениях. Хорошо известно, что первое правило из серии тенденций взаимодействия металлов с кислыми растворами не применимо к концентрированным серной и азотной кислотам любой концентрации.
В отличие от соляной кислоты, где катион водорода был окислителем для атомов металла, в серной и азотной кислоте окислителями являются атомы серы и азота из серы и нитрат-ионов. Таким образом, $H_2SO_4 $ (концентрация) и $HNO_3 $ (любая концентрация) взаимодействуют с металлами в порядке напряжения как до, так и после водорода, восстанавливая их до $SO_2 $, $NO$ и т.д. Например, при взаимодействии меди с разбавленной азотной кислотой образуется нитрат меди(II), оксид азота(II) и вода. Опишите тип исходного и конечного вещества с указанием степени окисления.
Подчеркните признаки химических элементов, которые изменили свою степень окисления.
Составьте электронное уравнение. Другими словами, захватите процесс подачи и присоединения электронов.
Поставьте коэффициент $3$ перед $Cu ^ 0$ и перед типом нитрата меди (II), которым является $Cu ^ $. Это объясняется тем, что при таких значениях степени окисления медь появляется поочередно. Поместите коэффициент $ 3500 только перед типом вещества $ N ^ $. Это связано с тем, что данное значение степени окисления азота появляется только один раз в схеме реакции, но коэффициент не пишется перед $ HNO_3 $, так как $ N. ^ $ снова появляется в уравнении $ Cu(NO_3)_2$. Регистрация осуществляется в следующей форме
где число атомов азота одинаково. После реакции $3-2= $6$ Cu(NO_3)_2$ и еще два 3500NO$, итого $8$.
Поэтому запишите коэффициент $8$ перед $HNO_3$.
Затем уравняйте количество атомов водорода: $HNO_3$.
Подсчитайте количество атомов кислорода до и после реакции, чтобы проверить порядок коэффициентов. До реакции — $24$ и после реакции — $24$. Коэффициенты верны, поэтому замените стрелки в уравнении на знак равенства.
$ до $35002. Таким образом, в этой реакции каждый атом водорода приобрел один электрон.
И каждый атом цинка отдал два электрона:.
Химические реакции, в результате которых изменяется степень окисления атомов химических элементов или ионов, входящих в состав реактива, называются окислительно-восстановительными реакциями.
Коррозия металлов
Когда металлы взаимодействуют с веществами в окружающей среде, на их поверхности образуются соединения, свойства которых сильно отличаются от свойств самого металла. В повседневной жизни часто повторяются слова «ржавчина» и «ржаветь», а на изделиях из железа и его сплавов можно увидеть коричневато-желтый налет. Ржавчина является частным случаем коррозии.
Коррозия — это естественное разрушение металлов под воздействием внешней среды.
Однако почти все металлы подвержены коррозии, что приводит к снижению (или полной потере) многих свойств, таких как снижение прочности, пластичности, блеска и проводимости, увеличение трения между движущимися частями машины, изменение размеров аксессуаров и т.д.
Коррозия металла может быть постоянной или локализованной.
Первое не так опасно, как второе, и его последствия можно учесть при проектировании сооружений и оборудования. Потеря металла незначительна, но локальная коррозия гораздо опаснее. Одним из самых опасных видов является коррозия. Это означает одновременное образование проникающих поражений, т.е. полостей (впадин), которые выглядят как точки, снижая прочность отдельных компонентов и надежность конструкции, устройства и установки.
Коррозия металла наносит значительный экономический ущерб. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей двигателей, судов, мостов и различных видов оборудования.
Коррозия снижает надежность металлических конструкций. Потенциал катастрофы обуславливает необходимость переоценки долговечности некоторых продуктов (например, компонентов самолетов, лопаток турбин). Это означает, что расход металла должен быть увеличен, что приводит к дополнительным экономическим затратам.
Коррозия может привести к остановке производства из-за замены неисправного оборудования и к потере сырья и продукции из-за разрушения газо-, нефте- и водопроводов. Необходимо также учитывать ущерб, наносимый окружающей среде в результате разливов нефти и других химических веществ, и, в конечном счете, здоровью человека. Коррозия может привести к загрязнению продукта, что в свою очередь может привести к снижению качества продукции. Затраты на восстановление после коррозионных потерь огромны. На их долю приходится 30% годового производства металлов во всем мире.
Из всего вышесказанного становится ясно, что поиск способов защиты металлов и сплавов от коррозии является очень важным вопросом. Они весьма разнообразны. Однако, чтобы сделать выбор между ними, необходимо знать и учитывать химию процесса коррозии.
По своей химической природе коррозия — это процесс окисления. В зависимости от среды, в которой она возникает, существуют различные виды коррозии.
Наиболее распространенными видами коррозии являются химическая и электрохимическая.
Химическая коррозия возникает в непроводящих средах. Этот тип коррозии возникает при взаимодействии металлов с сухими газами или жидкостями, не являющимися электролитами (например, бензин, парафин). Этому виду коррозии подвержены компоненты и узлы двигателей, газовых турбин и ракетных систем. Химическая коррозия часто возникает при обработке металлов при высоких температурах.
Большинство металлов окисляются кислородом воздуха, образуя на поверхности оксидную пленку. Если эта пленка прочная, плотная и прочно прилипает к металлу, она защищает металл от разрушения. Такие защитные пленки появляются на $ Zn, Al, Cr, Ni, Pb, Sn, Nb и Ta$. В случае с железом он рыхлый, пористый и легко отделяется от поверхности, тем самым не защищая металл от дальнейшего разрушения.
Изменение степени окисления всегда означает переход электронов от одних частиц к другим. То есть одни частицы отдают электроны в ходе химического или электрохимического взаимодействия, а другие частицы принимают. Здесь срабатывает Закон сохранения материи..
Восстановитель и окислитель как определить
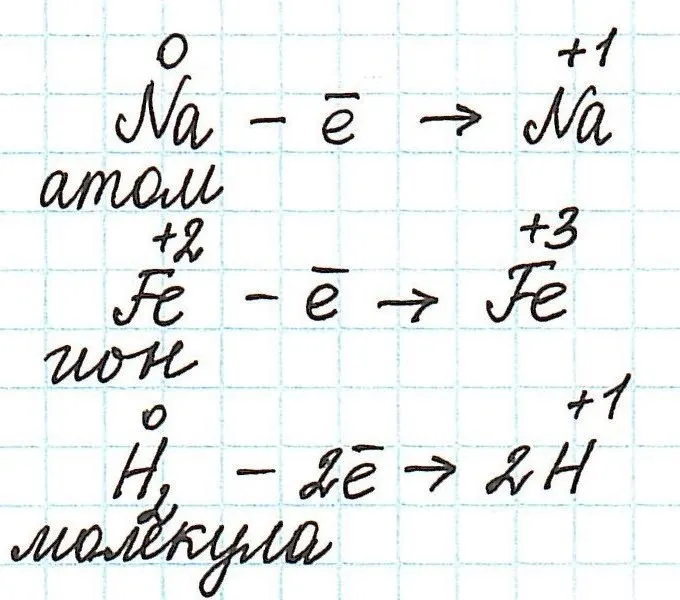
Ключевые слова по контуру: окислитель, восстановитель, окисление, восстановление.
Окислитель — это вещество, атомы, молекулы или ионы которого принимают электроны. Восстановитель — это вещество, атомы, молекулы или ионы которого высвобождают электроны. Окислителями и восстановителями также могут быть элементы, атомы которых отдают или принимают электроны. Когда элемент окисляется, его степень окисления понижается. Когда элемент восстанавливается, его степень окисления повышается.
Окисление, т.е. процесс пожертвования электронов атомами, молекулами или ионами, повышает степень окисления элемента. Восстановление — процесс получения электронов от атома, молекулы или иона — уменьшает степень окисления элемента.
Окислители
Среди простых веществ окислительные свойства являются типичным неметаллическим свойством (F2, кл2, bg2, I2, o2, � 3(�). Галоген, как средний окислитель, приобретает некоторую степень окисления -1, и его окислительные свойства ослабевают от фтора к иоду. Кислород приобретает некоторую степень окисления в виде убывающей -2 (h2o или oh-).
В кислородсодержащих кислотах и их солях, плотной серной кислоте, азотной кислоте, нитрате4 -, хроматический кро4 2 и CR2o7 2-.
Концентрированная серная кислота обладает окислительными свойствами, поскольку сера является наиболее окисляемым +6. Продуктами восстановления серы являются2 (сера +4 степени окисления), сера — простое вещество (сера в степени окисления), сероводород (сера -2 степени окисления).
Азотная кислота обладает окислительными свойствами благодаря окислительной способности азота и HNO в высшей степени окисления +53 которая увеличивается с ростом концентрации. Синтез продуктов восстановления азотной кислоты зависит от активности восстановителя, концентрации кислоты и температуры системы.
Кислородсодержащие галогенированные кислоты (например, HCLO, HCLO3, hbro3) и соли, действующие как средний окислитель, обычно снижают степень галогена-1 (для хлора и брома) и 0 (для йода). Например, 5xlo3 + 6p = 5kcl + 3p2o5
Водород с некоторой степенью окисления + 1 действует преимущественно как окислитель в растворах кислот (как правило, взаимодействие с металлами в области напряжения до водорода): Zn + H2Итак.4 (разбавление) = ZnSO4 +н2↑ (разбавление)
Может также действовать как окислитель при взаимодействии с сильными восстановителями, водородом и компонентами воды.2O + 2NA = 2NAOH +H.2↑н2o + nah = naoh + h2↑ (разбавление)
Ионы металлов с наиболее высокой степенью окисления (например, Fe 3+, Hg 2+, Cu 2+) преобразуются в ионы с более низкой степенью окисления как среднее значение окисления: 2FECL3 + h2S = 2FCL2 + s + 2hcl
Восстановители
Типичными восстановителями являются реакционноспособные металлы (щелочи и щелочные земли, алюминий, цинк, железо и т.д.) и некоторые неметаллические элементы, такие как водород, углерод (в виде карбона или кола), фосфор и кремний. В кислой среде минералы окисляются положительно заряженными ионами.
Углерод чаще всего окисляется CO или CO -монооксидом2; под воздействием сильных окислителей фосфор окисляется с образованием фосфата h3ro.4.
Кислоты без кислорода (HCL, HBG, HI, H2s) и их соли; восстановителями являются анионы, которые окисляются с образованием простых веществ. В порядке галогенидов восстановительная способность увеличивается от Cl- к i-.
Металлы в промежуточном состоянии окисления (например, ионы SN 2+, Fe 2+, Cu+, Hg 2+) могут повышать свою степень окисления при взаимодействии со средствами окисления: 2FECL2 + кл2 = 2FECL310feso.4 +2 кмно.4 + 8 часов.2Итак.4 = 2mnso.4 + 5fe2(так.4)3 + k2Итак.4 + 8 часов.2O.
Образец выполнения задания ОГЭ.
Распределение. Состояние окисления азота аммиака и нитрата калия равно 1)-2 и +5 соответственно 2)-3 и +5 3)+3 и +5 4)-4 и +3
Решение. Определите степень окисления аммиака и нитрата натрия.
Обратите внимание, что для аммиака степень окисления азота отрицательна, поскольку электронов азота больше, чем электронов водорода.
Пассивные металлы — это оксидные металлы, которые переводят поверхность металла в инертное состояние, образуя на поверхности металла тонкий слой инертных соединений, в данном случае в основном не реагирующих с азотной кислотой по концентрации.
Окисление и восстановление
Процесс, в ходе которого вещество присваивает себе электроны, называется окислением — степень окисления увеличивается. Обратный процесс — принятие электронов — называется восстановлением. Оба процесса происходят одновременно. Окисление одного элемента уменьшает другой.
Наиболее часто используются следующие редукторы
- Металлы
- Водород
- Уголь
- Окись углерода (II) (CO)
- Сероводород (H2S)
- Оксид серы (IV) (SO2)
- Сернистая кислота H2Итак.3 и её соли
- Галогеноводородные кислоты и их соли
- Катионы металлов в низших степенях окисления: SnCl2, фекл2, МНСО4, cr2(так.4)3
- Азотистая кислота HNO2
- Аммиак NH3
- Гидразин NH2NH2
- Оксид азота(II) (NO)
- Катод при электролизе
Используются следующие средства окисления
- Галогены
- Перманганат калия(KMnO4)
- Манганат калия (K2mno4)
- Оксид марганца (IV) (MnO2)
- Дихромат калия (K2cr2o7)
- Хромат калия (K2Кро4)
- Азотная кислота (HNO3)
- Концентрированный раствор серной кислоты (H2Итак.4)
- Оксид меди(II) (CuO)
- Оксид свинца(IV) (PbO2)
- Оксид серебра (Ag2O)
- Пероксид водорода (H2o2)
- Хлорид железа(III) (FeCl3)
- Бертоллетова соль (KClO3)
- Анод при электролизе
В зависимости от условий реакции некоторые вещества могут быть как средством окисления, так и средством восстановления. В основном, это вещества людей в промежуточных состояниях окисления.
- Оксид серы (IV) (SO2)
- Сернистая кислота H2SO3 и её соли
- Пероксид водорода (H2O2)
- Азотистая кислота HNO2 и ее соли
Уравнение редокс
Окислительно-восстановительная реакция (от redore-reference-oxidation) уравнивается в два этапа: реакция расщепляется на два полусущества окисление и восстановление, каждое из которых математически уравнивается по отношению к массе вещества, затем математически уравнивается. Количество электронов, затем обе реакции объединяются, уравнивая количество электронов в обеих реакциях.
1. проанализируйте реакцию: Fe 2+ → Fe 3+ — окисление I2 → i- уменьшение
2. уравнять по массе: Fe 2+ -E- → Fe 3+ — окисление I2 + 2e- → 2i-восстановленный
Окислительные реакции — это химические реакции, происходящие путем изменения окислительного статуса индивида, реакция, осуществляемая путем перераспределения электронов между окисляющим и восстанавливающим агентами. Число электронов в конкретном человеке и степень окисления отличаются от числа электронов в процессе окисления в нейтральном состоянии, в котором молекула собирает электроны, и числа электронов в процессе окисления в нейтральном состоянии, в котором молекула уменьшает электроны, и степени окисления, в которой молекула собирает электроны.








