Водородная связь между молекулами воды отмечены черными линиями. Желтые линии показывают ковалентную связь, которая которые удерживают вместе атомы кислорода (красный) и водорода (серый).
Водородная связь
Атом водорода, связаннКовалентный атом с сильно электроотрицательным атомом (кислород, фтор, хлор, азот) может связываться с неподеленной парой электронов другого сильно электроотрицательного атома того же или другого атома. молекулы с образованиеатома этого или другого электроотрицательного атома этого или другого сильно электроотрицательного атома этого или другого слабо комплементарного атома. связи — водородной связью. В этом случае может быть установлено равновесие.
Появление водородной связи определяется исключительностью атома водорода. Атом водорода намного меньше других атомов. Облако электронов, образованномежду ним и электроотрицательным атомом сильно склоняется в сторону последнего. В результате ядро водорода остается почти не экранированным.
Атомы кислорода гидроксильных групп двух молекул карбоновые кислоты, спирты или фенолы могут приближаться друг к другу под действием следующих факторов образования водородных связей.
Положительный заряд ядра водорода и отрицательный заряд другого электроотрицательного атома притягивают друг друга. Энергия их взаимодействия сравнима с энергией первого взаимодействия связи, так, что протон оказывается связаннодновременно с двумя атомами. Связь со вторым электроотрицательным атомом может быть сильнее, чем с первым. связь.
Протон может перемещаться от одного электрона к другому. Энергетический барьер для такого перехода пренебрежимо мал.
Водородные связи Протон может перемещаться от одного электроотрицательного атома к другому. связей умеренной силы, но если есть связей многие из них вносят свой вклад в образованию прочные димерные или полимерные структуры.
Образование водородной связи к $\alpha $-спиральной структуре дезоксирибонуклеиновой кислоты, к алмазоподобной кристаллической структуре льда и т.д.
Готовые работы на аналогичную тему
Положительный конец диполя гидроксильной группы расположен у атома водорода, так что через водород а связь с анионами или электроотрицательными атомами с неподеленными электронными парами.
Почти во всех других полярных группах положительный конец диполя расположен внутри молекулы и поэтому является труднодоступным. для связываПоложительный конец диполя расположен внутри и поэтому труднодоступен. Для карбоновых кислот $(R=RCO)$, спиртов $(R=Alk)$, фенолов $(R=Ar)$ положительный конец диполя $OH$ расположен снаружи. молекулы:
Примеры для нахождения положительного конца диполя $C-O, S-O, P-O$ внутри молекулы:
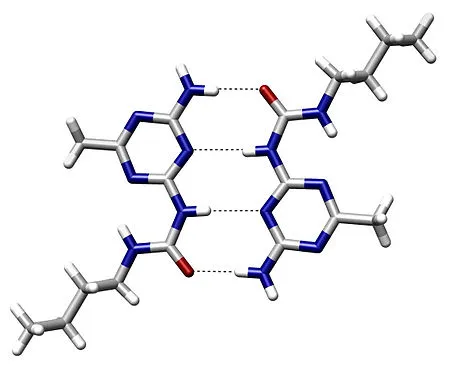
Рисунок 2: Ацетон, диметилсульфоксид (ДМСО), гексаметилфосфотриазид (ГМФТА).
Поскольку стерические препятствия отсутствуют, водородная связь образуется это просто. Его прочность в основном определяется тем, что он в основном ковалентный.
Обычно наличие водородной связи отмечены пунктирной линией. между Он является донором и ресивером, например, для спиртов.
Как правило, расстояние между из двух атомов кислорода и водородной связи меньше суммы ван-дер-ваальсовых радиусов атомов кислорода. Должно существовать взаимное отталкивание электронных оболочек атомов кислорода. Однако сила отталкивания преодолевается силой, которая водородной связи.
Природа водородной связи
Природа водородной связи заключается в электростатическом и донорно-акцепторном характере. Основная роль в формировании энергии водородной связи электростатическое взаимодействие. В образовании межмолекулярной водородной связи В процессе участвуют три атома, которые они находятся почти на одной прямой, но расстояния между между ними, однако, различны. (исключением является связь $F-H\cdots F-$).
Для межмолекулярных водородных связей во льду $-O-H\cdots OH_2$ расстояние $O-H$ равно
Значение межмолекулярной водородной связи
Водородная связь играет важную роль в физических и химических свойствах соединения.
Водородные связи оказывают следующее воздействие на соединения:
вызывают соединение соединений (карбоновых кислот, спиртов), что приводит к высоким температурам кипения этих соединений,
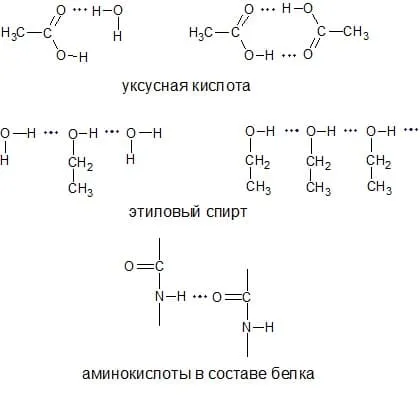
Например, уксусная кислота также существует в газовой фазе в виде димера.
Даже в случае водной фазы соединения все еще находятся в жидком состоянии. образования водородных связей с растворителем значительно повышает их растворимость,
B — димеры способствуют стабилизации ионизированных частиц в растворе, например, междумолекулярные водородные связи в соединениях А,Б,В:
где А — ассоциация молекул спирт, B — димеры карбоновых кислот, C — гидратация молекул спирта.
важны для формирования пространственной структуры нуклеиновых кислот, белков, полисахаридов и других соединений,
участвуют в различных биохимических процессах (синтез мРНК, репликация ДНК),
обеспечивают связывасвязывание препарата с рецепторами и т.д.
,097$ нм, а расстояние $H\cdots O$ равно
Внутримолекулярные водородные связи
В случаях, когда цикл может быть закрыт шестью или пятью членами, образуются внутримолекулярные водородные связи.
Наличие внутримолекулярных водородных связей в салицилатальдегиде и о-нитрофеноле приводят к тому, что их физические свойства отличаются от свойств соответствующих мета- и пара-изомеров.
$o$-гидроксибензальдегид или салицилальдегид (A) и $o$-нитрофенол (B) не образуют межмолекулярныe являются партнерами, поэтому они имеют более низкие температуры кипения. Они мало растворимы в воде, поскольку не связываются с в образовании межмолекулярных водородных связей с водой.
$o$-нитрофенол — единственный из трех изомерных представителей нитрофенолов. который подходит для паровой дистилляции. Это свойство является основой для его дифференциации от смеси изомеров нитрофенола, которая образуется в результате нитрования фенолов.
Его значение pH находится в диапазоне 179 нм.
Энергия большинства водородных связей составляет порядка 10-40 кДж/моль, что намного меньше ковалентной или ионной энергии атомов. связи. Часто можно наблюдать, что сила водородных связей увеличивается с увеличением кислотности донора и основности акцептора протонов.
Азот и кислород являются основой жизни; эти элементы содержатся в особенно высоких концентрациях в углеводах, белках и нуклеиновых кислотах. Если бы между этими веществамесли бы не было сильного контакта через атом Н, жизнь на Земле была бы невозможна.
Содержание
Часто водородную связь как электростатическое взаимодействие, которое усиливается из-за малого размера водорода, которое растворяет близость взаимодействующих диполей. Затем он становится своего рода донорским рецептором. связи, недиахроническое взаимодействие между Атом водорода H, ковалентный связаннA из группы A-H молекулы RA-H и электроотрицательный атом B другого атома молекулы (или функциональная группа этого же молекулы) BR’. Эти взаимодействия приводят к образованию комплексов RA-H—BR’ с различной стабильностью, в которых Атом водорода действует как «мост», связываАтом водорода действует как «мост» между молекулами RA и BR’.
Особенностями водородной связи, по которым Наиболее важными из этих комплексов, которые не являются общеизвестными, являются их низкая прочность,2 их широкое распространение и значение, особенно в органических соединениях,3 и их не очень большой и компактный размер.которые побочные эффекты, связаннОн имеет небольшой размер и отсутствие лишних электронов в водороде.
В настоящее время в контексте теории молекулярных орбиталей водородная связь рассматривается как особый случай ковалентной связи с децентрализацией электронной плотности вдоль атомной цепи. и образованиеm трицентрический тетраэлектрон связей (например, -H—F-F-H—F-).
История
В книге Лайнуса Полинга «Природа химической связи и структура молекул и кристаллов», впервые опубликованной в 1939 году, термин водородной связи приписывается Муру и Уинмиллу. Они использовали водородную связь, утверждать, что гидроксид триметиламмония имеет более слабое основание, чем гидроксид тетраметиламмония. 4 Описание водородных связей в воде была проведена Латимером и Родебушем 5 в 1920 году.
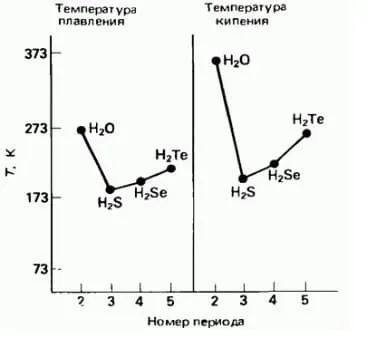
Энергия водородной связи значительно ниже, чем энергия обычного ковалентного соединения. связи (не более 40 кДж/моль). Однако этой энергии достаточно, чтобы обеспечить корреляцию молекул, т.е. их объединение в димеры или полимеры. Если соединение молекул который имеет необычайно высокую температуру плавления и кипения. веществ, как фтористый водород, вода и аммиак.
Этот тип связи слабее, чем ионные и ковалентные связи, но связей, тем не менее, играет очень важную роль во внутри- и межгосударственных отношениях.молекулярнывзаимодействия. Водород связи во многом отвечает за физические свойства воды и многих органических жидкостей (спиртов, карбоновых кислот, амидов карбоновых кислот, эфиров).
Прочность водородной связи (энтальпия образования комплекс) зависит от полярности комплекса и варьируется от ~ 6 кДж/моль для комплексов молекул галогеноводородных комплексов с инертными газами до 160 кДж/моль для ионных комплексовмолекулярныкомплексы (AHB) ± ; таким образом, для комплекса (H2O-H-OH2) + образованного H2O и H3O + — 132 кДж/моль в газовой фазе.
В воде
Механизм Гротгуса
Необычайно высокая теплоемкость воды, а также теплопроводность многоатомных спиртов объясняется многочисленными водородными связями. Одна молекула воды может образовать до четырех классических произведений водородных связей с соседями (принимая во внимание H-связей до 5-6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водород связи отвечают за многие другие уникальные свойства воды.
Водные кластеры

Водородная связь между молекулами воды отмечены черными линиями. Желтые линии показывают ковалентную связь, которая которые удерживают вместе атомы кислорода (красный) и водорода (серый).
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к образованию так называемых водных агрегатов или водных комплексов. Простейшим примером такого комплекса является водный димер:
\cdots \mathsf» width=»» height=»» />
Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал/моль), что лишь на порядок больше характерной энергии теплового движения при 300 К. В то же время, ковалентная энергия O-H связи в 200 раз больше тепловой энергии. Таким образом, образом, водородные связи Они относительно слабы и нестабильны: предполагается, что они могут легко появляться и исчезать из-за тепловых флуктуаций. В частности, это приводит к тому, что вода считается не «простой», а «связаннжидкость»: вода представлена в виде сети молекул , соединённых водородными связями 6 .








