Карбид кальция CAC.2 Широко используется для производства ацетилена, восстановления металлов и производства цианамида кальция (с использованием карбида кальция при нагревании азота при 1200°C, реакция является внешней и происходит в цианамидной печи).
Кальций играет очень важную роль в организме. На протяжении всей нашей жизни он необходим для здоровья костей и зубов, нормального функционирования сердца и кровеносной системы, движения мышц, передачи стимулов мозга ко всем частям тела и выработки гормонов. Однако человеческий организм не вырабатывает этот микроэлемент самостоятельно, поэтому знание того, в каких продуктах содержится кальций, имеет решающее значение.
Суточная потребность в кальции зависит от возраста и пола.
| Рекомендованные ежедневные дозы кальция в зависимости от пола и возраста | |
|---|---|
| Возраст | Кальций, мг / сутки |
| От рождения до 6 месяцев | 200 |
| Младенцы 7–12 месяцев | 260 |
| Дети от 1 года до 3 лет | 700 |
| Дети 4–8 лет | 1000 |
| Дети 9–13 лет | 1300 |
| Подростки 14–18 лет | 1300 |
| Взрослые 19–50 лет | 1000 |
| Взрослые мужчины от 51 года до 70 лет | 1000 |
| Взрослые женщины от 51 года до 70 лет | 1200 |
| Взрослые от 71 года и старше | 1200 |
| Беременные и кормящие грудью | 1000 |
| На основе данных U.S. Department of Health and Human Services (HHS). | |
Средняя нормальная суточная потребность в кальции немного варьируется в разных источниках.
- СанПиН – 1000 мг/сутки
- Американская академия наук – 1000 мг/сутки
- Codex Alimentarius – 800 мг/сутки
- Принятое в Справочнике Скурихина – 1000 мг/сутки
Чем грозит недостаток кальция
Примерно через 30 лет кости начинают терять кальций. С возрастом потеря костной массы ускоряется, что может привести к остеопорозу и переломам — слабым, хрупким костям. Эта проблема особенно остро стоит у женщин.

— Низкий уровень кальция может привести к проблемам с зубами и кариесу. Гипокальциемия влияет на нервную систему и мышцы, вызывая судороги, онемение и переломы. Кроме того, возникают сердечно-сосудистые проблемы, приводящие к нарушениям свертываемости крови, атеросклерозу, артриту, остеомаляции и депрессии.
Дефицит кальция особенно опасен для детей, так как влияет на их общее развитие. Гипокальциемия в молодом возрасте угрожает развитию скелета и зубов, рахиту и аллергии. Иммунная система ребенка ослаблена, что делает его более восприимчивым к инфекциям и раздражительным.
Как понять, что у вас дефицит кальция
Дефицит кальция особенно часто встречается у женщин в постменопаузе и у тех, кто не употребляет молочные продукты. Молочные продукты являются доступным источником кальция, но люди с непереносимостью лактозы или аллергией на молоко, а также вегетарианцы (не употребляющие продукты животного происхождения) находятся в группе риска.
Сухие, ломкие волосы, отшелушенные ногти, белые пятна и уродства, онемение пальцев, икроножные судороги (особенно ночью), боли в мышцах, потливость кожи головы, частый кариес и посуда, корень носа и бессонница.
— У младенцев до 1 года на дефицит кальция может указывать частый плач, повышенное настроение, медленное заживление альвеолярных промежутков, беспокойный сон и задержка появления зубов. На дефицит кальция может также указывать тот факт, что ребенок не может высоко держать голову, сидеть или ползать в течение длительного времени», — объясняет Мария Чоток. Ногти. Кожа становится очень чувствительной, более склонной к травмам, возникает кровотечение. У детей могут развиться мышечные сокращения по краям и на лице.
Женщинам в перименопаузе и постменопаузе рекомендуется провести тест на плотность. Он указывает на плотность костей и вероятность переломов.
В Анатомо-терапевтической химической классификации (АТХ) есть отдельная подкатегория «H. Гормональные препараты (кроме половых гормонов)» со следующими группами и отдельными кодами: H05 препараты, регулирующие метаболизм кальция.
Кальций
Кальций является элементом четвертого периода и находится в группе PA системы цикла, порядковый номер 20. Электронный тип человека.18AR4S 2, степень окисления +2 и 0. Принадлежит к щелочноземельным металлам. Он обладает низкими электронными (1,04) и металлическими (основными) свойствами. Он образует (в виде катионов) многочисленные соли и бинарные соединения. Многие соли кальция слабо растворимы в воде. По сути, это шестой по распространенности элемент (третий из металлов), но связанный. Недостаток кальция в почве может быть компенсирован кальцием (например, CAC0, CAO, цианамиды).3 CAO, CACN цианамид2 и т.д.).. Кальций, катионы и соединения кальция придают пламени газовой линзы темно-оранжевый цвет (качественное обнаружение).
Серебристо-белый металл, мягкий и податливый. Он находится в жидком воздухе и покрыт пленкой Сао и Ca(OH).2 При нагревании с воздухом он вступает в реакцию с водородом, хлором, серой и тонером.
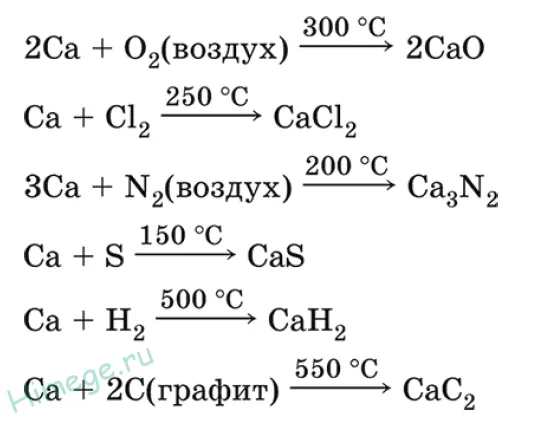
Другие металлы анализируются из оксида (промышленно важный метод — известняк):.

Экстракция кальция в промышленности:.
![]()
Кальций используется как компонент легкоплавких и противогнилостных сплавов, для удаления неметаллических металлов и отделения редких металлов от оксидов.
Оксид кальция СаО
Основные оксиды. Техническое название — известь. Белый, очень гигроскопичный. Имеет ионную структуру Ca 2+ O 2-. Тугоплавкий, термически стабильный, летучий при воспламенении. Поглощает влагу и углекислый газ из воздуха. Он сильно реагирует с водой (с высокой легитимностью), образуя сильный щелочной раствор (возможность осаждения гидроксида), процесс, называемый известковым распадом. Он реагирует с кислотами, оксидами металлов и неметаллов. Используется для синтеза других соединений кальция для производства Ca(OH)2 CA(OH), CAC.2 Минеральные удобрения, как поток в металлургию, как катализатор в органических композициях, как компонент вяжущих материалов при строительстве.
Наиболее важные уравнения реакций:.

Производство CAO в промышленности — известняковый желоб (900-1200°C):.
Гидроксид кальция Са(ОН) 2
Основной гидроксид. Техническое название стирается известью. Белый, гигроскопичный. Имеет ионную структуру Ca 2+(OH-).2. Разлагается при воздействии умеренного тепла. Поглощает воду и углекислый газ из воздуха. Слегка растворим в холодной воде (образуя щелочность), более растворим в кипящей воде. Прозрачные растворы (известь) быстро становятся мутными из-за выпадения гидроксида (суспензия называется кальцием). Качественным ответом на ионы Ca 2+ является перенос углекислого газа через известняк и опускание CAC03 переходят в раствор. Он реагирует с кислотами и кислотными оксидами и участвует в реакциях ионного обмена. Используется для каустического и пресноводного размягчения стекла, известкового отбеливателя, извести и соды, а также для приготовления известняка — тестообразной смеси (песок + известь + вода) и служит связующим веществом и кладке, стенах, штукатурке и других строительных. Твердение («застывание») этих растворов происходит в результате поглощения углекислого газа воздухом.
Наиболее важные уравнения реакций:.

Производство ок (ах)2 промышленность — падение извести по КоАП (см. выше).
Не употребляйте сыр с вином, так как он препятствует усвоению химических веществ. Алкогольная продукция нарушает обмен витамина D и вмешивается в работу кальцитриотиоловых соединений, которые помогают организму усваивать кальций.
Физические свойства кальция и способы получения металла
В обычных условиях кальций является твердым инертным веществом. Металл намерзает при температуре 842°C. Кальций является отличным электрическим и тепловым проводником. При нагревании он сначала превращается в жидкость, затем превращается в пар и теряет свои металлические свойства. Металл очень мягкий и может быть разрезан ножом. Он закипает при температуре 1484°C.
Под давлением кальций теряет свои металлические свойства и способность к электропроводности. Однако его металлические свойства восстанавливаются, и он проявляет сверхпроводящие свойства в несколько раз выше, чем у других элементов.
Кальций долгое время было трудно получить без примесей. Из-за своей высокой химической активности он не встречается в природе в чистом виде. Так было, когда его обнаружили в начале XIX века. Кальций как металл был впервые составлен английским химиком Хамфри Дэви. Узнайте, как твердые минералы и соли реагируют на электричество. Сегодня электролиз кальциевых солей (смесь хлорида кальция с хлоридом калия и смесь фторида кальция с хлоридом кальция) остается наиболее широко используемым методом получения металлов. Кальций извлекается из оксидов вместе с алюминием, что является распространенным методом металлургии.
Химические свойства кальция
Кальций — активный металл, участвующий в ряде взаимодействий. При нормальных условиях он легко образует соответствующие бинарные соединения. Кислород, галогены. Для получения дополнительной информации о соединениях кальция нажмите здесь. При нагревании кальций вступает в реакцию с азотом, водородом, углеродом, кремнием, бором, фосфором, серой и другими веществами. На открытом воздухе кальций вступает в прямую реакцию с кислородом и углекислым газом и покрывается серым налетом.
Кальций бурно реагирует с кислотами и может стать огнеопасным. Кальций обладает интересными свойствами для соли. Например, пещерные алевролиты и каменные лаги представляют собой карбонат кальция, который постепенно образуется под воздействием воды, углекислого газа и углеводородов в результате подземных процессов.
Из-за своей высокой активности кальций обычно хранится в лабораториях в темных герметичных стеклянных контейнерах под слоем парафина или парафина. Качественной реакцией на ионы кальция является сильный черепично-красный цвет пламени.

Кальциевые красители пламенно-красного цвета Викимедиа
Металлы распознаются по нерастворимым осадкам определенных солей элементов (фторид, карбонат, сульфат, силикат, фосфат и сульфат).
Реакция воды с кальцием
Кальций хранится в банках под слоем защитного раствора. Чтобы провести эксперименты, показывающие, как они реагируют с водой и кальцием, металл нельзя удалить и отрезать его части. В лаборатории проще использовать металлический кальций в виде стружки.
Если в бутылке нет кусков металла, а только крупные куски кальция, понадобятся плоскогубцы или молоток. Последний кусочек кальция помещается в бутылку или стакан с водой. Фрагменты кальция помещаются на пластину с марлевыми мешочками.
Кальций погружается на дно, и начинает выделяться водород (там, где вначале происходит пробой свежего металла). Постепенно из поверхности кальция выделяется газ. Этот процесс напоминает бурное кипение с одновременным образованием осадка гидроксида кальция (негашеной извести).

Flickr Гашеная известь.
Количество кальция, унесенного с пузырьками водорода, всплывает. Примерно через 30 секунд вода становится мутной, так как кальций растворяется и образуются гидроксиды. Если реакцию проводить в пробирке вместо скин-стакана, можно наблюдать нагревание. Пробирку немедленно нагревают. Реакция между кальцием и водой не заканчивается эффектным взрывом, но взаимодействие между этими двумя веществами интенсивно развивается и кажется зрелищным. Эксперимент безопасен.
Если мешочек с оставшимся кальцием вынуть из воды и подержать на воздухе, то через некоторое время происходящая реакция приводит к сильному нагреванию и вода, оставшаяся в марле, закипает. Если часть мутного раствора через воронку залить в стакан с кожицей, то при прохождении угарного газа через раствор образуется осадок. Для этого не требуется углекислый газ — воздух, выдыхаемый в раствор через стеклянную трубку, можно продуть.
На более поздней стадии (ближе к цветению) растение нуждается в основном в фосфоре и калии. Затем в настой древесной золы можно добавить нитрат кальция. Общее смазывание усиливает действие каждого удобрения и, следовательно, делает его более эффективным.
Чтобы получать необходимое количество кальция, нужно знать, в каких продуктах он содержится. Ниже приведена таблица овощей и продуктов животного происхождения, богатых кальцием.
Пармезан, рок, российский, швейцарский сыр, бридж, творог, плавленый сыр, мука обезжиренная и цельное молоко, сахар, масло, мороженое, сметана, йогурт, козье и молоко.
Овощи, продукты семьи Холли Уорн.
Огурцы, капуста (белая или красная), соя, морковь, белая фасоль, горох, продажа, консервированные зеленые оливки, тыква.
Свежие фрукты и ягоды, сухофрукты.
Инжир, апельсины, малина, яблоки, изюм, киви.
Рыба и морепродукты
Сардины в масле, лосось, семга, скумбрия, сельдь, карп, треска, форель, консервированная скумбрия, устрицы, крабы и креветки.
Кролик, курица, домашняя птица, говядина.
Семена мака, миндаля, арахиса, грецкого ореха, фундука, кунжута и подсолнечника.
Базилик, петрушка, листья крапивы, салат, кристаллы, шпинат, укроп, лук-порей, зелень.
Список продуктов, содержащих большое количество кальция (количество указано в мг на 100 грамм продукта):.
- мак – 1450;
- сыр «Пармезан» – 1300;
- сухое молоко обезжиренное – 1155;
- сыр «Российский» и сухое молоко цельное – 1000;
- кунжутные семена – 875;
- сыр «Рокфор» – 740;
- листья крапивы – 713;
- сыр «Швейцарский» – 600;
- брынза – 530;
- сыр плавленый – 450.
Все вышеперечисленные продукты, содержащие кальций, могут употребляться детьми, беременными женщинами и спортсменами для укрепления костей и для нормального развития в целом.
Врачи составляют ежедневное потребление молочных продуктов в виде твердого сыра, поскольку эти продукты обогащены лактозой, которая содержит кальций и лучше всего усваивает основные питательные вещества в организме.
Не употребляйте сыр с вином, так как он препятствует усвоению химических веществ. Алкогольная продукция нарушает обмен витамина D и вмешивается в работу кальцитриотиоловых соединений, которые помогают организму усваивать кальций.
Однако не все источники пищи способствуют накоплению химических веществ в организме. Эксперты приводят этот список продуктов, которые снижают содержание кальция.
- крепкий черный чай, кофе, в которых содержится кофеин (также вывести кальций из организма может зеленый чай, но только если пить жидкость в больших дозах);
- различные копчености;
- соленые продукты (если употреблять в больших объемах);
- спиртные напитки.
Стоит уточнить, что продукты, выводящие кальций, могут негативно сказаться на вашем здоровье, если употреблять их в чрезмерных количествах. Поэтому не стоит пренебрегать своим здоровьем. Предпочтительнее есть здоровую и полезную пищу, чем страдать от различных заболеваний.

Взаимодействие с витаминами и минералами
При употреблении продуктов, богатых кальцием, важно знать, какие минералы и витамины этого химического вещества усваиваются организмом, а какие, наоборот, хуже.
Не рекомендуется употреблять кальций вместе с магнием, железом и марганцем, так как кальций препятствует усвоению этих металлов. Эти ключевые питательные вещества следует употреблять отдельно друг от друга.
Врачи также советуют не сочетать кальцийсодержащие продукты с источниками пищи или добавками, содержащими высокую концентрацию фосфора и цинка. Это связано с тем, что последние два элемента не позволяют организму правильно усваивать кальций.
Кроме того, кальций плохо взаимодействует с натрием, особенно в больших количествах. Эта комбинация может снизить уровень концентрации кальция в моче. Стоит отметить, что кальций может выводиться из организма после чашки кофе. В этом случае количество химического вещества может быть уменьшено на 3 миллиграмма.
Однако существуют витамины и минералы, которые работают вместе, чтобы кальций лучше усваивался. Терапевты принимают кальций в комплексе с такими витаминами, как B6, B12, D и K. Кальций полностью усваивается организмом в сочетании с бором и магнием. Такое взаимодействие металлов способствует не только хорошему усвоению кальция, но и замедлению процесса выведения организмом ключевых питательных веществ.
Кальций — очень полезный химический элемент, помогающий укреплять кости и поддерживать организм в хорошем состоянии. Однако важно отметить, что высокое потребление основных питательных веществ может привести к их избытку в организме, что может негативно сказаться на общем состоянии здоровья. Чувство меры необходимо для всех.
Суточный потолок потребления кальция включает в себя поступление этого микроэлемента из всех источников — пищи, напитков и БАДов.








