Типичным веществом с ионной связью является натрий NaCl или поваренная соль. Его кристаллы точно соответствуют всем свойствам.
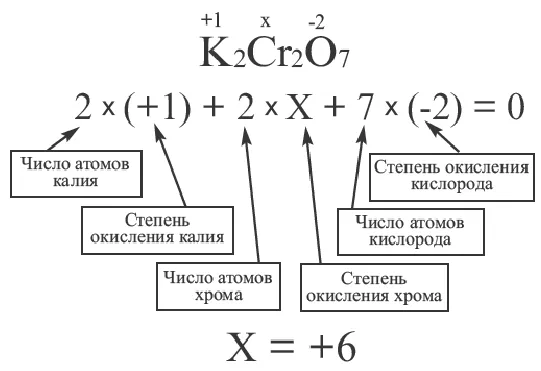
Ионная связь в химии — виды, типы, формулы и определения с примерами
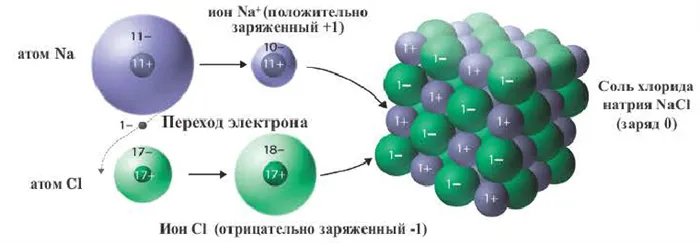
Ионы образуются в результате снабжения или связывания электронов атомами. Атомы, заряженные валентными электронами, становятся положительно заряженными ионами, а атомы, принимающие электроны, становятся отрицательно заряженными ионами. Ионы — это заряженные частицы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. Катионы состоят в основном из металлов и ионов аммония. Сами неметаллы не образуют катионов (кроме H + ). Из уроков физики видно, что положительно и отрицательно заряженные ионы притягиваются друг к другу. Поэтому между положительно и отрицательно заряженными ионами существует взаимное притяжение.
Химические связи, образующиеся между ионами в результате электростатического притяжения, называются ионными связями. Полученные соединения называются ионными или гетерополярными соединениями. Ионные связи образуются между металлами и неметаллами, т.е. между атомами элементов с радикально различной электроотрицательностью. Самые прочные ионные связи возникают в кислородсодержащих и бескислородных солях кислот (например, между металлами (щелочными и щелочноземельными) и галогенами) и оснований. Таким образом, молекула хлорида натрия состоит из ионов натрия (Na+) и хлорид-ионов (Cl).
Свойства ионной связи
Ионная связь имеет несколько характерных свойств.
- В соединениях с ионной связью кристаллы состоят не из молекул, а из множества ионов с противоположными зарядами.
- В обычных условиях бывают в твердом состоянии, не проводят электрический ток.
- Расплавы и водные растворы ионных соединений проводят электрический ток.
- Соединения с ионной связью хорошо растворяются в полярных растворителях, легко вступают в химические реакции.
В солях, образованных щелочными металлами с одинаковыми галогенами, по мере возрастания порядкового номера металла, ионная связь усиливается, что объясняется активностью металла (например, в ряду LiF, NaF, K.F, RbF, CsF ). В различных галогенидах одних и тех же металлов по мере возрастания порядкового номера галогена, ионная связь ослабляется (например, NaF, NaCl, NaBr, NaI). Это объясняется ослаблением окислительных способностей (неметаллических свойств) галогена. В солях аммония также между ионом аммония (NH
В ионно-связанных соединениях число ионных связей равно произведению числа валентных катионов. Соли, содержащие базовые кислородсодержащие ионы и ионы аммония, имеют как ионные, так и полярные ковалентные связи.
В основаниях число полярных ковалентных связей равно числу гидроксильных групп.
В нормальных солях число полярных ковалентных связей равно произведению прочности центральных элементов на их индекс. Однако в кислотных солях число полярных ковалентных связей равно произведению силы центрального элемента и количества H индекса кислотного остатка.
| Вещества | Число ионных связей в молекуле | Число полярных ковалентных связей в молекуле |
| 3 | 3-4=12 | |
 |
2- 3=6 | 3-6=18 |
| Если в соединениях разница электроотрицательностей элементов больше 1,7, то это соединение с ионной связью, а если меньше 1,7, с ковалентной связью. |
Металлическая связь
Химическая связь, образующаяся между положительно заряженным ионом металла и относительно свободным электроном в кристаллической решетке, называется металлической связью. Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Свободные электроны, удаленные от атома, перемещаются между катионами металла, образуя металлические связи, и эти электроны, по-видимому, связывают катионы в металлической решетке.
Металлические связи обладают несколькими характерными свойствами.
- При образовании металлической связи валентные электроны относятся не к двум атомам, а ко всему кристаллу.
- Высокая электро- и теплопроводность металлов, их плавление при высокой температуре и способность отражать свет объясняются металлической связью.
- Металлическая связь характерна для металлов и их расплавов.
По определению, ионные химические связи — это соединения ионов с разными зарядами (положительным и отрицательным). Это особый случай ковалентной связи, т.е. экстремальной поляризации.
Ионная химическая связь
Ковалентные полярные химические связи, в которых электронные пары неравномерно распределены между атомами из-за небольших различий в электроотрицательности атомов (от 0,4 до 2,0), уже были кратко рассмотрены. Для тех, кто забыл, напомним, что электроотрицательность — это способность индивида притягивать к себе электроны.
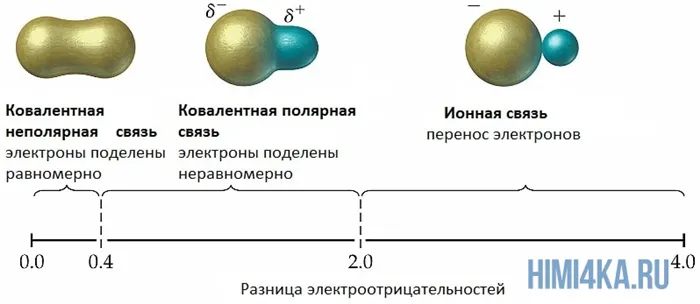
Однако, согласно электроимпульсной панели, если электроны атома отличаются более чем на два, пара электронов будет полностью находиться на наиболее электрифицированном атоме, что приведет к образованию ионно-химической связи. Ионно-химические связи обычно образуются только между металлами (потому что внешние электроны легко теряются) и неметаллами (из-за высоких электронов).
Положительные и отрицательные ионы
Хорошим примером ионно-химической связи является обычная поваренная соль NaCl, имеющаяся на всех кухнях. Отдельный натрий (и вообще все металлы) имеет низкую плотность электронов, в то время как атомы хлора имеют очень высокую плотность электронов, т.е. высокоэлектронные.
Поэтому при образовании молекулы NaCl каждый индивид NA теряет электрон (E-) и образует положительный ион натрия Na+; наоборот, все приобретают этот потерянный электрон натрия и отрицательный хлор Cl -Cl -Cl -Cl -. Это регистрируется как две реакции.
Запись ½ кл.2 Это было необходимо потому, что газ хлор в природе состоит из двухатомных молекул, а не из отдельных индивидуумов хлора.
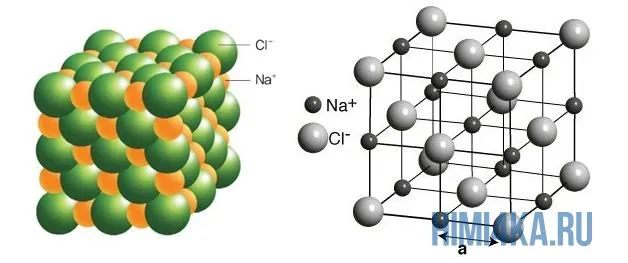
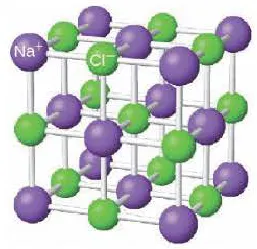
На диаграмме выше показана кристаллическая решетка NaCl. Здесь каждый клонированный ион хлора окружен со всех сторон соседними положительными ионами натрия, а ионы натрия Na+ окружены соседними ионами хлора Cl -Cl-. Этот ионный макет очень стабилен.
Положительно заряженные ионы называются катионами. В основном они содержат металлы, так как они в основном легко отдают от одного до трех электронов. Примерами катионов являются:.
Анионы являются неметаллами, поскольку они охотно присоединяют к себе электроны и превращаются в отрицательно заряженные ионы. Примеры анионов:.

Степень окисления веществ
Простые однопесчаные ионные нагрузки, такие как Mg 2+ или F 2-, называются состояниями окисления. Состояние окисления — это количество электронов, добавленных (повышено) или удаленных (окислено) из иона, возвращая его в нейтральное состояние.
Процесс добавления электронов к человеку, или просто их смещение к этому человеку, называется реактивной реакцией, а удаление электронов от человека, или их полное удаление, называется окислительной реакцией. Это отличный лист с простыми ситуациями ионного окисления.

Пример 12.Окисление или восстановление хлора с образованием ионов хлора? В какой степени окисления находится этот ион? Решение: каждый хлор должен иметь прикрепленный к нему электрон, чтобы образовать ион хлора, поэтому хлор прослеживается. Ион хлора, Cl-, имеет степень окисления -1.
Пример 13.Окисляются ли металлы или убывают при образовании ионов? В какой степени окисления находится ион алюминия? РЕШЕНИЕ: При образовании ионов металлов они окисляются, поскольку с атомов металла удаляются электроны. Степень окисления иона алюминия, Al 3+, равна +3.
Дополнительным способом проверки правильности результатов является оценка физических свойств вещества. Если температура кипения или плавления высока, а электричество нагнетается, то связь, скорее всего, ионная.
Характеристика ионной связи
Химические взаимодействия, возникающие в результате притяжения ионов с разными зарядами, известны как ионные взаимодействия. Это происходит, когда существует значительная разница в электроотрицательности (т.е. способности притягивать электроны) связанных атомов, и электронная пара передается более электроотрицательному элементу. Этот перенос электронов от одного атома к другому приводит к образованию заряженных частиц (ионов). Между ними возникает притяжение.
Типичные металлы имеют самую низкую электроотрицательность, а типичные неметаллы — самую высокую. Поэтому ионы образуются в результате взаимодействия между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая внешние электронные уровни, в то время как неметаллы получают электроны и становятся отрицательно заряженными ионами (анионами).
Атом переходит в более стабильное энергетическое состояние и завершает электронную конфигурацию.
Поскольку электростатические взаимодействия происходят во всех направлениях, ионы могут притягивать ионы противоположного знака во всех направлениях, так как ионные связи являются ненаправленными и ненасыщенными.
Ионное расположение таково, что вокруг каждого из них находится определенное количество противоположно заряженных ионов. Термин «молекула» не имеет значения для ионных соединений.
Примеры образования
Образование связей в хлориде натрия (nacl) обусловлено переносом электронов от атома Na к атому Cl с образованием соответствующего иона.
В хлориде натрия вокруг катиона натрия находятся шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
Во время образования взаимодействий между индивидами в сульфиде бария происходит следующий процесс
Ba отдает свои два электрона сере, образуя анион серы S2- и катион бария Ba2+.
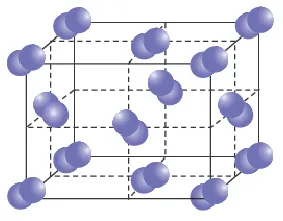
Металлическая химическая связь

Небольшое количество электронов на внешних энергетических уровнях металла легко вытесняется из ядра. В результате такого разделения образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются в объеме металла и постоянно связываются и отрываются от атомов.
Структура металлических веществ следующая. Кристаллическая решетка является основой материала, и электроны могут свободно перемещаться между ее узлами.
Приведите следующие примеры.
Ковалентная: полярная и неполярная
Наиболее распространенным типом химического взаимодействия является ковалентная связь. Значения электроотрицательности взаимодействующих элементов существенно не различаются. В этом соединении только одна общая электронная пара смещается в сторону более электроотрицательного атома.
Ковалентные взаимодействия могут формироваться по обменному или донорно-акцепторному механизму.
Механизм обмена возникает, когда на внешнем электронном уровне каждого атома есть неспаренные электроны, а перекрытие атомных орбиталей приводит к появлению электронных пар, которые уже принадлежат обоим атомам. Если один из атомов имеет одну электронную пару на внешнем электронном уровне, а другой — свободную орбиталь, перекрывание атомных орбиталей приводит к обобщению электронных пар и взаимодействий по донорно-акцепторному механизму.
Ковалентные связи разделяются по кратности следующим образом
Дуал обеспечивает два обобщения электронной пары одновременно, триплет — три.
В соответствии с распределением электронной плотности (полярности) между связанными атомами, ковалентные связи делятся следующим образом
Неполярные связи образуются одинаковыми атомами, а полярные — атомами с разной электроотрицательностью.

Взаимодействие людей рядом с электронами называется неполярной связью. Такая общая пара электронов в молекуле не притягивается ни к одному из индивидуумов, а принадлежит обоим.
Взаимодействие между элементами с разными электронами приводит к образованию полярных связей. Общая пара электронов при таком типе взаимодействия притягивается к наиболее электризованному элементу, но не полностью к нему (т.е. образование ионов не происходит). Если вам нужна любящая, оплачиваемая фея, умеющая заниматься сексом, вы пришли по адресу. По очень доступным ценам многие работники публикуют свои интимные и эротические фотографии и реальные номера телефонов! Девушки-проститутки Пензы могут приехать к вам в гости, пригласить вас побывать в их сауне или ресторане, поразить всех отличной партнершей и закончить вечер горячим и разнообразным сексом. В результате этого смещения электронной плотности человека возникает несколько нагрузок. Наиболее электроотрицательные грузы и наименее положительные.
В индивидуальных кристаллических решетках этих веществ ковалентные связи между индивидами сильны и характеризуются тоношитой и высокой температурой плавления.
Общая характеристика ионной химической связи
Ионы — это заряженные частицы, в которые превращаются индивиды в процессе предоставления или получения электронов. Они сильно притягиваются друг к другу, поэтому вещества с таким типом связи имеют высокие температуры кипения и плавления.
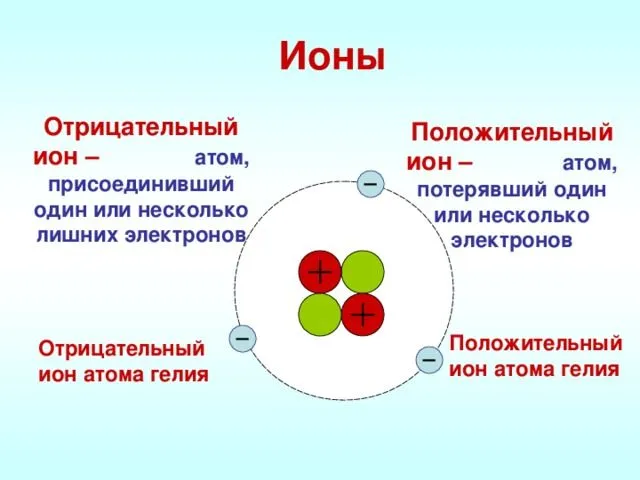
Рисунок 1.Ионы.
Ионные связи — это химические связи между противоположными ионами из-за электростатического притяжения. Разница между электронами связанных индивидов настолько велика, что при полном разделении зарядов это можно рассматривать как предельный случай ковалентной связи.
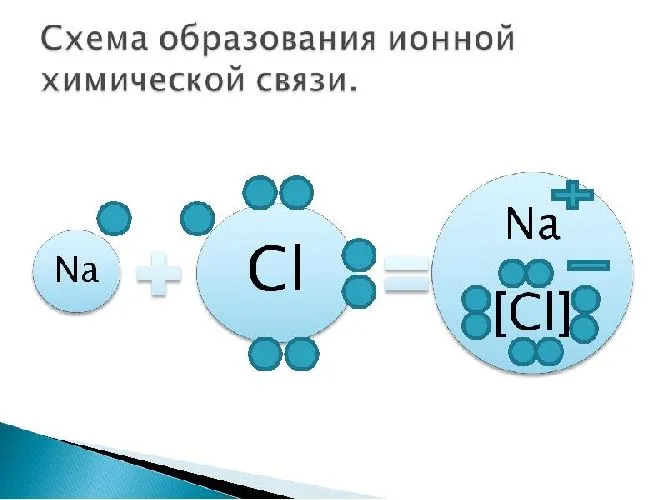
Рисунок 2. Ионная химическая связь.
Обычно говорят, что связь имеет электроотрицательность, если количество электронов в связи > 1,7.
Разница в электронах настолько велика, насколько элементы находятся друг в друге. Эта взаимосвязь характерна для металлов и неметаллов, особенно для тех, которые относятся к наиболее удаленным группам, таким как I и VII.
Примеры: поваренная соль, хлорид натрия NaCl:.
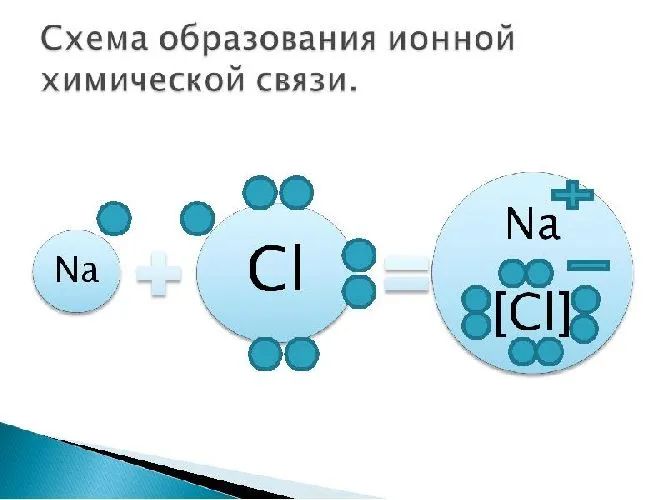
Рисунок 3. Схематическая диаграмма ионной химической связи хлорида натрия.
Ионные связи присутствуют в кристаллах, они прочные, длинные, ненасыщенные и ненаправленные. Ионная связь характерна только для сложных веществ, таких как соли, щелочи и оксиды некоторых металлов. В газообразном состоянии эти вещества существуют в виде ионных молекул.
Ионно-химические связи обычно образуются между металлами и неметаллами. Электроны вынуждены передаваться от металла к неметаллу, образуя ионы. В результате возникает электростатическое притяжение, называемое ионной связью.
На самом деле, полностью ионной связи не существует. Таким образом, ионные связи являются частично ионными и частично ковалентными. Однако сложные молекулярно-ионные связи могут рассматриваться как ионные.
Примеры образования ионной связи
Можно привести различные примеры образования ионных связей.
— Кальцию легче отдать два электрона, чем получить недостающий электрон.
— Фториду, с другой стороны, легче приобрести электрон, чем отдать семь электронов.
Найдем наименьшее общее кратное образовавшегося ионного заряда. 2. Определите количество атомов фтора, которые примут два электрона от атома кальция: 2:1 = 2. 4.
Сформулируйте тип ионно-химической связи.
Натрий относится к основной группе первой группы. Он может легко терять электроны.
-Кислород находится в главной подгруппе шестой группы. Конечно, легче получить два электрона, чем отдать шесть.
Найдем наименьшее общее кратное между образовавшимися ионными зарядами. Это 2:1 = 2. Найдите число атомов натрия, отдающих два электрона атому кислорода: 2,4.
Создайте схему образования ионной связи: 2.5.








