Йодистый водород обладает самой высокой восстановительной активностью среди всех галогенированных водородных соединений. Даже оксиды и соли трехвалентного железа могут окислять его. Сероводород H2S не является таким восстановительным.
Кислоты — классификация, свойства, получение и применение.
Есть причина, по которой кислоты называются серной кислотой. Большинство из них имеют кислый вкус. Некоторые из них хорошо известны всем вам. Например, уксусная кислота, аскорбиновая кислота (также известная как витамин С) и лимонная кислота, которые есть в каждом доме. Однако не обязательно пробовать все кислоты. Кислоты могут быть очень коррозийными. Даже известная аскорбиновая кислота в высоких концентрациях вредна для человеческого организма. Более сильные кислоты, такие как серная кислота, соляная кислота и даже уксусная кислота, могут вызвать сильные ожоги и даже смерть. Поэтому при работе с кислотами необходимо соблюдать осторожность и соблюдать технику безопасности.
| Название кислоты | Формула | Название соли |
|---|---|---|
| Серная | H2Итак.4 | Сульфат |
| Сернистая | H2Итак.3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная (хлористоводородная) | HCl | Хлорид |
| Фтороводородная (плавиковая) | HF | Фторид |
| Бромоводородная | HBr | Бромид |
| Йодоводородная | HI | Йодид |
| Азотная | HNO3 | Нитрат |
| Азотистая | HNO2 | Нитрит |
| Ортофософорная | H3PO4 | Фосфат |
| Угольная | H2используется в качестве растворителя при производстве CO3 | Карбонат |
| Кремниевая | H2SiO3 | Силикат |
| Уксусная | ch3COOH | Ацетат |
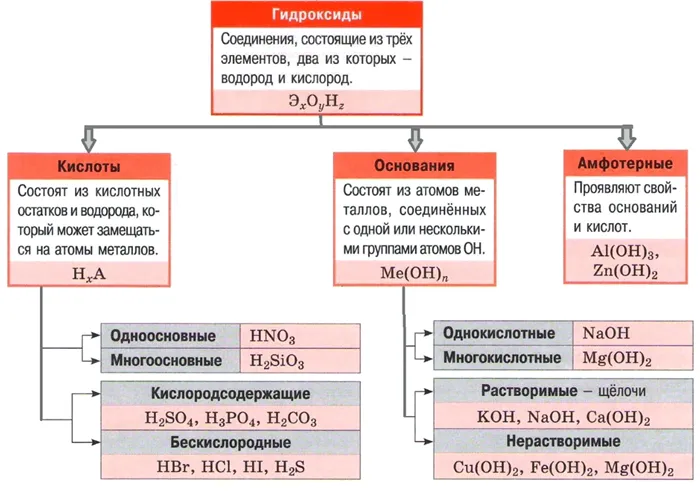
Классификация кислот
| По содержанию кислорода | |
|---|---|
| Кислородсодержащие (H2Итак.4) | Бескислородные (HCl) |
| По количеству содержащихся катионов водорода (H+) | ||
|---|---|---|
| Одноосновные (HCl) | Двухосновные (H2Итак.4) | Трёхосновные (H3PO4) |
Термин «моноосновная кислота» происходит от того, что для нейтрализации молекулы моноосновной кислоты необходима молекула основания. Для дибазовых кислот требуется, соответственно, две молекулы.
| По растворимости (в воде) | |
|---|---|
| Растворимые (HCl) | Нерастворимые (H2SiO3) |
| По силе (степени диссоциации) | |
|---|---|
| Сильные (H2Итак.4) | Слабые (CH3COOH) |
| По летучести | |
|---|---|
| Летучие (H2S) | Нелетучие (H2Итак.4) |
| По устойчивости | |
|---|---|
| Устойчивые (H2Итак.4) | Неустойчивые (H2используется в качестве растворителя при производстве CO3) |
Свойства кислот
Изменение цвета индикаторов в кислой среде
| Индикатор | Нейтральная среда | Кислая среда |
|---|---|---|
| Метилоранж | оранжевый | красный |
| Лакмус | фиолетовый | красный |
| Фенолфталеин | бесцветный | бесцветный |
| Бромтимоловый синий | зеленый | желтый |
| бромкрезоловый зеленый | синий | желтый |
Химические свойства кислот
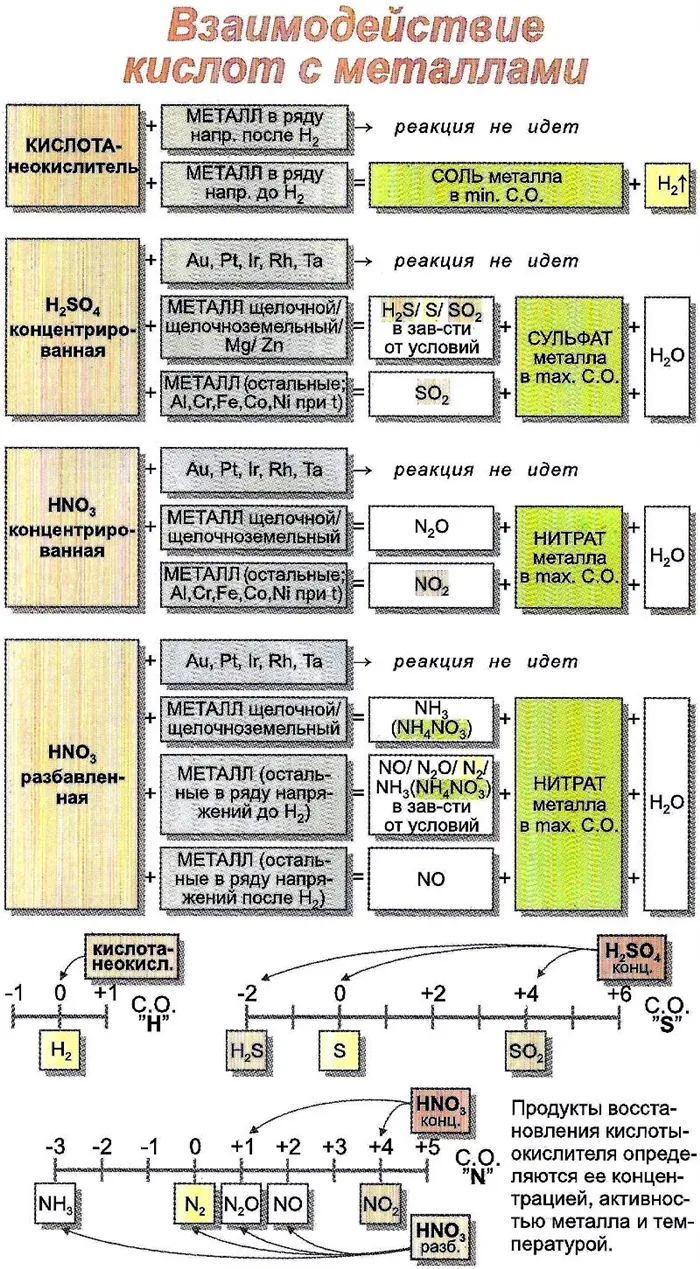
- Взаимодействие с металлами (в ряду активности находящихся до водорода), протекает с выделением газообразного водорода и образованием солей:
H 2 Итак. 4 +2Na → Na 2 Итак. 4 + H 2 ↑
Металлы в активной последовательности после водорода не реагируют с кислотами (кроме концентрированной серной кислоты).
Азотная кислота и концентрированная серная кислота обладают окислительными свойствами, и продукты реакции зависят от концентрации, температуры и природы восстановителя.
H 2 Итак. 4 +MgO → MgSO 4 + H 2 O
H 2 Итак. 4 +2NaOH → Na 2 Итак. 4 + H 2 O
- Кислоты могут взаимодействовать с солями, если в результате реакции будет образовываться нерастворимая соль, или выделяться газ:
H 2 Итак. 4 + K 2 CO 3 → K 2 Итак. 4 + H 2 O + CO 2 ↑
3H 2 Итак. 4 + 2K 3 PO 4 K 3K 2 Итак. 4 + H 3 PO 4
В зависимости от того, является ли кислота концентрированной или разбавленной, цвет индикатора также будет отличаться. Например, если камень погрузить в концентрированную серную кислоту, индикатор покраснеет, тогда как в разбавленной серной кислоте цвет не изменится.
Взаимодействие с металлами
Из предыдущих задач видно, что в водных растворах многие кислоты реагируют с металлами левее H2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и водород, простые газообразные вещества:.

без кислорода (HCl, HBr) и с кислородом (H).2Итак.4, H3PO4) кислоты, например

Как вы знаете, этот тип реакции относится к реакциям замещения. Атом металла замещает (замещает) атом водорода в молекуле кислоты.
Вы должны запомнить металлы в порядке активности справа от H2 (Cu, Ag, Hg и т.д.) не реагируют с кислотами в водном растворе.
Реакции с основными оксидами
Когда вы еще учились в школе, вы узнали, что изменение позиции суммы не меняет сумму: 2 + 3 = 5? 3 + 2 = 5.
В химии действует аналогичное правило. Изменение исходного вещества в уравнении реакции не приводит к изменению продуктов реакции. Так, например, изучив ранее химию основных оксидов, мы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, мы можем с уверенностью утверждать, что кислоты реагируют с основными оксидами с образованием одинаковых продуктов (соль и вода).

Пример уравнения реакции по этой схеме:.
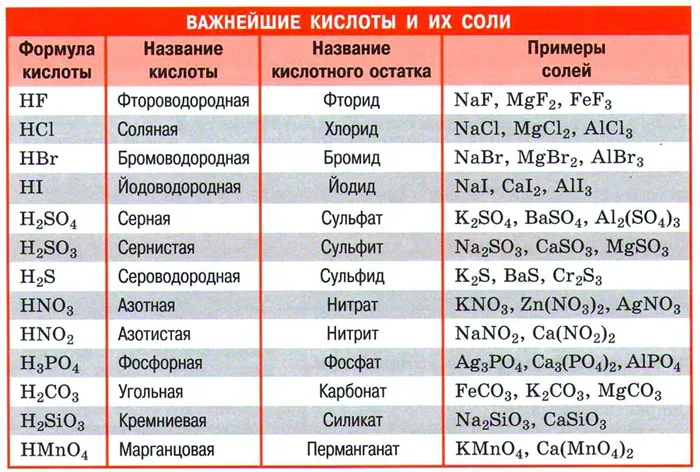
Как вы уже знаете, эти реакции являются реакциями обмена. Это происходит потому, что в процессе взаимодействия исходное сложное вещество обменивается компонентами.
Взаимодействие с основаниями
Изучая химические свойства основания, мы обнаружили, что оно реагирует с кислотами, образуя соль и воду. Что образуется при взаимодействии кислоты с основанием? Да, тот же продукт — соль и вода! Опять же, мы видели, что синтез конечного вещества не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Теперь составим диаграмму в соответствии с реакцией кислоты с основанием.

Помните, что соли атомов металла такие же, как и материнское основание, а яркие остатки такие же, как и материнская кислота.
Например, кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями.
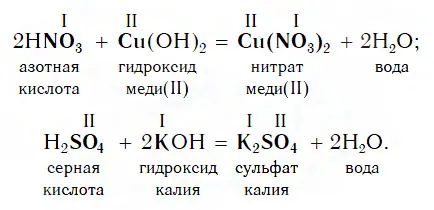
Этот тип реакции, как и предыдущий, является реакцией обмена. Вспомните название реакции, указанное в последнем уравнении. Почему он так называется?
Чтобы правильно решать подобные задачи, необходимо понимать, что каждое последующее деление степени всегда переходит в более низкую степень, чем предыдущее. Это явление основано на увеличении нагрузки кислотных остатков, что только увеличивает силу связи между ними и катионом.
Химические свойства кислот, их классификация и реакции
Кислоты — это сложная категория химических веществ, состоящая из атомов водорода и кислотных остатков.
В основном выделяются кислоты:.
Свойства карбоновых кислот подробно анализируются в статье Карбоновые кислоты (ссылка на статью)
Он выделяется по количеству атомов водорода, которые могут быть замещены в химической реакции.
Уксусная кислота имеет четыре атома водорода, три из которых принадлежат кислотным остаткам и не участвуют в реакциях замещения. В результате получается исключительно уксусная кислота.
Свойства неорганических кислот зависят также от наличия кислорода в их составе и отличаются
Кислотные растворы могут разделять и вертикально электричество. Другими словами, они являются электролитами. В зависимости от степени разделения они бывают

Пособие написано преподавателем кафедры химии Университета им. Книга отличается простотой и ясностью изложения, высоким научным уровнем, многочисленными иллюстрациями, экспериментами и занимательными опытами, что позволяет использовать ее в классах и школах с углубленным изучением естественных наук.
Химические свойства кислот
1. Диссоциация
При растворении кислоты образуются катионы водорода и кислотные остатки.
Многоосновные кислоты разделяются на стадии.
HPO 2-.4 ↔ H + + ro-z-.4 (третий шаг).
2. Разложение
Кислородные кислоты растворяются в оксидах и воде.
Бескислородное образование простых веществ.
3. Реакция с металлами
Кислота реагирует только с металлом, находящимся перед кислородом в диапазоне активности. В результате взаимодействия образуются соли и выделяется водород.
На последней странице E -Book Chemistry 9, курируемой В. В. Ереминым, вы можете найти ряд мероприятий.
Внимательный студент может спросить: «Золото идет после водорода в ряду металлов, но реагирует на «королевскую воду». Как это возможно?»
Из каждого правила есть исключения.
Поскольку азотная кислота содержит азот с серой, имеющие степени окисления +5 и +6, они являются более сильными окислителями, чем ионы металлического водорода. Образуются соли, но водород не выделяется.
4. Реакции с основаниями
В результате образуются соль и вода и выделяется тепло.
Этот тип реакции называется реакцией нейтрализации. Самая простая реакция, которую можно провести на кухне, — это обесценивание соды столовым уксусом или 9%-ным раствором уксусной кислоты.
5. Реакции кислот с солями
Анализируя ионное уравнение (ссылка в статье), помните, что одним из условий реакции является образование нерастворимых солей, выделение летучих газов или слегка растворенных веществ, таких как вода, в процессе взаимодействия. Те же условия применимы к реакциям кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуются соли и выделяется вода.
7. Восстановительные свойства бескислородных кислот
В реакциях окисления первую скрипку играет водород, тогда как в реакциях реакции главную роль играют анионные остатки. В результате реакции из них свободно образуются галогены.
Физические свойства кислот
При нормальных условиях (атмосферное давление = 760 мм рт. ст. температура 273,15 k = 0°C) кислота находится в жидком состоянии, а образующаяся кислота — в твердом. Ортофосфорная кислота h3PO4 или кремниевая кислота h2SiO3.
Некоторые кислоты представляют собой газообразные растворы в воде. Это соляная кислота HF, соляная кислота HCl и грязный водород HBR.
Кислотные свойства кислот возрастают по мере увеличения HF → HCl → HBR → HI.
Некоторые кислоты (гидрохлорид, сульфат, уксусная кислота) характеризуются специфическим запахом.
Благодаря наличию ионов водорода в составе, кислоты имеют характерный кислый вкус.
Химические лаборатории — это не рестораны. В целях безопасности тестирование химических веществ строго запрещено.
Как же узнать, есть ли в пробирке кислота?
Озеро было обнаружено в 1300 году, и с тех пор алхимикам и химикам не приходится рисковать своим здоровьем, проверяя содержимое пробирки. Помните, что озеро становится красным в кислой среде.
Вторым широко используемым индикатором является фенол кожи век.
Простой памятный стишок помогает напомнить, как индикатор работает в различных условиях.
Лакмос — индекс красной кислоты четко показывает. Ламмос — голубой, щелочь здесь — не мешайте, если среда нейтральная, она всегда фиолетовая. Феноловые окуляры в щелочах имеют темно-красный цвет, а в кислотах — бесцветный.
Кислоты — это сложные вещества, обычно состоящие из атома металла и атома водорода, который может быть замещен кислотным остатком. Водные растворы кислот являются кислотными и обладают раздражающими и красящими свойствами.
Дополнительные материалы (схемы, таблицы)
Обзор курса химии 8 класса «Кислоты: классификация, свойства и получение». Выберите дальнейшие действия.
Азотная кислота и концентрированная серная кислота обладают окислительными свойствами, и продукты реакции зависят от концентрации, температуры и природы восстановителя.
Общая характеристика
Кислоты классифицируются как кислородные или бескислородные кислоты, органические и минеральные кислоты.
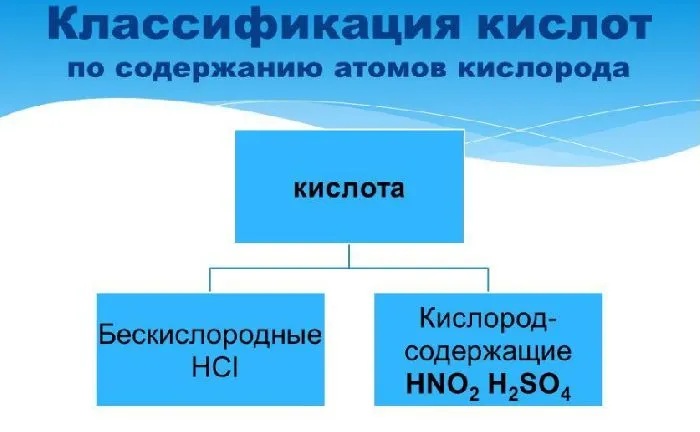
Рисунок 1.Кислоты — кислоты без кислорода или кислородные кислоты.
Кислородные кислоты — это растворы бинарных соединений воды, таких как углеводороды и сероводород. В растворе полярная ковалентная связь между водородом и электрическим элементом поляризуется диполярной молекулой воды, в результате чего молекула распадается на ионы. В принципе, наличие ионов водорода можно назвать водными растворами этих бинарных кислот.
Кислоты называют по названию бинарного соединения, добавляя окончание -ная. Например, HF является гидрофильной кислотой. Анион кислоты называют в честь элемента, добавляя окончание -id. CL — хлорид.
Кислородсодержащие кислоты (кислотные кислоты) — это кислотные гидроксиды, т.е. кислые гидроксиды, которые растворяются в виде протокола. Их общий тип — E(OH)Mon, где E — неметалл или металл с переменной валентностью в высшей степени окисления; N — ноль, поэтому кислота слабая (H2бо3 -борная), если n = 1, то кислота слабая или умеренная (h3PO4 -Тексэкспошат), если n = 2 или более, то кислота считается сильной (h2Итак.4 ).

Рисунок 2.Серная кислота.
Кислотный гидроксид соответствует кислотному оксиду или кислотному дегидрату. Серная кислота соответствует сернистой сере3 .
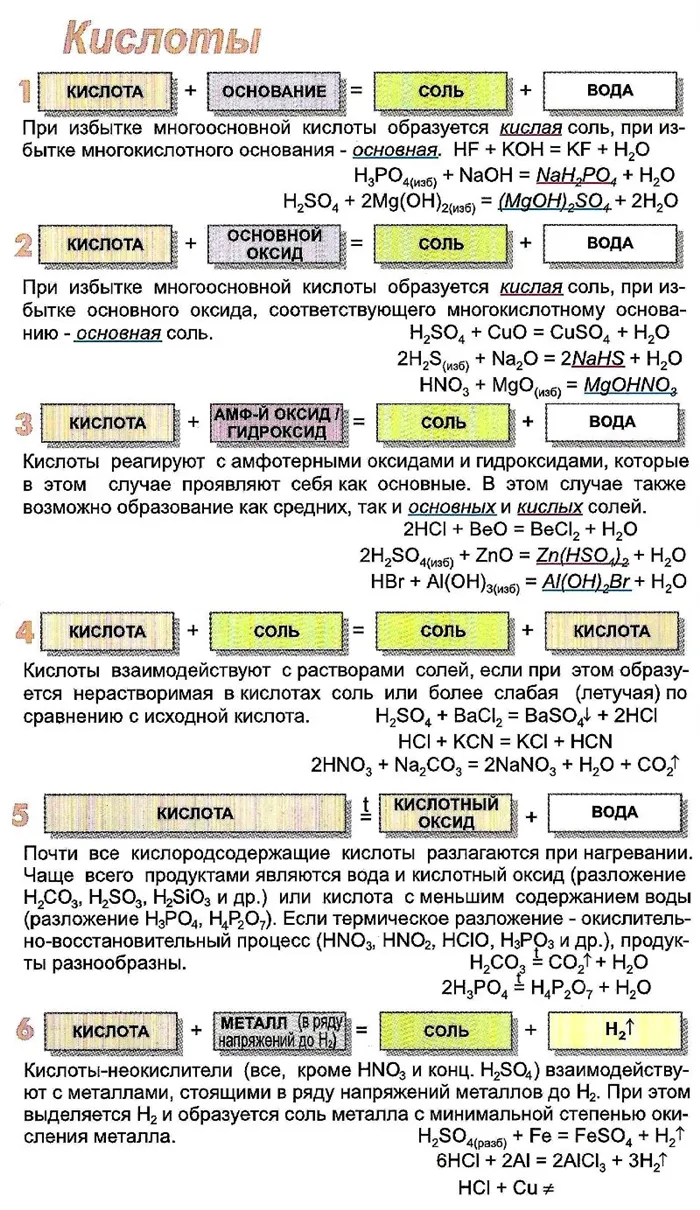
Химические свойства кислот
Кислоты характеризуются рядом свойств, которые отличают их от солей и других химических веществ.
- Действие на индикаторы. Как протолиты кислоты диссоциируют с образованием ионов H+, которые изменяют окраску индикаторов: фиолетовый раствор лакмуса становится красным, а оранжевый раствор метилоранжа становится розовым. Многоосновные кислоты диссоциируют ступенчато, причем каждая последующая стадия идет труднее предыдущей, так как на второй и третьей ступенях диссоциируют все более слабые электролиты:
В зависимости от того, является ли кислота концентрированной или разбавленной, цвет индикатора также будет отличаться. Например, если камень погрузить в концентрированную серную кислоту, индикатор покраснеет, тогда как в разбавленной серной кислоте цвет не изменится.
- Реакция нейтрализации, то есть взаимодействие кислот с основаниями, в результате чего происходит образование соли и воды, идет всегда, если хотя бы один из реагентов сильный (основание или кислота). Реакция не идет, если кислота слабая, основание нерастворимо. Например, не идет реакция:
В других случаях, однако, последует реакция нейтрализации с этими реагентами.
- Взаимодействие кислот с металлами, стоящими в ряду напряжений левее водорода, приводит к процессу, в результате которого образуется соль, и выделяется водород. Эта реакция идет легко, если кислота достаточно сильная.
Азотная кислота и густая серная кислота реагируют с минералами, восстанавливая центры, а не водород.
- Взаимодействие кислот с солями происходит, если в результате образуется слабая кислота. Если соль, реагирующая с кислотой, растворима в воде, то реакция пойдет также в том случае, если образуется нерастворимая соль:
Реакции Na2SiO3 (растворимая кислота пациента) + 2HCl (сильная кислота) = h2SiO3 (слабая нерастворимая кислота) + 2NaCl (растворимая соль).
Многие кислоты используются в промышленности. Кислоты Кислоты необходимы для сохранения мясных и рыбных продуктов.

Рисунок 3.Таблица химических свойств кислот.
Как вы знаете, этот тип реакции относится к реакциям замещения. Атом металла замещает (замещает) атом водорода в молекуле кислоты.
Классификация кислот
- По содержанию кислорода
- бескислородные (HCl, H2S);
- кислородосодержащие (HNO3h2Итак.4).
- Одноосновные (HNO3);
- Двухосновные (H2SEO4, двухосновные предельные карбоновые кислоты);
- Трёхосновные (H3PO4, H3бо3).
- Полиосновные (практически не встречаются).
- Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10 −3 (HNO3);
- Слабые — константа диссоциации меньше 1·10 −3 (уксусная кислота Kw= 1,7·10 −5 ).
- Устойчивые (H2Итак.4);
- Неустойчивые (H2используется в качестве растворителя при производстве CO3).
- Неорганические (HBr);
- Органические (HCOOH,CH3COOH);
- Летучие (H2S, HCl);
- Нелетучие (H2Итак.4) ;
- Растворимые (H2Итак.4);
- Нерастворимые (H2SiO3);


(в этом случае образуется нестабильная угольная кислота)
Некоторые распространённые кислоты


Неорганические (минеральные) кислоты
Кислоты, образованные серой
- Бромсульфоновая кислота
- Дитионистая кислота
- Пероксомоносерная кислота
- Дисерная кислота
- Дисернистая кислота
- Политиосерные кислоты
- Сульфоксиловая кислота
- Тетратионовая кислота
- Тиосернистая кислота
- Фторсульфоновая кислота


Органические кислоты
Интересные факты
- Подземное животное голый землекоп имеет нечувствительные к кислоте клетки кожи даже при pH менее 3,5. 1
- У крокодила в желудке pH бывает меньше 0,5.
H + Li + K + Na + NH4 + Ba 2+ Ca 2+ Mg 2+ Sr 2+ Al 3+ Cr 3+ Fe 2+ Fe 3+ Ni 2+ Co 2+ Mn 2+ Zn 2+ Ag + Hg 2+ HG (в этом случае образуется нестабильная угольная кислота)2 2+ Pb 2+ Sn 2+ Cu + Cu 2+ OH − P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F − P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl − P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br − P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I − P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S 2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н Итак.3 2− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? Итак.4 2− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р Нет.3 − P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р Нет.2 − P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO4 3− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н используется в качестве растворителя при производстве CO3 2− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — ch3COO − P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN − P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO3 2− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ?








