Изучить взаимодействие оксида кальция CaO с водой. Для этого небольшое количество CaO добавляют в стакан воды и хорошо перемешивают. Это вызывает химическую реакцию: CaO затем смешивается с небольшим количеством воды.
Какие металлы взаимодействуют с водой при повышенной температуре
Металлы традиционно делятся на различные группы. Они характеризуются отличной от других металлов химической активностью. Эти группы следующие.
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества со свойствами металлов всегда восстанавливаются в химических реакциях. Положение металла в последовательности активности указывает на то, насколько активен металл в химической реакции (т.е. насколько он восстановлен).
Серия реактивных металлов.
1. чем дальше по шкале в левой части находится металл, тем более сильным восстановителем он является.
2.Металл, расположенный справа от каждого металла в последовательности действий, может быть преобразован в соль. 3.3.
Металлы, расположенные слева от водорода в последовательности действий, могут замещать водород из кислых растворов.
Щелочные и щелочноземельные металлы реагируют с водой во всех водных растворах.
Общие химические свойства металлов
Взаимодействие с простыми неметаллами
1. металлы реагируют с кислородом, образуя оксиды.
Например, при взаимодействии магния с кислородом образуется оксид магния.
Видеоклип:.
Серебро, золото и платина не реагируют с кислородом.
2. металлы реагируют с галогенами (фтор, хлор, бром и йод) с образованием галогенидов.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия. 3:
3. металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка.
Видеоклип:.
Цинк реагирует с серой
4Активные металлы при нагревании реагируют с азотом, фосфором и другими неметаллами.
Например, литий реагирует с азотом, образуя нитрид лития.
Когда кальций взаимодействует с фосфором, образуется фосфид кальция.
Взаимодействие со сложными веществами.
1. щелочные металлы и щелочноземельные металлы взаимодействуют с водой при нормальных условиях с образованием водорастворимых оснований (щелочей) и водорода.
Активный металл + вода → щелочь + водород.
Например, при взаимодействии натрия с водой образуется гидроксид натрия и водород.
Видеоклип:.
Взаимодействие натрия с водой
Некоторые промежуточные продукты реагируют с водой при высоких температурах с образованием оксидов металлов и водорода.
Например, расплавленное железо реагирует с водяным паром с образованием смешанного оксида железа (окалина Fe_3O_4 и водород).
2. металлы, расположенные слева от водорода в последовательности металл-актив, реагируют с кислыми растворами с образованием солей и водорода.
Взаимодействие с простыми веществами
с кислородом
Бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом, если их не нагревать. Это объясняется тем, что бериллий и магний покрыты тонкой защитной пленкой, состоящей из оксидов BeO и MgO соответственно. Их хранение не требует специальной защиты от ветра или влаги, в отличие от щелочноземельных металлов, которые хранятся под слоем инертной жидкости, обычно парафина.
Be, Mg, Ca и Sr при сгорании в кислороде образуют оксиды MeO, а Ba — смесь оксида бария (BaO) и пероксида бария (BaO2).
Следует отметить, что при сгорании щелочно-гибридных металлов и магния на воздухе они реагируют с азотом воздуха, образуя нитриды с общей формулой ME3N2, в дополнение к соединениям металлов с кислородом.
с галогенами
Бериллий реагирует с лошадью только при высоких температурах, а другие металлы группы IIA — уже при комнатной температуре:.
Mg + I2 = MGI2 — йодистый магний
CA + BR2 = CABR2 — кальций бромелиевый
BA + CL2 = BACL2 — хлорид бария
с неметаллами IV–VI групп
Все металлы группы IIA реагируют при нагревании со всеми неметаллами групп IV-VI, но требуют разной степени нагрева, в зависимости от положения металла в группе и активности неметалла. Бериллий — самый химически инертный из всех металлов группы IIA, поэтому для его неметаллических реакций требуются значительно более высокие температуры.
Следует отметить, что реакции металл-углерод могут приводить к образованию карбидов с различными свойствами. Различают гидрокарбиды метана, которые считаются обычными производными метана, где все атомы водорода заменены на металлы. Как и метан, они содержат углерод в степени окисления -4, и при гидролизе или реакции с неокисляющими кислотами одним из продуктов является метан. Существует также другой тип карбида, ацетилененид, который фактически содержит C22-, фрагмент молекулы ацетилена. Карбиды ацетилена образуют ацетилен как один из продуктов гидролиза или реакции с неокисляющими кислотными взаимодействиями. Тип карбида — метанового или ацетиленового — который образуется при взаимодействии металла и углерода, зависит от размера катиона металла. Как правило, метаны образуются с ацетиленом, содержащим ионы металлов малого радиуса и более крупные ионы металлов. Для металлов группы II метан образуется при взаимодействии бериллия с углеродом.
Другие металлы группы IIA образуют ацетилен с углеродом:.
Металлы группы IIA образуют пирит кремния — соединение в форме ME2SI, азота — азот — азот (ME3N2), фосфора — фосфид (ME3P2):.
с водородом
Все щелочноземельные металлы при нагревании реагируют с водородом. Чтобы заставить магний реагировать с водородом, недостаточно одного лишь нагревания, как в случае со щелочными землями, в дополнение к высокой температуре. Также требуется повышение давления водорода. Бериллий не реагирует с водородом ни при каких обстоятельствах.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы положительно реагируют с водой, образуя щелочи (растворимые гидроксиды) и водород. Магний реагирует с водой только при кипячении, так как защитная пленка оксида MGO растворяется при нагревании. В случае берилла оксидная защитная пленка очень прочная. Вода не вступает с ним в реакцию при кипячении или даже в горячем состоянии.
c кислотами-неокислителями
Все металлы главной подгруппы II подгруппы реагируют с неокисляющими кислотами, поскольку в порядке активности они находятся слева от водорода. В результате образуются соли этой кислоты и водорода. Пример реакции.
CA + 2CH3COOH = (CH3COO)2CA + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
Все металлы группы IIA реагируют с редкой азотной кислотой. В этом случае при восстановлении вместо водорода (как в случае неокисляющихся кислот) образуется в основном оксид азота (I) (N2O), а в случае очень разреженной азотной кислоты — нитрат аммония (NH4NO3): оксид азота (N2O)
4mg + 10hno3 (очень разбавленный) = 4mg(no3)2 + nh4no3 + 3h2o
− концентрированной азотной кислотой
Концентрированная азотная кислота пассивирует бериллий при комнатной (или низкой) температуре. Другими словами, он не вступает в реакцию с бериллием. В условиях кипения возможны реакции, которые протекают в основном в соответствии со следующим уравнением
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой. Это означает, что при нормальных условиях он не вступает в реакцию, но в условиях кипения реакция продолжается с образованием сульфата бериллия, диоксида серы и воды.
Be+2H2SO4→BeSO4+SO2↑+2H2O
Барий также пассивируется концентрированной серной кислотой, образуя нерастворимый сульфат бария, который вступает в реакцию при нагревании. Сульфат бария превращается в сульфат водорода бария и растворяется в концентрированной серной кислоте при нагревании.
Другие основные металлы группы IIA реагируют с концентрированной серной кислотой при любых условиях, даже при низких температурах. Сера в основном восстанавливается до сероводорода.
4Mg + 5H2SO4 (агломерация) = 4MgSO4+H2S↑+4H2O
с щелочами
Магний и щелочноземельные металлы не реагируют со щелочами, тогда как бериллий легко реагирует с безводными щелочами в щелочных растворах и плавится. Если реакция протекает в водном растворе, то в реакции участвует вода, а продуктами являются щелочные или щелочноземельные тетрагидроксобутиратные соли и газообразный водород:.
Be + 2KOH + 2H2O = H2↑+K2Be(OH)4-тетрагидроксибутират калия
При реакции с твердой щелочью при плавлении образуются щелочные или щелочноземельные соли бериллия и водород.
Be + 2KOH = H2↑+K2BeO2-калиевый бериллий
с оксидами
Щелочноземельные металлы и магний можно нагревать для восстановления менее активных металлов и некоторых неметаллов из их оксидов. Например
Метод восстановления металлов из оксидов с помощью магния называется магнитотермией.
- Химические свойства щелочных металлов: взаимодействие, получение
- Химические свойства щелочноземельных металлов: взаимодействие, получение
- Химические свойства алюминия
- Химические свойства переходных металлов (меди, цинка, хрома, железа)
Все элементы группы IIA являются s-элементами. Это означает, что плоскость s-sub содержит все валентные электроны. Поэтому электронная конфигурация внешней электронной оболочки всех химических элементов этой группы имеет вид ns 2 где n — номер периода, в котором расположен элемент.
Урок 28. Химические свойства воды
В Уроке 28 «Химические свойства воды» урока «Химия тупых вещей» вы узнаете о взаимодействии воды с различными веществами.

При нормальных условиях вода очень активна по сравнению с другими веществами. Это означает, что он вступает в химическую реакцию со многими из них.
Взаимодействие с оксидами неметаллов
В случае струи монооксида углерода (IV) CO2 (углекислый газ) направляется к воде, часть его растворяется (рис. 109).

В результате химических реакций в растворе образуется новое вещество — карбоновая кислота H2CO3:.
Кстати, Дж. Пристли обнаружил, что, собирая углекислый газ в воде, часть газа растворяется в воде, придавая ей приятный горький вкус. Фактически, Пристли был первым, кто получил такие напитки, как газированная вода и содовая вода.
Комбинированные реакции также происходят в случае твердых оксидов фосфора (V)P2O5 Происходит химическая реакция, в результате которой образуется H-фосфорная кислота3PO4 (рис. 110):.

Испытайте растворы, полученные в результате взаимодействия CO2 и P2O5С водой, метелкокальциевый индекс. Для этого в полученный раствор добавьте одну-две капли раствора индекса. Цвет индекса меняется с оранжевого на красный, что указывает на присутствие кислоты в растворе. Это подразумевает взаимодействие между CO2 и P2O5 h, который фактически образует кислоту в воде.2CO3 и h3PO4.
Оксиды, такие как со2 и P2O5которые образуют кислоты при реакции с водой, называются кислотными оксидами.
Окисляющие кислоты являются оксидами, соответствующими оксидам.
Некоторые из этих кислотных оксидов и соответствующих кислот перечислены в таблице 11. Обратите внимание, что это безотходные продукты. Как правило, неметаллические оксиды являются кислотными оксидами.
Взаимодействие с оксидами металлов
Вода по-разному реагирует с неметаллическими оксидами.
Изучить взаимодействие оксида кальция CaO с водой. Для этого небольшое количество CaO добавляют в стакан воды и хорошо перемешивают. Это вызывает химическую реакцию: CaO затем смешивается с небольшим количеством воды.

В результате образуется новое вещество под названием Ca(OH)2, которое относится к категории основных. Литий и оксид натрия одинаково реагируют с водой. При этом также образуется база, например.

Узнайте больше об основаниях в следующем уроке. Оксиды металлов, основания которых соответствуют основным оксидам.
Основной оксид — это оксид, которому соответствует основание.
В таблице 12 приведены конкретные типы основных оксидов и соответствующие им основания. Обратите внимание, что, как и кислотные оксиды, основные оксиды содержат атомы металлов. Большинство оксидов металлов являются основными оксидами.
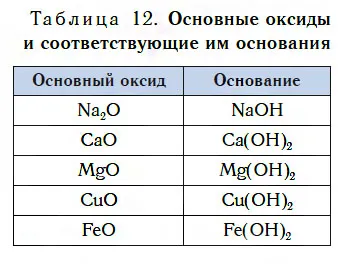
Каждый основной оксид соответствует основанию, но не все основные оксиды, содержащие воду, такие как CAO, взаимодействуют с образованием основания.
При сокрушительно высоких температурах алюминий бурно реагирует с кислородом, выделяя большое количество тепла. В результате образуется оксид алюминия.
Взаимодействие металлов с кислотами. ряд активности металлов
Что такое кислоты? Какие кислотные вещества вы встречали в природе?
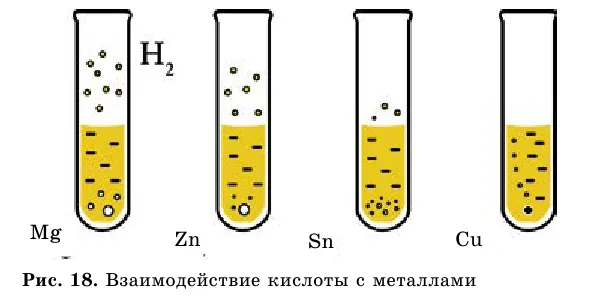
По определению, кислоты должны реагировать с металлами. Все ли металлы реагируют с кислотами? Это можно подтвердить опытным путем.
В четыре пронумерованные пробирки налейте одинаковое количество раствора соляной кислоты и добавьте следующим образом: вторая пробирка — добавьте от второго Зн- к четвертому Зп- к третьему Зп-.
Как видите, не все металлы, включая кислоты, могут взаимодействовать и имеют разные скорости взаимодействия (рис. 18).
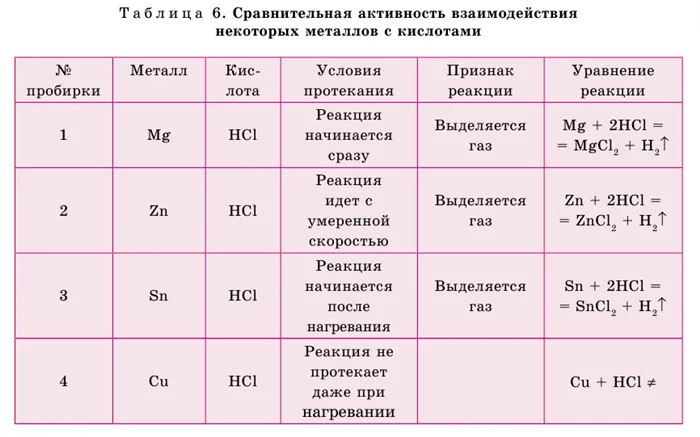
На основе интенсивности взаимодействия металла с кислотой русский ученый н.н. Бекетов составил ряд активностей:.
li k ca na mg al zn fe ni sn pb (h2) cu hg ag au
При использовании серии химических мероприятий необходимо учитывать следующие правила
1) металлы, стоящие в начале этого ряда, химически активны, они могут вытеснить водород из воды. 2) активность металлов в этом ряду снижается слева направо 3) только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот
Активный металл + кислота — > соль + водород
Происходят реакции замещения. Металлы, следующие за водородом в порядке реакционной способности, не реагируют с растворами редких кислот (Таблица 6).
Лабораторный эксперимент 3 Взаимодействие металлов с кислыми растворами
Цель: исследовать реакции различных металлов с кислыми растворами и сделать выводы о наличии химических минералов.

Раствор соляной кислоты наливают в четыре пробирки. В одну пробирку насыпают порошок магния, в другую — зерна цинка, в третью — железную стружку, в четвертую — медную.
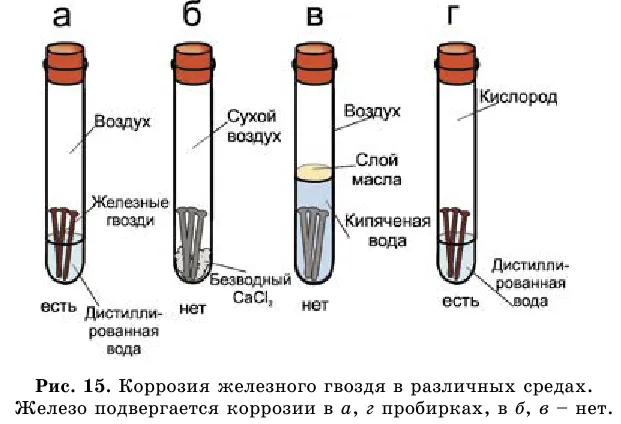
Можно ли разъесть железо? Да, если он очень чистый. Например, в Дели (Индия) есть колонна высотой 7 м и весом 6,5 тонн. Он был заселен в IX веке до н.э. Он содержит 99,72% Fe. До сих пор колонна не подвергалась коррозии.
Взаимодействие металлов с растворами солей
С какими солями вы сталкивались в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы, чем солевые растворы, вызывая реакции вытеснения. Например, железо вытесняет медь из раствора сульфата меди (III) (рис. 19).

Выделение красного налета меди является признаком реакции. Обратная реакция не протекает
Форма реакции смещения выглядит следующим образом
Соль 4 — активный металл = новая соль + новый металл (менее активный)
Этот тип реакции происходит при следующих условиях: 1) соль, с которой происходит взаимодействие, должна быть растворима в воде; 2) новый металл должен быть активен в воде.
Демонстрация трех вытеснений металла из солевого раствора
Цель: Понять, что более активный металл вытесняет менее активный металл, чем его соль.


Поместите гранулу цинка в пробирку и прилейте раствор сульфата меди. В другую пробирку поместите небольшой кусочек железа и залейте раствором сульфата меди. Что вы заметили? Напишите уравнение реакции. Сделайте вывод.
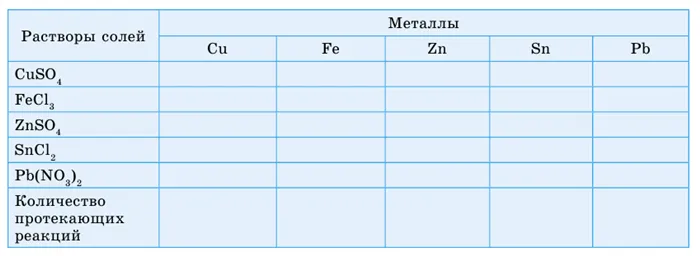
Рабочий лист 1 Сравнение действий с металлами
Цель: Разработать серию мероприятий по металлу. Обобщите результаты и сделайте выводы.
Налейте 5 мл солевого раствора в пять пробирок и поместите медный наконечник в каждую пробирку. Затем повторите эксперимент с другими металлами. Наблюдайте за интенсивностью реакции. Заполните таблицу: где происходят реакции и символы» — «нет». Составьте ряд активности металлов на основе сравнительной интенсивности, т.е. по количеству происходящих реакций.
- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Химическая служба:.
Лекции по химии:.
Лекции по неорганической химии:.
Лекции по органической химии:.
Отправляйте задания в любое время дня и ночи
Официальный сайт Брилёновой Натальи Валерьевны, профессора факультета информатики Екатеринбургского государственного института.
Все права интеллектуальной собственности на загруженный материал сохраняются за бенефициарами этого материала. Коммерческое и/или иное использование запрещено за пределами материалов предварительного изучения NataliblileNova.ru. Публикация и распространение опубликованных материалов не преследует цели извлечения коммерческой и/или иной выгоды.








