Значение пищевых кислот в питании человека определяется их энергетической ценностью и участием в метаболизме. Соотношение энергетической ценности (ккал/г):.
ЖИРНЫЕ КИСЛОТЫ
Жирные кислоты — это алипатиокарбоновые кислоты, большинство из которых входит в состав животных и растительных жиров. В животных и растениях свободные жирные кислоты и жирные кислоты, входящие в состав липидов, выполняют очень важные энергетические и пластические функции. Неизвестные жирные кислоты в организме человека и животных участвуют в биосинтезе особой группы биологически активных веществ — простагландинов (см.). Содержание свободного и связанного в сыворотке крови служит дополнительным диагностическим тестом при различных заболеваниях. Жирные кислоты широко используются при приготовлении различных мыл, резины и резиновых изделий, лаков, эмалей и красок.
В зависимости от количества карбоксильных групп в молекуле различают монобазисные, двухдиплостальные и полибаниевые гликоли. В зависимости от степени насыщенности углеводородных корней различают насыщенные (ненасыщенные) и ненасыщенные (ненасыщенные) гли. В зависимости от числа атомов углерода в структуре различают глиолы нижние (C1-C3), средние (C4-C9) и верхниеnh2no2. Общий тип ненасыщенного глицерила зависит от количества содержащихся двойных или тройных связей.
Для названий глицеридов используется рациональная и систематическая номенклатура. Кроме того, многие глицериды имеют исторически сложившиеся названия. Согласно рациональной номенклатуре, все глицериды считаются производными уксусной кислоты, в которых атом водорода замещен углеводородным корнем в молекуле. Согласно систематической номенклатуре, углеводороды получают свои названия от названий углеводородов. Углеводороды состоят из того же числа атомов углерода, включая углерод-углеродные группы, что и в молекулах углеводородов (пропан — пропановая кислота, этан — Этановая кислота, экзановая — гексановая кислота и т.д.). В названиях ненасыщенных глицеридов указывается количество двойных связей (одинарные, ди-, три- и т.д.) и окончание «eino». Нумерация атомов углерода GH начинается с карбоксильной группы (COOH-) и пишется арабскими буквами. Личность С, ближайшая к группе COOH, называется альфа, ее сосед — бета, а конечный атом углерода углеводородного корня — омега. Г.С. двойная связь Это обозначается числом атомов углерода с двойной связью с помощью символа D или просто CIS или транс-форминг транс. Некоторые из наиболее распространенных глюкоз и их тривиальные, обоснованные и систематические названия приведены в таблице 1.
Содержание
Нижние гликоли представляют собой летучие жидкости с резким запахом, средний — масло с неприятным запахом слив, а верхний — твердое кристаллическое вещество с незначительным запахом.
Только антикислоты (см. ), уксусная кислота (см. ) и пропионовая кислота смешиваются с водой во всех точках; Г.К. Их растворимость быстро уменьшается и в конце концов равна нулю. Спирты и эфиры Г.К. Он достаточно растворим.
Температуры плавления фазовых соединений гликолизов повышаются, но не одинаково. ГК с игольным числом С плавится при более высоких температурах, чем следующая ГК с игольным числом С (табл. 2). В обоих этих рядах (с превосходящим количеством человек) разница температур плавления между двумя следующими членами постепенно уменьшается.
Это своеобразное различие между глицеридами с иго и ненужным числом С в молекуле проявляется в некоторой степени химически, не только в температуре плавления, но и в биологических свойствах. Так, по мнению Г. Эмбдена, если происходит кровоизлияние в печень, глицериды с отличным количеством С-индивидов разлагаются в ацетоне, глицериды с ненужным количеством С-индивидов не распадаются.
G.C. они сильно связаны и даже при температуре выше точки кипения имеют вдвое большую молекулярную массу, чем те, которые возникают из этого типа. Эта корреляция объясняется появлением водородных связей между определенными гликолями.
Химические свойства
Химические свойства гликолей определяются свойствами групп COOH и их углеводородных корней. В группе COOH плотность электронов может легко расщеплять протоны из-за ослабления связи O-H путем смещения электронов к кислороду на двойную связь c = o. Это приводит к постоянному аниону кислоты:.
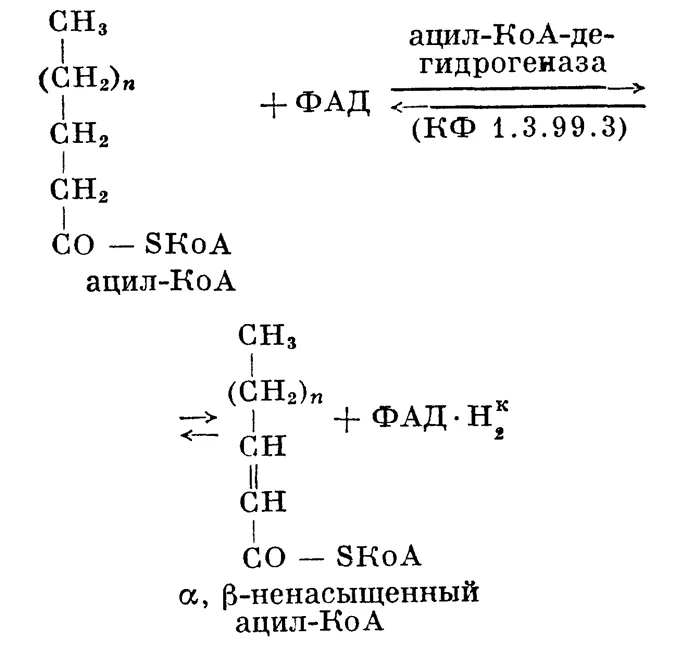
Сродство к электрону карбонильного остатка может быть частично удовлетворено соседней метиленовой группой. Константа разделения для группы COOH в ГК составляет 10 -4 -10 -5 м. Это означает, что его значение намного ниже, чем у неорганических кислот. Миристиновые кислоты — самые сильные аминокислоты. Группы COOH органических кислот могут реагировать с щелочными металлами в водном растворе. Верхние гликолитические соли, содержащие эти металлы, называются мылами (см. ). Мыло обладает свойствами поверхностно-активного вещества — детергента (см. ). Натриевое мыло — твердое, а калиевое — жидкое. Г.К. Они могут быть легко заменены галогенами с образованием пони, которые широко используются в органических композициях. Если галоген замещается другим кислотным остатком, образуются ангидриды LH. При замещении спиртовым остатком образуются сложные эфиры, аммиачный аммиак и гидразин. Наиболее распространенными являются сложные эфиры глицеринового спирта и верхние глицериды — жиры (см.). Водород на углероде A в LC может быть легко заменен галогеном с образованием галогенсодержащего LC. Ненасыщенные ЖК могут существовать в виде СНГ и транс-изомеров. Большинство природных ненасыщенных гликолей имеют цис-конфигурацию (см. изоматизм). Степень ненасыщенности гликолей можно определить по дублированию двойных связей. Процесс преобразования ненасыщенных гликолей в насыщенные называется гидрогенизацией, обратный процесс — дегидрогенизацией (см. гидрогенизация).
Натуральный ГГ получают путем гидролиза (омыления) жиров.
Если в этом процессе участвуют молочнокислые бактерии, то молочная кислота фактически является единственным продуктом реакции. В случае гетерозиготных бактерий, образующих молочную кислоту, помимо молочной кислоты, образуются уксусная и пропионовая кислоты, а также другие продукты ферментации, такие как этанол, диацетил и этилацетилан.
Урок 23. Понятие о кислотах
В курсе «Химия для чайников» вы узнаете о сложных кислотах, их показателях и о том, как они могут помочь.

Вы уже много раз встречали слово «кислота» в наших руководствах. Конечно, вы много раз слышали это слово в своей повседневной жизни. Уксусная и лимонная кислоты используются в кулинарии, а борную кислоту можно найти в аптеках. Серную кислоту добавляют в автомобильные аккумуляторы. Следует отметить, что как в повседневной жизни, так и в производственной деятельности люди в основном используют водные растворы кислот. Поймите эти ассоциации.
Состав кислот
В большинстве случаев молекулы кислот содержат только неметаллические атомы. На рисунке 97 показаны некоторые кислотные сферы и их типы. Что общего у этих молекул? Ответ прост — они содержат атомы водорода.
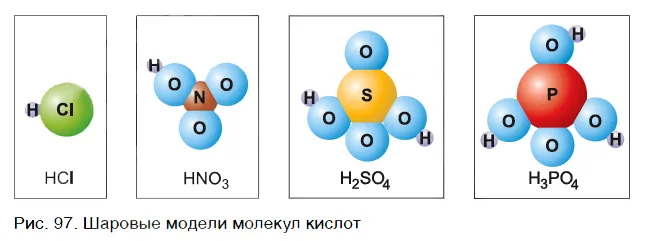
В молекулах хлористого водорода, кроме атома водорода H, имеется атом хлора Cl, в молекулах азотной кислоты — группа атомов NO3и молекулы серной кислоты SO4и молекулы фосфата PO4имеют группу атомов.
Атом Cl, группа атомов NO3Итак.4PO4Другие атомы и группы атомов в кислотах называются кислотными остатками.
Кислоты — это сложные вещества, состоящие из атома металла и атома водорода, который может быть замещен кислотным остатком.
Кислотный остаток молекулы кислоты связан с атомом водорода в соответствии с его валентностью. Как его можно определить? Водород всегда одновалентен. Поэтому, если кислотный остаток молекулы кислоты связан с атомом водорода, его валентность равна 1 (или 2, если он связан с двумя атомами), и 3, если он связан с тремя.
При написании кислотных формул сначала пишется атом водорода, а затем кислотный остаток.
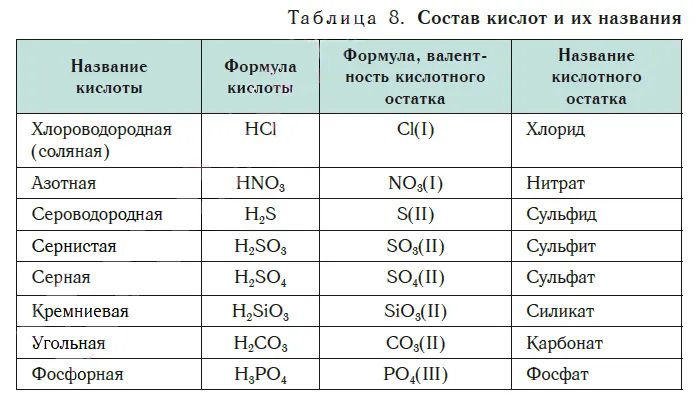
В таблице 8 перечислены названия и типы кислот, встречающиеся при изучении основной химии. Здесь также указаны типы кислотных остатков, входящих в состав этих кислот, их сила и названия.
В нормальных условиях кислоты существуют в жидком и твердом накопительном состоянии. Например, фосфорная кислота H3PO4 твердый при комнатной температуре. Серная кислота H2Итак.4 -это вязкая жидкость без запаха. Он почти в два раза тяжелее воды. Соляная кислота HCl представляет собой водный раствор газообразного хлористого водорода. Исторически известна как соляная кислота. Этот кислотный раствор имеет характерный запах.
В большинстве случаев кислота растворима в воде. Исключением является кремниевая кислота H2SiO3. Растворы соляной, серной и фосфорной кислот бесцветны. Безводная азотная кислота желтеет при хранении.
Поскольку все кислоты содержат атомы водорода, они обладают общими свойствами: 1) изменяют цвет некоторых органических веществ; 2) имеют кислотный вкус (как и в случае с другими веществами, кислотные тесты запрещены. Может вызвать ожоги).3 ) Оказывает коррозионное воздействие на кожу человека, ткани, бумагу, дерево и другие материалы.
Некоторые вещества, например, кислоты, содержат атомы водорода, но не обладают кислотными свойствами.4, аммиак NH3и вода H2O и т.д. Поэтому не все вещества, содержащие атомы водорода, являются кислотами.
Уксусная кислота обладает бактерицидными свойствами, и ее растворы используются в консервировании продуктов питания, медицине, производстве ацетона, крашении и книгопечатании.
Кислоты, их соли и ангидриды
Названия и состав конкретных кислот, их солей (названия кислотных остатков) и ангидридов (кислотных оксидов) приведены в таблице ниже.
| Неорганические | |||||
| Кислота | Формула | Кислотный остаток и его валентность | Кислотный оксид | ||
| Бескислородные | |||||
| одноосновная | фтороводородная (плавиковая) | HF | F- (I), фторид | — | |
| хлороводородная (соляная) | HCl | Cl- (I), хлорид | — | ||
| бромоводородная | HBr | Br- (I), бромид | — | ||
| йодоводородная | HI | I- (I), йодид | — | ||
| двухосновная | сероводородная | H2S | S2- (II), сульфид | — | |
| селеноводородная | H2Se | Se2- (II), селенид | — | ||
| Кислородсодержащие | |||||
| одноосновная | азотистая | HNO2 | NO2- (I), нитрит | оксид азота (III) | |
| азотная | HNO3 | NO3- (I), нитрат | оксид азота (V) | ||
| хлорноватистая | HClO | ClO- (I), гипохлорит | оксид хлора (I) | ||
| хлористая | HClO2 | ClO2- (I), хлорит | оксид хлора (III) | ||
| хлорноватая | HClO3 | ClO3- (I), хлорат | оксид хлора (V) | ||
| хлорная | HClO4 | ClO4- (I), перхлорат | оксид хлора (VII) | ||
| марганцовая | HMnO4 | MnO4- (I), перманганат | оксид марганца (VII) | ||
| двухосновная | сернистая | H2SO3 | SO32- (II), сульфит | оксид серы (IV) | |
| серная | H2SO4 | SO42- (II), сульфат | оксид серы (VI) | ||
| угольная | H2CO3 | CO32- (II), карбонат | оксид углерода (IV) | ||
| кремниевая | H2SiO3 | SiO32- (II), силикат | оксид кремния (IV) | ||
| хромовая | H2CrO4 | CrO42- (II), хромат | оксид хрома (VI) | ||
| трехосновная | ортофосфорная | H3PO4 | PO43- (III), (орто)фосфат | оксид фосфора (V) | |
| (орто)борная | H3BO3 | BO33- (III), (орто)борат | оксид бора (III) | ||
| мышьяковая | H3AsO4 | AsO43- (III), арсенат | оксид мышьяка (V) | ||
| Органические | |||||
| Кислота | Формула | Кислотный остаток и его валентность | |||
| одноосновная | муравьиная | HCOOH | HCOO-, формиат | ||
| уксусная | CH3COOH | CH3COO-, ацетат | |||
| двухосновная | щавелевая | HOOC-COOH | -OOC-COO-, оксолат ((C2O42-) | ||
Свойства кислот
В нормальных условиях кислота находится в жидком или твердом состоянии. Водные растворы кислот изменяют цвет индикатора.
- лакмус: фиолетовый → красный;
- метилоранж: оранжевый → красный;
- универсальный: оранжевый → красный;
Фенолфталеин не реагирует в кислых условиях.
Химические свойства

Реакции с концентрированной серной и азотной кислотой не выделяют водорода, поскольку металл в этом случае окисляется серой S6+ и азотом N5+.
Продуктами реакции являются соль и вода.
Сильные кислоты вытесняют слабые кислоты из солей. Сила кислоты уменьшается слева направо в несколько этапов.
Например, в карбонате кальция CaCO3 плавиковая кислота HF заменяет углекислоту H2CO3.
При нагревании нерастворимые молекулы кислоты распадаются на кислотные оксиды и воду.
Нерастворимые молекулы углекислого газа и серной кислоты разлагаются при взаимодействии с газом и водой.
Кислоты используются во многих отраслях промышленности, включая пищевую, легкую и химическую промышленность, медицину и горнодобывающую промышленность.

Наиболее широко используемыми минеральными кислотами являются серная, азотная, ортофосфорная и соляная. Карбоновые кислоты, такие как щавелевая, уксусная, масляная и муравьиная, также используются в различных областях, от производства продуктов питания до металлургии.
В молочных и молочнокислых продуктах основными органическими кислотами являются молочнокислые бактерии, образование которых связано с биохимическим преобразованием лактозы — молочного сахара, которое происходит под воздействием молочнокислых бактерий (виды лактозы показаны в пункте 1). Согласно уравнению реакции
Как применяют кислоты
Кислоты — это вещества, состоящие из атомов водорода и кислотных остатков. Это соединения, которые необходимы для жизни человека. Кислоты используются во многих областях медицины, промышленности и повседневной жизни. При употреблении пищи люди получают животные и растительные белки. Они расщепляются на аминокислоты. Благодаря им в организме создаются биологические ткани и белковые структуры.

Виды кислот
Существует два типа кислот — органические и неорганические, первые всегда содержат молекулы углерода. Органические кислоты поступают в организм через ягоды, овощи, фрукты и молочные продукты. Некоторые кислоты являются витаминами, например, витамин С и аскорбиновая кислота.
Неорганические кислоты могут быть получены из продуктов питания, но также могут вырабатываться организмом самостоятельно. Соляная кислота содержится в желудочном соке, и ее действие убивает бактерии, попавшие в желудок с пищей. Серная кислота содержится в минеральной воде.
Применение кислот
Серная кислота является кислотой номер один. Он используется в больших количествах при производстве удобрений, синтетических волокон, пластмасс и фармацевтических препаратов. Он используется для зарядки кислотных аккумуляторов и извлечения металлов из руд. В нефтяной промышленности он используется для переработки нефтепродуктов.
Уксусная кислота обладает бактерицидными свойствами, и ее растворы используются в консервировании продуктов питания, медицине, производстве ацетона, крашении и книгопечатании.
Соляная кислота используется в нефтяной промышленности для обработки буровых лент.
Азотная кислота играет важную роль в производстве удобрений, лаков, красок, пластмасс, взрывчатых веществ и фармацевтических препаратов.
Фосфорная кислота встречается в составах для обезжиривания металлических материалов перед нанесением на них защитных покрытий. Он содержится в ингибиторах ржавчины перед покраской и используется в качестве антикоррозийного средства для труб.
Лимонная кислота используется в косметике в качестве разбавителя и консерванта. Благодаря своим отбеливающим, очищающим и вяжущим свойствам используется в очищающих кремах, ополаскивателях для волос, кремах против окрашивания и красках для волос.
Ацетилсалициловая кислота широко используется в медицине, поскольку она эффективна в профилактике сердечно-сосудистых заболеваний, уменьшает образование тромбов и обладает обезболивающими свойствами.
Борная кислота используется в медицине благодаря своим антисептическим свойствам. Он используется для лечения вшей, ушных инфекций, конъюнктивита и раздражений кожи.
Стеариновая кислота используется в производстве мыла. Добавление его в мыло обеспечивает гладкое, мягкое и успокаивающее воздействие продукта на кожу.








