Чтобы контролировать водород, подержите небольшую пробирку на конце газоотводной трубки (в течение 10-20 секунд), держите ее отверстием вниз и приблизьте к огню. Слышен взрыв или жужжащий звук, что указывает на наличие водорода.
Водород как химический элемент в химии — формулы, определение с примерами
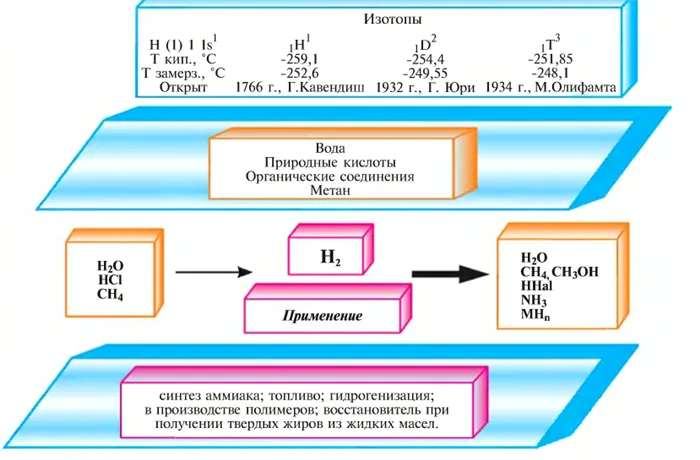
В 1766 году английский ученый Г. Кавендиш открыл «горючий воздух». В 1783 году Жан Шарль из Парижа запустил воздушный шар, наполненный водородом (рис. 25), а в 1787 году А. Лавуазье объяснил, что «горючий воздух», открытый Г. Кавендишем, является частью воды, и назвал его «гидрогениум». Это означает «вода рождается». Сегодня водород представлен первой буквой H в этом слове.
Свободный водород встречается на Земле в небольших количествах.
Он выделяется вместе с другими газами при извержениях вулканов и добыче нефти. Однако он широко распространен в виде соединений. Водород — это элемент, образующий большинство соединений. Он составляет 0,88% от общей массы земной коры и воздуха. Он составляет 1/9 часть массы молекулы воды и является компонентом всех растительных и животных организмов, нефти, природного газа и некоторых минералов.
Определение водорода
Водород — самый распространенный элемент во Вселенной. Она составляет большую часть массы Солнца и других звезд. Водород является компонентом космической газовой туманности, межзвездного газа и звезд, где его атомы превращаются в атомы гелия. В этом процессе происходит выделение энергии (термоядерные реакции), что является основным источником энергии для многих звезд, включая Солнце.

Рисунок 23: Полет воздушного шара, наполненного водородом. Париж, 1783 год.
Эта энергия необходима для многих природных процессов. Солнечная энергия согревает землю, приводит в движение газообразные массы атмосферы и воду в реках, океанах и морях, обеспечивает процесс фотосинтеза в зеленых растениях и, наконец, является фундаментальным условием для существования жизни.
Водород широко распространен на Земле в виде свободной воды, кристаллизационной воды минеральных вод, метана и нефтяных углеводородов, различных гидроксидов, растительной и животной биомассы и органического вещества почвы.
Водород и кислоты
Среди водородных соединений, встречающихся в природе, особое место занимают кислоты (кислые воды).
Вспомните освежающий вкус содовой и других безалкогольных напитков и абрикосового сока, или кислинку ревеня в жаркий летний день. Всем, наверное, знаком кислый вкус лимонов. В природе существует так много кислот, что неудивительно, что они часто встречаются в самых распространенных цитрусовых.
Цитрусовые (лимоны, апельсины, мандарины) содержат лимонную кислоту, свежие фрукты (яблоки, мармелад, колючие груши) содержат яблочную кислоту, листья свиязи и платана содержат щавелевую кислоту, муравьиные брюшки (и пчелиный яд) содержат муравьиную кислоту, а угольная кислота содержится в газированной воде.
Многие люди используют уксусную кислоту в кулинарии, особенно в приготовленных продуктах, также она используется в консервированных овощах. Известно, что уксусная кислота получается в результате ферментации винограда и яблок. Прокисание молока показывает, что причиной является молочная кислота. В сельской местности производят силос, из которого получают молочную, масляную и другие кислоты. Все вышеперечисленные кислоты характеризуются кислым вкусом и являются водородными соединениями.
Такие вещества, как камни, метилхлорид и универсальные маркеры, проявляют разные цвета в кислых растворах. Камни становятся красными, метилхлорид — розовым, а универсальный маркер — красным (рис. 26).
Когда металлы (магний, цинк, железо и медь) взаимодействуют с кислыми растворами (синтетическими неорганическими кислотами), реакции развиваются по-разному.
Таким образом, кислоты — это вещества со следующими общими характеристиками
- растворы кислот обладают кислым вкусом (в этом можно убедиться на примере природных кислот; пробовать на вкус синтетические кислоты опасно для жизни);
- растворы кислот изменяют окраску индикаторов;
- водные растворы почти всех кислот, взаимодействуя с целым рядом химически активных металлов, теряют водород.
Помимо природных кислот, существуют также синтетические кислоты, производимые химической промышленностью, которые также являются водородными соединениями. В случае желудочно-кишечных расстройств по указанию врача следует принимать внутрь слабый раствор соляной кислоты или серную кислоту, которая, как известно, используется в автомобильных аккумуляторах.
Получение водорода
Сила водорода всегда стабильна и является 1. Соединение, состоящее из двух элементов (бинарные соединения), одним из которых является водород, что указывает на жизнеспособность другого элемента.
В результате водород имеет определенную валентность, что позволяет легко определить валентность другого элемента.

Рис. 27. Вытеснение водорода из цинка соляной кислотой
Получение водорода в лаборатории
В лаборатории водород получают при взаимодействии цинка или железа с соляной кислотой (рис. 27).
Для этого используется специальное устройство или устройства KIPP (рис. 28).
Устройство KIPP готово к работе в любое время и может быть остановлено в любой момент.
Устройство состоит из A и воронки B, состоящей из сферических и полусферических полых резервуаров, прикрепленных друг к другу. При установке воронки B образуется зазор между краем воронки и узкой частью шара и полусферы. Металлические куски такого размера проходят через бункер B, не проходя через столб. Раствор кислоты заливается в воронку, заполняет полусферу, проходит через щель и достигает металлической полосы. После этого подача кислоты прерывается. Между металлом и кислотой происходит реакция, в результате которой начинает выделяться газ. Газ расходуется через дозированную вентиляцию D с прикрепленной к трубке пробкой. По окончании эксперимента кран T закрывается. Это закрывает путь выхода газа. Газ начинает подниматься в воронку без контакта кислоты с фрагментами, в результате давления, оказываемого на кислоту при ее сборе, тем самым останавливая реакцию. Водород можно хранить в сферической части сосуда для последующего использования.
Если устройство KIPP недоступно, специальную посуду можно приготовить в лаборатории. Принципы те же, что и для устройств KIPP.
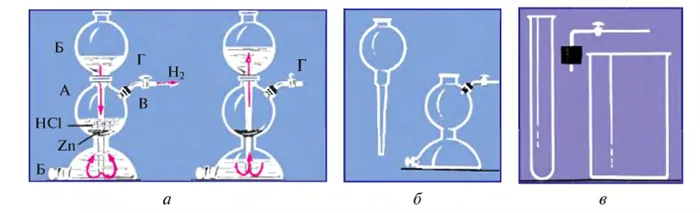
Рисунок 28. Часть устройства KIPP (a) — специальное устройство, заменяющее его (b) — устройство KIPP в действии (c)
Получение водорода в промышленности
Водород широко используется в народном хозяйстве и поэтому знаком с его промышленными методами производства. Водород как простое вещество встречается в природе в небольших количествах. Для его производства в промышленных масштабах используются наиболее распространенные природные соединения. Эти соединения включают воду и метан, которые являются основными компонентами природного газа. Из них водород добывается следующим образом.
Сила водорода всегда стабильна и является 1. Соединение, состоящее из двух элементов (бинарные соединения), одним из которых является водород, что указывает на жизнеспособность другого элемента.
Водород как химический элемент
Атомы водорода являются одними из самых легких, простых по структуре и наименьших по размеру. Относительный атомный вес водорода выглядит следующим образом.
Сравните это с относительной атомной массой кислорода и увидите, что атом водорода во много раз легче.
Атомы водорода соединяются с атомами других химических элементов, образуя композитные материалы. Как химический элемент, водород входит в состав воды, кислот, газов, масел, глюкозы и многих других веществ. В растительном и животном мире, включая человека, химический элемент водород в основном содержится в воде и различных органических веществах.
Водород как простое вещество
Молекула водорода состоит из двух атомов химического элемента водорода. Его тип — H.2. Относительные молекулярные веса простых водородных веществ следующие
![]()
Таким образом, молекулярная масса водорода выглядит следующим образом.
Молекулярный объем водорода, а также кислорода и других газов при нормальных условиях составляет
![]()
Как самостоятельное вещество водород встречается на Земле лишь в небольших количествах в вулканах и других природных газах. Молекулярный водород H2 молекулы находятся в верхних слоях атмосферы Земли. В Солнечной системе отдельный водород входит в состав атмосфер планет Юпитер, Сатурн и Уран.
Кстати, недавние исследования Юпитера, самой большой планеты Солнечной системы, привели ученых к предположению, что под водородной атмосферой планеты находится океан жидкого водорода. Глубина этого океана составляет десятки тысяч километров. Ядро планеты представляет собой оболочку из твердого водорода.
История открытия водорода
В 16 веке Парацельс заметил, что кислота воздействует на железо и другие металлы, выделяя газы. Первоначально это называлось «соотношением воздух-топливо». Примерно через 100 лет сгорание водорода в воздухе было описано Р. Бойлем, который обнаружил, что этот газ можно собирать. Во второй половине XVIII века британский ученый Г. Кавендиш подробно изучил свойства «горючего воздуха». Он обнаружил, что газы образуют воду при сгорании в воздухе. Джордж Кавендиш считается первооткрывателем водорода (1766).

Вывод о том, что «горючий воздух» является самостоятельным веществом, был сформулирован французским химиком А. Лавуазье в 1784 году. На самом деле это латинское название произошло от греческого «hudor» — вода и «gennao» — рождение. В то время этот элемент считался простым веществом, и его состав не поддавался дальнейшему анализу. Поэтому химический элемент водород имеет то же название, что и единичный элемент H2.
Реакция с металлами. Водород также вступает в реакцию с активными металлами. В то же время твердые вещества — гидриды (NaH, NaH, NaH, NaH, NaH, NaH, NaH, NaH, NaH, NaH).
Получение водорода

Промышленность производит водород для промышленного использования:.
- электролизом воды;
- методом глубокого охлаждения газовых смесей, содержащих водород;
- железо-паровым способом;
- из водяного газа путем окисления содержащейся в нем окиси углерода водяным паром в присутствии катализатора;
- в специальных водородных генераторах воздействием серной кислоты на железную стружку и цинк.
Получение водорода из кислот
Первоначально в качестве источника водорода использовались кислоты. Сегодня в лаборатории его часто получают средневековым способом — путем реакции цинка с серной кислотой. Реакция протекает по следующему уравнению.
Вместо цинка можно использовать железо в виде стружки или алюминий. Водород, загрязненный побочными продуктами разложения серной кислоты, при необходимости должен быть очищен.
Добыча водорода из промышленных газов
Большое количество водорода, необходимого современной промышленности, в настоящее время получают путем электролиза щелочных растворов и извлекают из промышленных газов (например, из грануляционных печей, газов нефтеперерабатывающих заводов).
Когда уголь перерабатывается в кокс, дополнительно образуется смола и коксовый газ. Состав газа составляет до 50-60% водорода (H2), 20-25% метана (CH4), окись углерода (CO) и азот (N).
В статье о свойствах солара и методах его производства объясняется, как солар производится путем фракционной конденсации. То же самое можно сказать и о газококсовом газе. Однако отделение водорода от других компонентов требует очень глубокого охлаждения из-за низкой критической температуры водорода.
Производство водорода из воды
Наиболее распространенным методом получения водорода является электролиз дистиллированной воды. В результате образуется водород, кислород и немного грязи.
Единственным сырьем для производства водорода электролизом является вода. Чистая, дистиллированная вода обладает большим сопротивлением и может только навязывать электричество. Поэтому, чтобы сделать воду электропроводной, ее необходимо растворить в соли, кислоте или основании, чтобы в ней появились ионы.
Через водный раствор щелочи (например, каустической соды) пропускается постоянный ток. Вода распадается, и водород выделяется на отрицательном электроде (падает), а кислород, другой важный промышленный продукт, выделяется на положительном электроде (поднимается).
Поскольку основным недостатком этого метода является высокое энергопотребление, рекомендуется использовать водород, полученный электролизом, вместе с кислородом. Поэтому портативное оборудование для водородной сварки становится все более популярным.
Применение водорода

Основные области применения водорода следующие
- химическая промышленность – синтез аммиака, метанола, углеводородов;
- пищевая промышленность – получение пищевых белков;
- нефтехимия – нефтепереработка (гидрогенезационная очистка нефтепродуктов);
- автотранспорт – автомобили на газообразном и жидком водороде;
- машиностроение – для сварки и резки металлов.
Применение водорода в сварке
Водород используется в качестве защитного газа с первой попытки защитить носовую область от воздуха. Однако в некоторых случаях водород может быть вреден. Это связано с тем, что использование водорода вызывает появление ресурсов в металле шва и является важным фактором образования холодных трещин. Пористость металла шва имеет большое значение из-за увеличения толщины сварочных элементов. В результате его использование может быть значительно сокращено в будущем. В чистом виде (и в виде смеси водорода и трута, получаемого при разложении аммиака) он в настоящее время используется в атомной водородной сварке (хотя сам этот метод был заменен другими, особенно сваркой неплавящимися электродами).
Когда струя водорода проходит через пламя вольтовой дуги, водород разрушается с выделением значительного количества тепла (103,6 ккал/моль) и напряжение дуги значительно возрастает. Он стабилизируется только при повышении напряжения источника питания. Так, например, при сварке атомарным водородом, которая является наиболее эффективной «кольцевой» дугой с вольфрамовым электродом и током 10-20 а, напряжение дуги составляет ок. 220 В (обычно около 300 В). В этом случае водород является не только защитным газом, но и переносит тепловую энергию от носовой части к поверхности нециркулирующего продукта.
Образующийся атомарный водород направляется к твердой поверхности, с которой он связан, где он поглощает тепло, выделяемое атомами, рекомбинирующими в молекулярный водород, который нагревает и плавит металл. Когда атомы водорода связываются с холодной металлической поверхностью (включая расплавленный металл, поскольку температура плавления большинства металлов ниже температуры, при которой может образоваться значительное количество атомов водорода), выделяется тепло, затраченное дугой на разложение. Выделяемое тепло повышает температуру поверхности свариваемого металла до 3528-4028°C. Эта атомная водородная связь позволяет рафинировать и соединять самые тугоплавкие металлы, нержавеющие стали, коррозионностойкие материалы и цветные металлы.
Атмосфера, окружающая металл при атомной водородной связи, представляет собой смесь молекулярного и атомарного водорода, но если металл не содержит большого количества оксидов, то сварной шов получается очень плотным, а низкоуглеродистые стали не содержат большого количества водорода. Диффузионная жидкость.
Для защиты от брызг иногда используется водяной пар. Однако это оказывает гораздо меньшее влияние на качество сварного шва, чем сварка защитной дугой в углекислом газе. Поэтому эта процедура не получила широкого распространения.
Взрывоопасность водорода
При работе с водородом особое внимание следует уделять герметичности оборудования и газовых коммуникаций, так как водород может проникать через небольшие отверстия и образовывать с воздухом взрывоопасные концентрации. При смешивании с кислородом (2:1) он образует взрывоопасную смесь, известную как гремучий газ.
Температура воспламенения составляет 510°C. Водород обычно инертен и в высоких концентрациях вызывает удушье. Оказывает наркотическое действие при повышенном кровяном давлении. При работе в водородной среде необходимо надевать изолирующую маску (кислородную маску или маску с трубкой).
Относительный молекулярный вес паров серы — 256, деленный на относительный атомный вес серы — 32, дает число атомов в молекуле паров серы, т.е. 256:32 = 8.
Ионы водорода
Атом водорода может либо испустить свой единственный электрон с образованием положительного иона (представляющего собой «голый» протон), либо связать единственный электрон, который преобразуется в отрицательный ион с помощью электронной модуляции гелия.
Для полного отделения электронов от атома водорода необходимо затратить очень высокую энергию ионизации.
В результате, когда водород взаимодействует с металлоидами, возникают только полярные, а не ионные связи.
Склонность нейтрального атома связываться с избытком электронов характеризуется величиной его электронного сродства. В случае водорода это выражено очень слабо (но это не означает, что такие ионы водорода не могут существовать): ион водорода не может присутствовать.








