2. гидрогалогенирование (добавление галогенида водорода). Реакция присоединения галогеноводорода, которая идет по электрофильному механизму, также протекает в два этапа, и на обоих этапах выполняется правило Марковникова:
Учебно-методическое пособие
Знать: Химическое строение органических веществ; основные положения теории химического строения; углеводороды с предельной и непредельной структурой; метан, этан, этилен, ацетилен (горение), взаимодействие с галогенами); реакция полимеризации этилена; природные источники углеводородов; спирты — метанол, этанол; горение спиртов; карбоновые кислоты, уксусная кислота, реакция этерификации; биологически важные органические вещества — жиры, углеводы, белки. Построение моделей неорганических и органических молекул (H2O, CO2, HCL, CH4, С2H6, С2H4, С2H2CH3СІ, СН3OH, CH2Н5OH, CH3CH) уравнения для изучаемых химических реакций. Ключевые слова: Органическая химия, углеводороды и их производные, структурные формулы, изомерия, первичные, вторичные, третичные и четвертичные атомы углерода, углеродный скелет, функциональные группы, разветвленные и неразветвленные цепи атомов С, гомологический ряд, гомологическое различие, ненасыщенные углеводороды, ароматические углеводороды, спирты, карбоновые кислоты, жиры, углеводороды, белки.
Контрольные списки
1. в чем разница между органическими и неорганическими соединениями? 2. какие вещества называются углеводородами? 3. как называются производные углеводородов? 4. являются ли продукты питания человека органическими или неорганическими? Приведите примеры. 5. Что такое облигации? 6. какие вещества называются изомерами? 7. нарисуйте пространственную структуру молекулы метана и укажите валентные углы. 8. назовите все синонимы термина «алканы». 9. с помощью каких реакций можно осуществить следующие превращения?
10. каковы характеристики связи C-C? 11. почему углеродная цепь может принимать различные формы в молекулах предельных углеводородов? 12. Где встречаются алканы в природе? 13. как изменяется температура кипения в гомологическом ряду алканов и почему? 14. какие реакции называются реакциями сложения? 15. Напишите уравнения реакций этана и этилена с бромом и объясните разницу. 16. 16. Что такое ненасыщенные соединения? Какие классы ненасыщенных соединений вы знаете? 17. Какую химическую реакцию вы можете использовать для определения наличия в алкане примеси алкана? 18. какова общая формула ацетиленовых углеводородов? Какова общая формула ацетилена Ацетилен? 19. Что такое ароматические углеводороды? Чем они отличаются от других углеводородов? 20. 20 Напишите возможные структурные формулы для C6H6молекулу и объясните, как можно получить действительную формулу бензола. 21. 21. Назовите основные области применения углеводородов. 22. что такое спирты? Приведите формулы всех известных вам спиртов. 23. Опишите наиболее важные области применения карбоновых кислот.
1. Предмет органической химии
Органическая химия — это отрасль химической науки, которая занимается углеродными соединениями — их структурой, свойствами, процессами производства и практическим использованием.
Соединения, содержащие углерод, называются органическими соединениями. Помимо углерода, органические соединения почти всегда содержат водород, довольно часто кислород, азот и галогены, реже фосфор, серу и другие элементы. Однако сам углерод и некоторые его простейшие соединения, такие как оксид углерода (II), оксид углерода (IV), карбоновая кислота, карбонаты, карбиды и т.д., являются не только углеродом, но и диоксидом углерода, углекислотой, солями углерода, карбидами и т.д. относят в неорганических соединениях. Поэтому часто используется другое определение.
Органические соединения — это углеводороды (соединения углерода с водородом) и их производные.
Благодаря особым свойствам элемента углерода, существует множество органических соединений. Известно более 10 миллионов синтетических и природных органических веществ, и их число постоянно растет. Причина такого разнообразия заключается в том, что атомы углерода способны: 1) соединяются друг с другом, образуя цепи с различной структурой: открытые (неразветвленные, разветвленные) и закрытые,
2) они могут образовывать не только одинарные, но и кратные связи (двойные и тройные):
3) образуют прочные связи практически с любым другим элементом.
Атом углерода характеризуется сочетанием двух факторов: наличием четырех электронов на внешнем энергетическом уровне (2 s и 2 p) (поэтому атом углерода не склонен терять или приобретать свободные электроны для образования ионов) и небольшим размером атома (по сравнению с другими элементами IV группы). Следовательно, углерод образует ковалентные, а не ионные связи и имеет валентность IV.
Органические соединения отличаются от неорганических несколькими способами:
2 (это может указывать на то, что рассматриваемое вещество является органическим соединением); t температура кипения и t пл).
Основные положения теории химического строения А.М. Бутлерова
- Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называют химическим строением и представляют структурной формулой (формулой строения).
- Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы.)
- Свойства веществ зависят от их химического строения.
- По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Структурная формула (структурная формула) описывает порядок, в котором атомы молекулы собраны вместе, т.е. ее химическую структуру. Химические связи в химической формуле обозначаются черточками. Связи между водородом и другими атомами обычно не показываются (такие формулы называются короткими структурными формулами). Примеры структурных формул некоторых органических соединений:
Молекулярные формулы Молекулярные формулы лишь указывают, какие элементы содержатся в веществе и в каких пропорциях (т.е. качественный и количественный элементный состав). В отличие от структурных формул, они не показывают порядок, в котором атомы соединены друг с другом.
2. Изомерия
Еще до развития структурной теории было известно, что вещества могут иметь одинаковый элементный состав, но разные свойства. Такие вещества были названы изомерами, а само явление — изомерией. Как показал Батлер, изомерия основана на различиях в структуре молекул, состоящих из одних и тех же атомов. Изомерия — это явление соединений, имеющих одинаковый качественный и количественный состав, но различную структуру и свойства. Например, н-бутан и изобутан имеют одинаковую молекулярную формулу C4H10но имеют разные последовательности связей и, следовательно, разные физические свойства.
Поэтому различие между веществами обусловлено не только различным качественным и количественным элементным составом, но и различным химическим строением, которое может быть представлено только структурными формулами. В зависимости от того, сколько других атомов углерода связано с определенным атомом углерода, его называют первичным, вторичным, третичным или четвертичным.
(a) происхождение вещества; (b) элементный состав соединения; (c) метод приготовления; (d) воспламеняемость; (e) разлагаемость; (f) молекулярный вес; (g) точки кипения и плавления.
Классификация и виды углеводородов:
При систематизации (классификации) При анализе углеводородов учитывается структура углеродного скелета и характер связей, соединяющих атомы углерода.
В зависимости от структуры углеродного скелета углеводороды делятся на ациклические и карбоциклические углеводороды.
Ациклические соединения (ациклические углеводороды) — это класс органических соединений, молекулы которых не имеют кругов (колец), а все атомы углерода соединены в прямые или разветвленные (открытые) цепи.
Ациклические соединения в литературе также называют алифатическими соединениями.
Карбоциклические соединения (карбоциклические углеводороды) — это класс органических соединений, характеризующихся наличием колец (циклов) из атомов углерода. Карбоциклические соединения отличаются от гетероциклических отсутствием в кольцах других атомов, кроме атомов углерода.
В зависимости от числа углерод-углеродных связей ациклические углеводороды делятся на предельные (алканы) и непредельные (алкены, алкины, диены). Ациклические углеводороды также называют насыщенными углеводородами, а ненасыщенные углеводороды — ненасыщенными углеводородами.
Циклические углеводороды в свою очередь подразделяются по числу углерод-углеродных связей на алкильные углеводороды (циклоалканы, циклоалкены, циклоалкины) и ароматические углеводороды (арены).
Предельные (насыщенные) ациклические углеводороды:
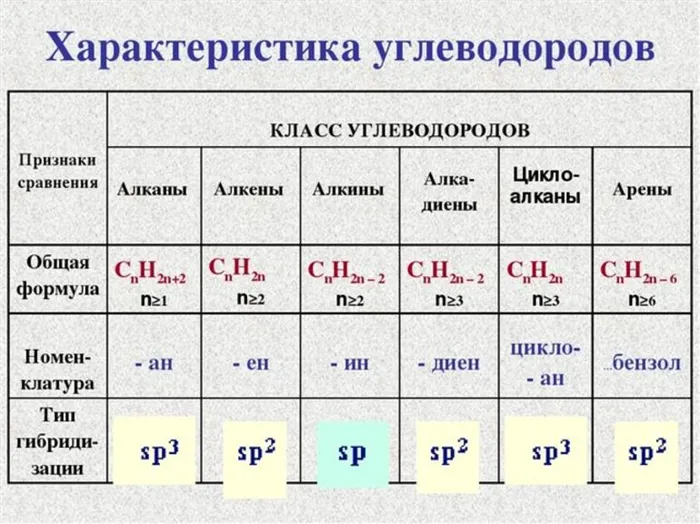
Алканы (также называемые насыщенными углеводородами, насыщенными парафинами) — это ациклические углеводороды с линейной или разветвленной структурой, которые содержат только одинарные связи между атомами углерода и образуют гомологический ряд с общей формулой CnH2n+2.
Насыщенные алканы называются насыщенными, потому что они содержат наибольшее возможное количество атомов водорода для данного количества атомов углерода.
Каждый атом углерода в молекулах алканов находится в состоянии sp 3 -гибридизации — и 4 гибридные орбитали атома углерода идентичны по форме и энергии, 4 связи направлены под углами 109°28′ к вершинам тетраэдра. Связи С-С — это связи с низкой полярностью и низкой поляризуемостью. Длина связи С-С составляет 0,154 нм, длина связи С-Н — 0,1087 нм.
Алканы образуют гомологический ряд, который также называют метановым рядом. Алканы относятся: метан CH4этан C2H6, пропан C3H8, бутан C4H10, пентан C5H12гексан C6H14, гептан C7H16, октан C8H18, нонан C9H20, декан C10H22 и т.д., которые имеют формулу CnH2n+2. Алканом с самой длинной цепью является неаконтатриктан C390H782.
Алканы, содержащие более трех атомов углерода, имеют изомеры. Изомеры насыщенных углеводородов основаны на более простых видом структурная изомерия, т.е. изомеризация углеродного скелета, а начиная с гептана — еще и оптическая изомерия. По мере увеличения числа атомов углерода в молекуле число изомеров быстро растет.
Непредельные (ненасыщенные) ациклические углеводороды:
Алкены (также называемые олефинами, этиленовыми углеводородами) — это ациклические ненасыщенные углеводороды, содержащие двойную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода в двойной связи находятся в состоянии гибридизации sp² и имеют валентный угол 120°. Связь C=C является p-связью. Длина связи C=C составляет 0,134 нм.
Согласно номенклатуре ИЮПАК, названия алкенов образуются из названий соответствующих алканов путем замены суффикса «-an» на «-en»; положение двойной связи обозначается арабской цифрой.
Алкены образуют гомологический ряд, который также называется этиленовым рядом. Алкены относятся: этен (этилен) C2H4, пропен (пропилен) C3H6, бутен (бутилен) C4H8, пентен C5H10ведьмы C6H12, гептен C7H14, октен C8H16, нонен C9H18, децен C10H20 и т.д., которые имеют формулу CnH2n.
Алкены с более чем двумя атомами углерода (т.е. кроме этилена) имеют изомеры. Алкены характеризуются изомерами углеродного скелета, положением двойной связи, межклассовыми и геометрическими (пространственными) изомерами. По мере увеличения числа атомов углерода в молекуле число изомеров быстро растет.
Алкины (также называемые ацетиленовыми углеводородами) — это ациклические ненасыщенные углеводороды с тройной связью между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Атомы углерода тройной связи находятся в состоянии sp-гидратации и имеют валентный угол 180°. Поэтому связь C≡C алкинов линейна (угол 180°) и лежит в одной плоскости. Связи C≡C образованы одной σ-связью и двумя π-связями. Длина связи C≡C составляет 0,121 нм.
Согласно номенклатуре ИЮПАК, алкины получаются из соответствующих алканов путем замены суффикса «-ан» на «-ин»; положение тройной связи обозначается арабскими цифрами.
Алкины образуют гомологический ряд, называемый также ацетиленовым рядом. Алкины относятся: этин (ацетилен) C2H2Пропин С3H4Бутин С4H6, пентен C5H8, exine C6H10гептин С7H12, octin C8H14, нонин C9H16, снижение C10H18 и т.д., которые имеют формулу CnH2n-2.
Алкины с более чем тремя атомами углерода (т.е. кроме ацетилена и пропина) имеют изомеры. Алкины характеризуются изомерами углеродного скелета, положением тройных связей и промежуточным порядком. По мере увеличения числа атомов углерода в молекуле число изомеров быстро растет.
Диены (также называемые алкадиенами) — это ациклические ненасыщенные углеводороды с двумя двойными связями между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
В зависимости от взаимного расположения кратных связей диены делятся на три группы:
— соединенные диены, в которых двойные связи разделены одной связью (1,3-диены)
— Аллены с накопленными двойными связями (1,2-диены)
— Диены с изолированными двойными связями, в которых двойные связи разделены более чем одной одинарной связью.
(a) ненасыщенные алициклические углеводороды; (b) ненасыщенные ациклические углеводороды; (c) алифатические углеводороды; (d) ненасыщенные гетероциклические соединения.
Определения
Предельные углеводороды отличаются от ненасыщенных углеводородов наличием одинарных связей. Атомы углерода в углеводородах соединены простыми одинарными связями. В этом случае все дополнительные связи атомов углерода заняты углеводородами. Поэтому насыщенные углеводороды могут вступать в реакции присоединения и замещения только под воздействием катализаторов или высоких температур.
Ненасыщенные углеводороды содержат двойные или тройные связи и могут присоединять дополнительные атомы в местах разрыва кратных связей, превращаясь в насыщенные углеводороды.
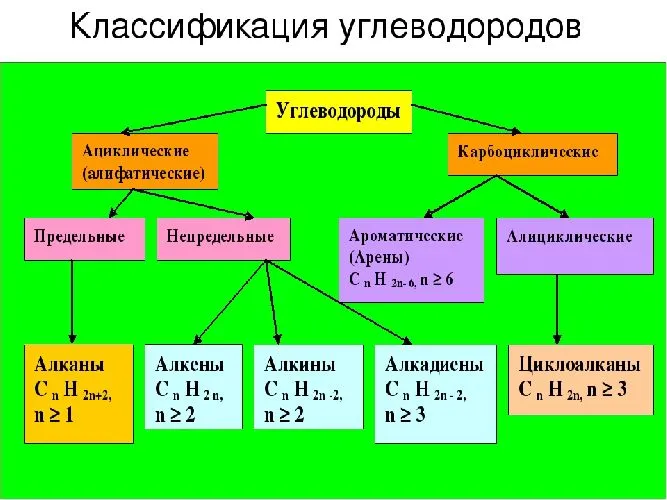
Рис. 1. Схема классификации углеводородов.
Физические и химические свойства углеводородов зависят от структуры молекулы и количества углеводородов в цепи.
Насыщенными углеводородами считаются следующие вещества относятся Алканы и циклоалканы. Ненасыщенные или ненасыщенные углеводороды. относятся Алкены, алкины, алкадиены.
Сравнительная таблица
Сводная таблица насыщенных и ненасыщенных углеводородов показывает наиболее важные характеристики категорий.
Класс
Общий тип
Структура
Облигации
Паритет
Линейные молекулы с одиночными связями
Структурное соответствие с углеродным скелетом. В некоторых случаях оптические
Циклические молекулы с одной связью
Структурированный углеродный скелет, упорядоченный, пространственный
Содержит двойную связь (CH2=CH2)
Структурно основаны на углеродном скелете и положении двойной связи, разветвление с помощью циклоалканов, пространственное
Содержит две двойные связи (CH2=C=CH2)
Структурный углеродный скелет, положение двойных связей, разветвление с алкинами, расстояния.
Содержит одну тройную связь (CH≡CH).
Структура основана на углеродном скелете, положении тройных связей и разветвлении.
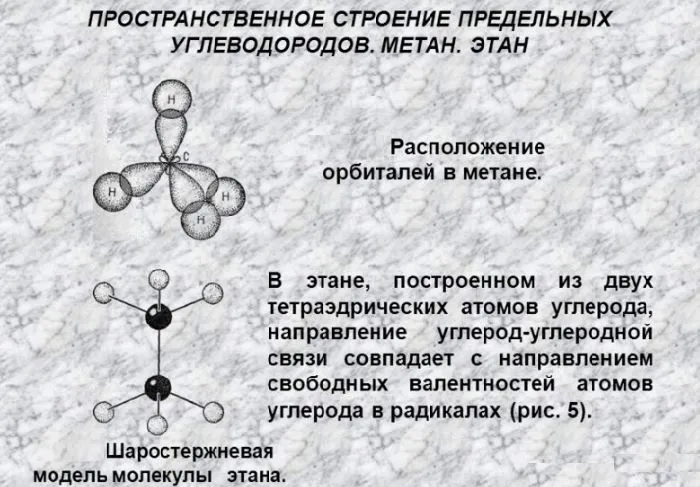
Рисунок 2. Структура насыщенных углеводородов.
Класс аренов (ароматических углеводородов) образует свою собственную группу. Арены содержат бензольное кольцо и по своим химическим свойствам отличаются от насыщенных и ненасыщенных углеводородов.
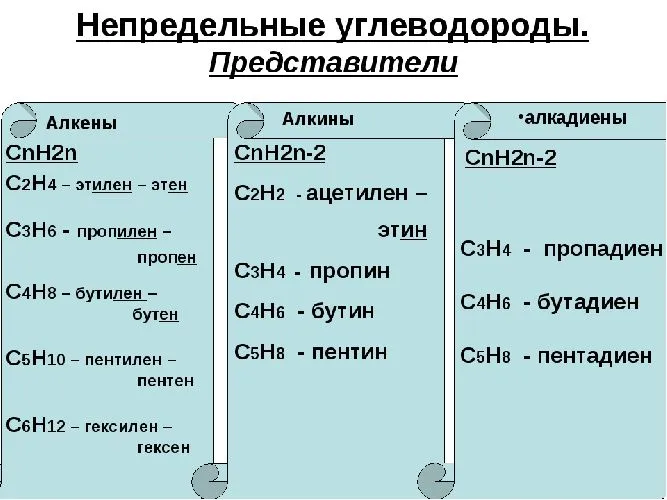
Рисунок 3. Примеры ненасыщенных углеводородов.
Алканы являются компонентами природного газа: метан 80-97%, этан 0,5-4%, пропан 0,2-1,5%, бутан 0,1-1% и пентан 0-1%. Состав нефти не может быть выражен одной формулой; он нестабилен и зависит от месторождения.
Ключевые параметры
Углеводороды могут сочетать в себе большое количество различных соединений. Но если говорить об их основных характеристиках, то следует заметить, что у них нет почти ничего общего. Единственное, что их объединяет, — это композиция. Структура всегда разная. Примечателен их переход из газообразного состояния в твердое. Они также могут переходить из жидкого состояния в жидкое. Это происходит в соответствии с увеличением числа атомов углерода в начале ряда. Еще одна общая особенность — способность гореть. В то же время при образовании воды и углекислого газа выделяется большое количество тепла.
Структурные особенности
Алканы являются гомологами метана, т.е. производными метана. Его молекулярная формула записывается как CH4. При удалении атома водорода может образоваться радикал (углеводородный радикал) CH3. В большинстве случаев в молекуле присутствует 4-углерод. Следовательно, сочетание двух радикалов приводит к образованию еще одного представителя гомологического ряда этана C2H6. После отщепления атома водорода образуется этильный радикал. Если его соединить с CH3, образуется другой гомолог — пропан.
Если мы посмотрим на структуру пропана, то увидим, что в его основе лежат 2 атома углерода.видноАтомы углерода в его основании. Это первичные и вторичные соединения. Каждый первичный атом имеет связь с 1 атомом углерода. Если атом водорода отсоединяется от первичного атома пропана, образуется первичный пропилен. Сочетание метила с вторичным пропиленом позволяет образовывать несколько вариантов других гомологов. Это может быть изобутан, который имеет широко разветвленную углеродную цепь, или стандартный бутан, углеродная цепь которого прямая.
Метан является наиболее типичным вариантом алканов. Для этих соединений характерна так называемая сигма-связь. Предположим, что метан имеет 4 ковалентные связи. За это отвечают 3 p- и 1 s-орбитали. Атом углерода образует эти связи благодаря s-орбитали.
Изомерия и номенклатура
Для того чтобы идентифицировать гомологи, в том числе бутан с формулой C4H10, необходимо изучить эффект изомерии. В случае бутана за стабильность его формулы отвечают два различных соединения, а в случае C5H12 — три. Число изомеров постепенно увеличивается с ростом числа атомов углерода в молекулах алкана. В формуле C6H14 есть пять структурных формул. Если первые четыре соединения являются газами, то вещества с 5 по 12 — жидкости. Вещества 16 и выше имеют твердую структуру.

Чистые углеводороды классифицируются как инертные вещества. Это можно объяснить сигма-связью атомов водорода и углерода в алканах. Именно по этой причине они не могут притягивать атомы водорода. Вещества могут подвергаться реакциям разложения, дегидрирования и нитрования. Они также участвуют в процессе радикального галогенирования. В последнем случае молекулы галогена могут легко заменить молекулы водорода в алкане. Нитрование приводит к тому, что водород во вторичных и третичных соединениях замещается нитрогруппой.
Для первичных и вторичных атомов процесс немного сложнее.
Полициклические углеводороды используются в производстве различных органических соединений. видов. Ненасыщенные соединения образуются при удалении из них атома водорода.
Для углеводородов также существует процесс полимеризации. Это состояние, в котором идентичные молекулы связаны друг с другом. В результате получается материал, который полностью отличается от исходного. Классическим примером является полиэтилен. Он изготавливается из стандартного этилена. Это возможно только при использовании ненасыщенных углеводородов.
Алкены, как и алканы, характеризуются структурными изомерами. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейшим алкеном, характеризующимся структурными изомерами, является бутен:
Особым видом Структурная изомерия — это изомерия положения двойной связи:
Вокруг единственной углерод-углеродной связи атомы углерода могут вращаться почти свободно, поэтому молекулы алканов могут принимать различные формы. Вращение вокруг двойной связи невозможно, что приводит к образованию другого алкена вида Изомерия — геометрическая или цис-транс-изомерия.

Цис-транс-изомеры отличаются от транс-изомеров пространственным расположением частей молекулы (в данном случае метильных групп). относительно количество связей $p$ и, следовательно, их свойства.
Алкены, например, изомерны циклоалканам (изомерия между классами):
Номенклатура алкенов, разработанная ИЮПАК, аналогична номенклатуре алканов.
1. IUCAC (IUPAC) имеет ту же структуру, что и IUCN (IUCA).
Название углеводорода начинается с определения главной цепи — самой длинной цепи атомов углерода в молекуле. В случае алкенов основная цепь должна содержать двойную связь.
Пронумеруйте атомы в главной цепи.
Пронумеруйте атомы в главной цепи, начиная с конца, ближайшего к двойной связи. Например, правильное название соединения следующее:
$5$-метилен-3500$, а не $3500$-метилен-$4$, как можно было бы предположить.
Если положение двойной связи не может быть использовано для определения принципа нумерации атомов цепи, оно определяется положением заместителей, как в случае насыщенных углеводородов.
3. образование имени.
Названия алкенов образуются так же, как и названия алканов. Название дополняется номером атома углерода, с которого начинается двойная связь, и суффиксом -en, который указывает на принадлежность соединения к классу алкенов.

Физические и химические свойства алкенов
Физические свойства. Первые три члена гомологического ряда алкенов — газы; соединения состава $C_5H_$ — $C_H_$ — жидкости; высшие алкены — твердые вещества.
Точки кипения и плавления естественным образом повышаются с увеличением молекулярного веса соединений.
Химические свойства.
Реакции доступа. Следует отметить, что характерной особенностью алкенов, представителей ненасыщенных углеводородов, является их способность к реакциям присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. гидрогенизация алкенов. Алкены могут присоединять водород в присутствии катализаторов гидрогенизации, таких металлов, как платина, палладий и никель:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, так как является экзотермической. При повышении температуры на тех же катализаторах может происходить обратная реакция — дегидрирование.
2. галогенирование (присоединение галогенов). Взаимодействие алкена с бромсодержащей водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образованию дигалогенированных алканов:
3. гидрогалогенирование (добавление галогенида водорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к наиболее гидрогенизированному атому углерода, т.е. атому с наибольшим количеством атомов водорода, а галоген присоединяется к наименее гидрогенизированному атому.
Гидратация (добавление воды).
Гидратация алкенов приводит к образованию спиртов. Например, добавление воды к эфину лежит в основе одного из промышленных методов получения этилового спирта:
Обратите внимание, что первичный спирт (с гидроксильной группой на основном углероде) образуется только при гидратации эфина. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция также следует правилу Марковникова — катион водорода присоединяется к более гидрогенизированному атому углерода, а гидроксильная группа — к менее гидрогенизированному.
Полимеризация. Особым случаем добавления является реакция полимеризации алкенов:
Эта реакция присоединения осуществляется по радикальному механизму.
6. реакция окисления со свободными радикалами.
Как и любое органическое соединение, алкены сгорают с кислородом до $CO_2$ и $H_2O$:
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются растворами перманганата калия. В нейтральных или щелочных растворах алкены окисляются до диолов (двухатомных спиртов) с гидроксильными группами, присоединенными к атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — это ациклические углеводороды, которые содержат две двойные связи между атомами углерода в дополнение к одинарным связям в молекуле и соответствуют общей формуле $C_H_$.
В зависимости от положения двойных связей различают три вида диенов:
— Алкадиены с кумулятивным расположением двойных связей:
— Алкадиены с сопряженными двойными связями,
— алкадиены с изолированными двойными связями.
Эти все три вида Алкадиены значительно отличаются по своей структуре и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в кумулятивно связанных алкадиенах находится в состоянии $sp$-hubby. Он образует две связи $sp$, которые лежат на одной прямой и имеют противоположные направления, и две связи $p$, которые лежат в перпендикулярных плоскостях. Связи $p$ образуются за счет негибридизированных p-орбиталей отдельных атомов углерода. Свойства алкадиенов с изолированными двойными связями очень специфичны, поскольку $p$-связи сильно влияют друг на друга.
p-орбитали, образующие $p$-пары, практически образуют единую систему ($p$-систему), поскольку p-орбитали соседних $p$-пар частично перекрываются.








