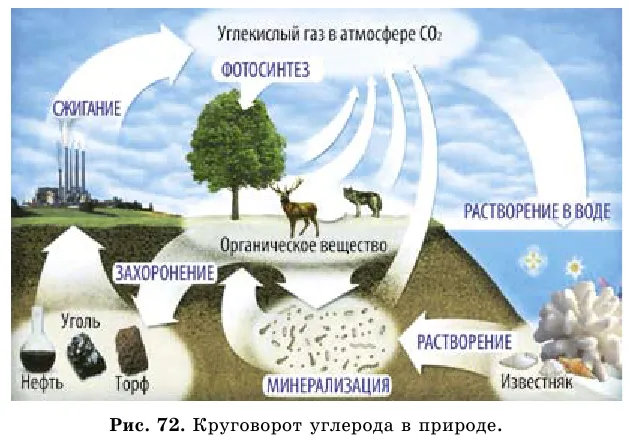
Увеличение концентрации углекислого газа в атмосфере создает «парниковый эффект», что приводит к повышению температуры и таянию ледников. Концентрация углекислого газа в атмосфере увеличивается из-за автомобильного транспорта, количество которого растет с каждым годом.
Углерод
Соединений углерода очень много: все живые организмы, углерод, торф, нефть и т.д. Они содержат углерод. Углерод входит в состав многих неорганических веществ (например, известняка, мела, мрамора). Химические свойства углерода. Углерод имеет низкий потенциал и реагирует с фтором только на холоде — при высоких температурах происходит химическая активность.
Страница — >Решение задач по химии содержит решения задач и задания с решенными примерами по всем проблемам химии.
Углерод и его соединения
Характеризуйте углеводороды на основе их положения в системе магазинов. Сообщает о соединениях углерода и прочности этих соединений.
Уголь, сажа и сажевые формы угля известны человечеству уже много лет. Элементарная природа углерода была открыта А. Лавуазье в конце 1780-х годов. Название было дано в 1824 году, когда оно было переведено с латыни как «древесный уголь».
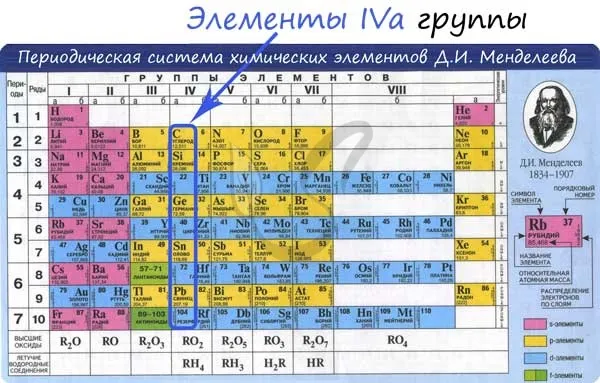
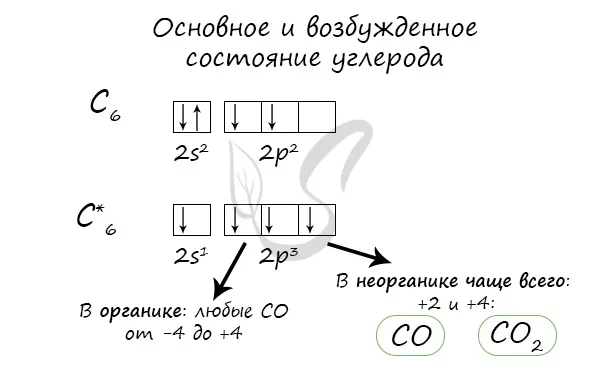
Положение в периодической системе. Углерод – элемент 2-го периода главной подгруппы IV группы (IVА), атомный номер 6, относительная атомная масса 12, в ядре атома содержится 6 протонов и 6 нейтронов
Структура человека. Электронный состав атома углерода: Углерод — это неэлемент, элемент p.
Валентные электроны (II, IV) расположены на орбиталях.

При возбуждении один электрон переходит с 2 s -подуровня на 2 p -подуровень. Поэтому в основном состоянии атом углерода двухвалентен (CО), а в возбужденном состоянии – четырехвалентен
Нахождение в природе . Углерод входит в состав всех живых организмов. В свободном состоянии углерод встречается в виде алмаза, графита и карбина (аллотропные видоизменения, рис. 69). Природные соединения углерода – доломит магнезит
Углерод в свободной форме не токсичен, но многие его соединения обладают значительной токсичностью.
Гомологичные модификации углерода характеризуются различными структурами кристаллической решетки. Этим объясняются резкие различия в их физических свойствах.
Физические свойства. Алмаз — самая требовательная природная ассоциация в мире. Это прозрачный, бесцветный кристалл с тетраэдрической структурой, не проводящий электричество.
Графит мягкий, непрозрачный, серый, маслянистый и блестящий (Рисунок 68). Графит превращается в карбин при температуре и давлении до 2000°C.
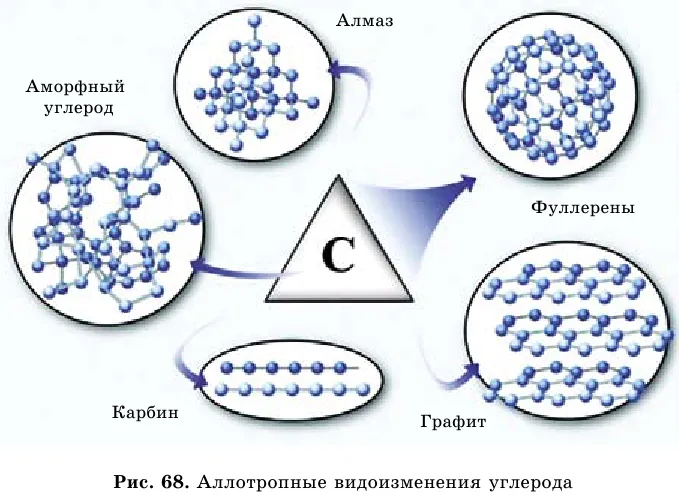
В последние годы была обнаружена еще одна форма. Фреллерен. По своей структуре он напоминает футбольный мяч.
Эти виды могут добавлять аморфный углерод, простейшим представителем которого является древесный уголь. При сухой перегонке древесины образуется древесный уголь, обладающий сильной адсорбционной способностью (поверхностным поглощением) газов, паров и растворенных веществ.
Как добраться. Сажа — это аморфный углерод, продукт неполного сгорания углеводородов. КМЭ — это твердое искусственное топливо, продукт термической переработки угля.
Помните! 1 г активированного угля имеет поверхность 800 м2, что повышает его адсорбционную способность. Адсорбенты — это вещества, способные поглощать газы и жидкости на своей поверхности. Таблетки активированного угля используются для подготовки желудочно-кишечного тракта к рентгену и ультразвуку для очистки спирта. Активированный уголь не поглощает монооксид углерода (CO).
Гомогенная модификация углерода.
Химические свойства углерода
Углерод может реагировать со многими простыми и сложными веществами (рис. 9).
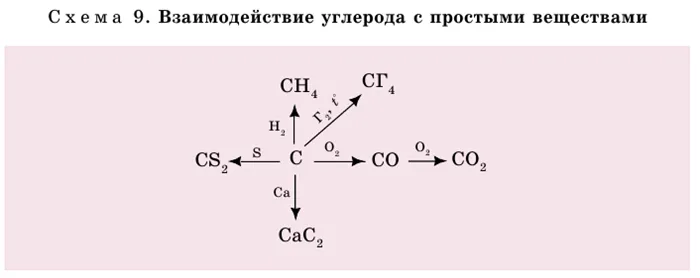
Уравнение реакции с простыми веществами выглядит следующим образом.
1) a) При неполном сгорании углерода:.

(b) при полном сгорании углерода в избытке кислорода:.
2) Уголь соединяется с хлором при освещении:.
3) Углеводы образуются в металлах.

4) Сероуглерод образуется с серой.
Листовые ядра углерода используются для производства вискозных волокон, а также в качестве растворителя
5) Метан образуется из водорода.
Метан — это газообразное топливо (газовая основа).
Уголь также взаимодействует со сложными веществами.
(1) Газовая вода образуется вместе с водой — ценным топливом. Поэтому, когда печь нагревается, уголь смачивается водой.
2) Углерод с углекислым газом образует оксид углерода (II).
3) Используется оксид железа (эта процедура проводится во взрыве). Углерод высвобождает железо в свободном состоянии:.

Применение. Алмазы используются для резки стекла, что является производством сверл. Ограненные алмазы используются в строительстве великих
Графит используется в производстве электродов и карандашей. CMS (C) производится методом сухой дистилляции (нагревание без воздуха). Он используется в качестве восстановителя при производстве металлов. Его способность рекламироваться на активированном угле также используется в медицине и противогазах (Рисунок 69).

Фреллерены — это наночастицы с очень ценными свойствами.
Каждая молекула содержит 60 атомов углерода, расположенных в пентагональной и гексагональной формах, что позволяет создавать кристаллы, используемые в электронике и компьютерах.
Практическая работа 6 Природные и химические свойства углерода
Цель: знать условия образования углекислого газа и угарного газа при сгорании углекислого газа.

Курс занятий.
Эксперимент 1.Изучение угля 1. Налейте немного окрашенного водного раствора в коническую бутылку. 2. всыпать в раствор 0,3-0,5 г измельченного углерода и взбалтывать содержимое в течение 2-3 минут. 3. отфильтруйте его и обратите внимание на потерю цвета.
Эксперимент 2.Эдебализирующие свойства древесного угля. 1.Смешайте массу оксида меди (II) и измельченного углерода на бумаге. 2.Перенесите смесь в сухую пробирку и поставьте горизонтально на полку. 3. закройте пробирку газоотводной трубкой, согнутой под правильным углом. 4. окуните конец трубки в раствор извести. 5. сильно нагревайте пробирку до тех пор, пока не перестанет выделяться газ. 6.Дайте пробирке остыть и обратите внимание на цвет содержимого.
HCN Мидоциановая кислота является важным продуктом химической промышленности и широко используется в органических композициях. Его мировое производство достигает 200 000 тонн в год. Электронная структура аниона циана напоминает оксид углерода (II), такие частицы называются изоструктурами.
Углерод
Углерод — неметаллический элемент IV группы D.I. Менделеева — важнейшая часть всех органических веществ в природе.

Общие свойства элементов группы IVA.
Увеличение от C до PB (сверху вниз по периодической таблице): индивидуальные радиусы, металлические, фундаментальные и восстановительные свойства. Электроны, энергия ионизации и сродство к электрону уменьшаются.
Уголь и кремний являются неметаллами; германий, олово и свинец — металлы IVA группы.
- C — 2s 2 2p 2
- Si — 3s 2 3p 2
- Ge — 4s 2 4p 2
- Sn — 5s 2 5p 2
- Pb — 6s 2 6p 2
Естественные ассоциации.
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MGCO3 — доломит

Подготовка.
Углерод поступает в атмосферу в результате пиролиза углеводородов (пиролиз — это бескислородный нагрев). Он также используется в производстве соединений карбоновых кислот в древесине и камне.
Химические свойства.
При нагревании углерод вступает в реакцию со многими безотходными продуктами водорода, кислорода и фтора.
2c + o2 → (T)2CO (монооксид углерода является продуктом неполного окисления углерода из-за недостатка кислорода)
C + O2 → (t)co2 (Диоксид углерода является продуктом полного окисления углерода при наличии достаточного количества кислорода)
При нагревании углерод вступает в реакцию с металлами и проявляет их окислительные свойства. Это напоминает нам о том, что металлы могут получать только положительное окисление.
Ca + C → CAC2 (карбид кальция; CO = -1)
AL + C → AL4c3(карбид алюминия, уголь -4)
Очевидно, что степень окисления углерода в соединениях с различными металлами может быть разной.

Углерод является хорошим восстановительным фактором. Металлургическая промышленность может использовать его для получения чистых металлов из оксидов.
Углерод не только восстанавливает металлы из оксидов, но и неметаллы аналогичным образом.
Он также может восстанавливать собственные оксиды.

Хорошо известная реакция между взаимодействием углерода и водяного пара — также называемая углеродом, торфом или сланцем — очень важна в промышленности.
В кислотных реакциях уголь выступает в качестве восстановителя.
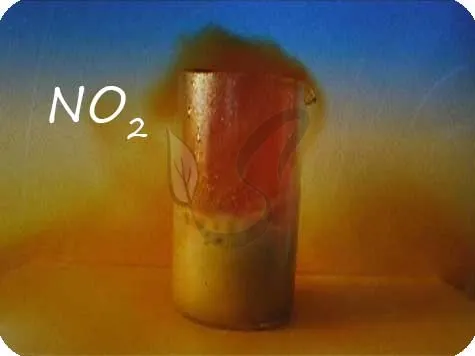
Монооксид углерода II -co
Монооксид углерода является продуктом неполного окисления углерода. Это несформировавшийся оксид. Это очень опасное вещество часто образуется при пожарах в помещениях или при нагревании автомобилей в гаражах.
Графит мягкий, непрозрачный, серый, маслянистый и блестящий (Рисунок 68). Графит превращается в карбин при температуре и давлении до 2000°C.
Углерод — характеристика элемента и химические свойства

Углерод (с) является типичным неметаллом и относится к IV группе, 2-й группе, главной подгруппе периодической системы. Он имеет серийный номер 6, AR = 12,011 а.е., ядерный заряд +6.
Физические свойства: углерод образует множество гомологичных модификаций: алмаз — одно из самых сложных веществ, графит, углерод и сажа.
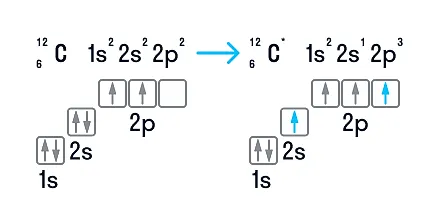
Атомы углерода имеют шесть электронов: 1S22S 2 2P 2. Последние два электрона содержатся в отдельных тележках P и являются безошибочными. В принципе, эта пара могла бы понять только одну орбиту, но в таких случаях появление усыновителя значительно увеличивается. По этой причине один из них занимает 2pх Другой получает 2 пенсаa или 2 пенсаz — Орбита.

Разница в энергии между S и P уровнями внешнего слоя невелика, поэтому человек очень легко входит в стимулированное состояние. Там один из двух электронов с орбитали 2S переходит на свободную 2P. Это приводит к состоянию интенсивности с конфигурацией 1S 2 2S 1 2PБАТС 1 2py 1 2pz 1. именно такое состояние атома углерода характерно для алмазной решетки — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и одинаковая энергия связи.
Это явление известно как SP 3 government, а результирующая функция — как SP 3 government. Образование четырех SP 3-связей обеспечивает атомам углерода более стабильные условия, чем три p-p-p-связи и одна S-S-связь. Помимо SP 3-правительств, атомы углерода также имеют SP 2 и SPA-правительства. В первом случае происходит взаимное наложение S- и двух p-троллей. Образуются три эквивалентные гибридные орбитали SP 2 -SP, которые находятся на одном уровне под углом 120°. Третья орбита P не изменена и перпендикулярна уровню SP 2.

В гибридизации SP орбитали S и P перекрываются. В результате угол между двумя эквивалентными гибридными орбиталями составляет 180°, а две орбитали P каждого человека остаются неизменными.
Задания по углероду. Алмаз и графит.
— Кислород C 0 + O с.2 -t°= co2 Углекислый газ при недостатке кислорода — неполное сгорание: 2c 0 + o2 -t°= 2c +2 o Монооксид углерода
— Водяной пар c 0 + при h2 O -1200°= C +2 O + H2 Пар.
— Оксиды металлов. Так происходит плавка металлов из руд. c 0 + 2cuo -t°= 2cu + c +4 o2
— Использование окислительных кислот: C 0 + 2H2 Итак.4 (кислота) = C +4 o2 + 2SO2 + 2H2 o c 0 + 4hno3 (кислота) = C +4 o2 + 4NO2 + 2H2 o
— Сера образует дисульфид углерода: C + 2s2 =сс2 C + 2s = cs.
Свободный углерод находится в виде алмазов и тонеров. Углерод в виде соединений содержится в минералах: меле, мраморе, известняке — Како3 (Како), доломит MGCO3 *Како.3 Углеводородные соли — Mg (нсо3 )2 и CA (HCO3 )2 CO2 Он входит в состав воздуха — углерод является основным компонентом природных органических соединений — газа, нефти, углерода, торфа, органических веществ, белков, жиров, углеводов и аминокислот, входящих в состав живых организмов.

Ни ионы C 4+, ни ионы C 4 не образуются в ходе обычных химических процессов. Соединения углерода имеют ковалентные связи разной полярности.
Оксид углерода (II) СО
Оксид углерода — бесцветный, без запаха, слабо растворим в воде, растворим в органических растворителях, токсичен, t°KIP = -192°C- T MEL = -205°.
Подготовка 1) Промышленность (газогенераторы): C + O2 = co2
2) В лаборатории — происходит термическое разрушение.2 Итак.4 (конденсат): HCOOH = h2 O + co
CO инертен при нормальных условиях — при нагревании он является восстановителем и несолевым оксидом.
Co + Cl2 -н = кокл2 (Фосген)
(4) Реагирует с щелочными жуками (под давлением).
co + naoh = hcoona (муравьиный натрий)
5) Переходные металлы образуют карбонилы.
Оксид углерода (IV) СO 2
Диоксид углерода, бесцветный, без запаха, растворимый в воде — при 1VH2 o 0,9 В растворяет co2 (при нормальных условиях) — тяжелее воздуха T° жидкости = -78,5°C (твердый CO2 Называется «сухой лед» — не поддерживает горение.
Co 2Химия кислотных оксидов: реагирует с основаниями с образованием основных оксидов и оснований
Может обладать окислительными свойствами при высоких температурах
c +4 o2 + 2 мг -t°= 2 мг +2 o + c 0
Качественные реакции
Размывание известняка:.
Совместно исчезают.2 В известняке нерастворимый карбонат кальция преобразуется в растворимый бикарбонат
Угольная кислота и её соли
h2 co.3 — кислота слабая и присутствует только в водном растворе.
Бикарбонат: h2 co3 ↔ H + + HCO3 — Кислоты являются бикарбонатами и бикарбонатами HCO3 — ↔ H + + co3 2-Умеренные соли — карбонаты.
Все свойства кислот являются характерными.
Карбонаты и углеводороды могут превращаться друг в друга:.
Карбонатные соли металлов (кроме щелочных металлов) при нагревании восстанавливаются и образуют оксиды.
Качественная реакция — «кипение» под воздействием сильных кислот.
Карбиды
Ацетилен выделяется, когда цинковые, кадмиевые, лантановые и антенные скульптуры реагируют с водой.
Интересно, что в этих экспериментах наряду с алмазами пытались гореть и другие драгоценные камни, например, рубины. Однако другие камни выдержали воздействие высоких температур, но только алмазы горели в незначительных количествах, привлекая внимание к их превосходным химическим свойствам.
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли, уголь занимает 11-е место по распространенности в природе. Содержание углерода в ней составляет 0,1% от массы коры Земли. Свободный углерод находится в виде алмазов и тонеров.
Большая часть углерода находится в виде природного кокоса карбоната кальция3 (мел, мрамор, известняк) и магний MGCO3а также горючие минералы.
Графит используется в производстве электродов и карандашей. CMS (C) производится методом сухой дистилляции (нагревание без воздуха). Он используется в качестве восстановителя при производстве металлов. Его способность рекламироваться на активированном угле также используется в медицине и противогазах (Рисунок 69).
Углерод
Уголь С включен под номером 6 в журнал Менделеева. Даже первобытные люди понимали, что при сжигании древесины образуется древесный уголь, который можно использовать для окраски стен пещер. Все органические соединения содержат углерод. Две наиболее изученные гомологичные модификации углерода — графит и алмаз.
Графит — это мягкое черное вещество, которое легко оставляет следы на бумаге и имеет металлический блеск.
Графит также является отличным проводником тепла и электричества. Графит используется в промышленности для производства смазочных материалов на основе графита и при изготовлении карандашей.

Фотографический графитовый жир
В отличие от графита, структура алмаза (еще одна гомологичная модификация) выглядит как тетраэдр. Помимо углерода, алмаз также содержит хром, кремний, алюминий, марганец, титан и железо. Углерод и азот составляют основную часть состава алмаза. Благодаря своей структуре, он не влияет на электричество и не обладает высокой теплопроводностью. Из алмазов получают драгоценные камни — бриллианты. Искусственные алмазы используются для изготовления режущих инструментов и абразивов.

Википедия.
Другой гомологичной формой углерода является фурелерен. Он состоит из множества атомов углерода, связанных ковалентными связями. Молекулы в сложной структуре фулерена удерживаются вместе электростатическими силами и силами Ван-дер-Ваальса. Свойства фулерена еще не до конца изучены. Однако благодаря его способности поглощать свободные радикалы уже известно, что эта гомологичная модификация углерода может быть использована в медицине.

Фотография молекулярного осаждения фулетния.
Химические свойства углерода
1. углерод — это неметалл, который может взаимодействовать с металлами, образуя углеводы
2.Углерод сгорает в два этапа в среде кислорода.
3.Когда углерод взаимодействует с водородом, образуется метан. Органическое вещество:.
4.При испарении воды под действием нагретого углерода образуются угарный газ и водород.
5. углерод не реагирует с хлором, бромом или йодом, но реагирует с фтором.
6. реакция с Богом:.
7. уголь может восстанавливать металлы из оксидов.
8. при повышении температуры углерод вступает в реакцию с серной кислотой.
Чтобы лучше понять свойства этого предмета, рекомендуется провести несколько ориентировочных экспериментов.
Углерод в органической химии
Углерод особенно часто встречается в журнальной системе. В зависимости от своей структуры он образует большие цепи линейных или кольцевых структур. Известно более 10 миллионов органических соединений. Несмотря на свое разнообразие, они постоянно преобразуются в углекислый газ и воду в воздухе и находятся под воздействием температуры.
Фото кредиты.
Роль углерода в нашей повседневной жизни огромна. Без углекислого газа основной биологический процесс фотосинтеза был бы невозможен.








