Благодаря своим гибким свойствам углекислый газ используется в промышленности, медицине и сельском хозяйстве. Сегодня CO2 — это удобрение в сельском хозяйстве, медицинский инструмент, регулятор температуры и новый источник энергии.
Получение CO2
В промышленности основным способом получения CO2 является преобразование метана CH4 в водород H2, реакции горения (окисления) углеводородов и побочные продукты разложения известняка CaCO3 на известь CaO и воду H2O.
Водород H2 необходим промышленности в основном для использования в производстве аммиака NH3 (процесс Харбор, каталитическая реакция водорода и азота). Аммиак также необходим для производства неорганических удобрений и азотной кислоты. «Водород можно производить различными методами, включая экологически чистый электролиз воды, но, к сожалению, все методы производства водорода, за исключением рекомбинации углеводородов, в настоящее время совершенно нерентабельны в больших масштабах, если нет избытка». Электроэнергия в производстве. Поэтому основным методом производства водорода, при котором также выделяется углекислый газ, является риформинг метана с помощью пара. При температуре около 700.1100°C и давлении 3,25 бар пар H2O реагирует с метаном в присутствии катализатора. CH4 с выделением синтез-газа (процесс эндотермический, т.е. поглощение тепла): CH4 + H2O (+ тепло) → CO + 3H2
Пропан может быть переформулирован аналогичным образом: Ñ3H8 + 3H2O (+ тепло) → 2CO + 7H2
И этанол (этиловый спирт): C2H5OH + H2O (+ тепло) → 2CO + 4H2
Даже бензин может подвергаться паровому риформингу. Бензин содержит более 100 химических веществ. Реакция парового риформинга изооктана и толуола: C8H18 + 8H2O (+ тепло) → 8CO + 17H2 C7H8 + 7H2O (+ тепло) → 7CO + 11H2
Так, при паровом риформинге углеводородного топлива образуются водород и CO (монооксид углерода). На следующем этапе процесса производства водорода монооксид углерода в присутствии катализатора вступает в реакцию переноса атомов кислорода O из воды в газ = CO окисляется до CO2, а водород H2 высвобождается в свободной форме. Реакция является экзотермической, выделяя около 40,4 кДж/моль тепла: CO + H2O → CO2 + H2 (+ тепло).
В промышленных условиях CO2, выделяющийся при риформинге углеводородов, легко отделяется и собирается. Однако CO2 является нежелательным побочным продуктом и выбрасывается только в атмосферу, наиболее распространенный сегодня метод удаления CO2, что нежелательно для окружающей среды, и некоторые заводы применяют более «продвинутые» методы, такие как инжекция. Смазать маслом. Либо в рецессии, либо выкачивая ее в море.
Получение CO2 при полном сжигании углеводородного топлива
Для углеводородов, таких как метан, пропан, бензин, парафин и дизельное топливо. Они сгорают, т.е. окисляются достаточным количеством кислорода с образованием углекислого газа, который обычно является водой. Например, реакция горения метана CH4 протекает следующим образом: CH4 + 2O2 → CO2 + 2H2O
Около 95% коммерчески доступного водорода в мире производится методом парового риформинга из углеводородов, в качестве которых в основном используется метан CH4, содержащийся в природном газе. Помимо парового риформинга, углеводородное топливо может давать водород и методами частичного окисления. Когда метан и другие углеводороды реагируют с достаточным количеством кислорода для полного сгорания топлива, они напоминают полное сгорание топлива, описанное выше. (CO2 углекислый газ и H20). Если кислорода подается меньше, чем стехиометрическое количество, продуктами реакции являются преимущественно водород H2 и монооксид углерода, с небольшим количеством монооксида углерода CO2, из которого извлекается диоксид углерода и другие вещества. Обычно процесс протекает на воздухе, а не на очищенном кислороде, поэтому и на выходе, и на выходе процесса содержится азот, который не участвует в реакции.
Частичное окисление — это экзотермический процесс, т.е. при реакции выделяется тепло. Частичное окисление обычно происходит гораздо быстрее, чем паровой риформинг, и требует меньшего реактора. Как показано в следующих реакциях, частичное окисление первоначально производит меньше водорода на единицу топлива, чем процесс парового риформинга.
Частичное окисление метана CH4: Ч. 1.4 +½o2 →Co + H2 (+ тепло)
Частичное окисление бензина с использованием изоконанов более 100 соединений, содержащихся в бензине, и растительных примеров более 100 соединений: C8h18 + 4o2 →8CO + 9H2 (+ тепло) c7h18 +3½o2 →7CO + 4H2 (+ тепло)
CO превращается в углекислый газ для получения дополнительного водорода — газа, уже упомянутого при описании реакции вытеснения воды кислородом → процесс паровой реформы: CO + H2O → CO2 + h2 (+ небольшое количество тепла)
CO2 при ферментации сахара
При производстве алкогольных напитков и хлебобулочных изделий из теста используется процесс брожения таких сахаров, как глюкоза, фруктоза и сахароза. -C2H5OH образуются этиловый спирт и углекислый газ. Например, реакция ферментации глюкозы C6H12O6 протекает следующим образом6h12O6 →2c2h5OH + 2CO2
Ферментация фруктозы C12H22O11 происходит следующим образом12h22O11 + h2o → 4c2h5OH + 4CO2

CO2 оборудование фирмы Wittemann
При производстве алкогольных напитков получаемый спирт является продуктом реакций брожения, даже если в этом нет необходимости. Углекислый газ может выделяться в атмосферу, а может оставаться в карбонатах. В хлебе все наоборот: CO2 необходим для образования пузырьков, вызывающих полноту теста, в то время как этиловый спирт почти полностью испаряется во время выпечки.
Поэтому многие компании, в основном дистилляторы, являются2 она — не нужна продукту, они создали бизнес по ее сбору и продаже. Газы из бродильных танков прогоняются через спиртоуловитель на углекислотный завод, где CO2 очищается, сжижается и разливается по бутылкам. Действительно, ликеро-водочные заводы являются основными поставщиками углекислого газа во многих регионах, и для многих из них продажа CO2 — далеко не последний источник дохода.
Существует целая индустрия оборудования для экспорта чистой углекислоты на пивоваренные и винокуренные заводы (Huppmann/Gea Brewery, Wittemann и др.) и для непосредственного производства углеводородов. Поставщики газа, такие как авиационные продукты и воздушные жидкости, также устанавливают CO2 для последующей очистки, сжижения и наполнения бутылок.
Поскольку углекислый газ является раздражителем для дыхательной системы, следующий вдох регулируется количеством CO При вдыхании происходит обмен — поступление кислорода и выделение углекислого газа.
По различным оценкам, глобальное потребление CO2 превышает 20 миллионов тонн в год. Такой высокий уровень потребления обусловлен требованиями пищевой и нефтяной промышленности, технологией приготовления напитков и другими промышленными применениями, такими как снижение цен на PH для водоочистных установок, металлургические проблемы (включая использование сварочных газов) и т.д.
Применение двуокиси углерода постоянно растет, поскольку оно простирается от промышленного применения до переработки пищевых продуктов, технического обслуживания изделий, механического производства от сварки и приготовления сварочных смесей до очистки поверхностей растворами «сухого льда». в сельском хозяйстве для питания растений, в газовой и нефтяной промышленности для тушения пожаров.
- в машиностроении и строительстве (для сварки и прочее);
- для холодной посадки частей машин;
- в процессах тонкой заточки;
- для электросварки, основанной на принципе защиты расплавленного металла от вредного воздействия атмосферного воздуха;
- в металлургии;
- продувка углекислым газом литейных форм;
- при производстве алюминия и других легкоокисляющихся металлов;
- в сельском хозяйстве для создания искусственного дождя;
- в экологии заменяет сильнодействующие минеральные кислоты для нейтрализации щелочной отбросной воды;
- в изготовлении противопожарных средств;
- применяется в углекислотных огнетушителях в качестве огнетушащего вещества, эффективно останавливает процесс горения;
- в парфюмерии при изготовлении духов;
- в горнодобывающей промышленности;
- при методе беспламенного взрыва горных пород;
- в пищевой промышленности;
- используется как консервант и обозначается на упаковке кодом Е290;
- в качестве разрыхлителя теста;
- для производства газированных напитков;

Напитки с углекислотой
Пить можно двумя способами: .
- При производстве популярных сладких и минеральных вод используется механический способ газирования, который предполагает насыщение углекислым газом какой-либо жидкости. Для этого необходимо специальное оборудование (сифоны, акратофоры, сатураторы) и баллоны со сжатым углекислым газом.
- При химическом способе газирования углекислоту получают в процессе брожения. Таким образом получается шампанское вино, пиво, хлебный квас. Углекислота в содовых водах получается в результате реакции соды с кислотой, сопровождающейся бурным выделением углекислого газа.

СО 2 как сварочный газ
С 1960 года сварка кустарников и углеродистой стали на двуокись углерода (CO2 ), в соответствии с требованиями ГОСТ 8050. В последнее время смеси сырых и солнечных газов получают все большее распространение в технологии машинной сварки, и многие из наиболее популярных газовых смесей содержат небольшие количества активного газа (CO2 или о2 ), который необходим для стабилизации сварочной дуги. Однако при сварке газифицированных и малослойных стальных конструкций на российских объектах основным защитным газом по-прежнему является углекислый газ2 благодаря природным свойствам этого защитного газа и его доступности.
Для уточнения стоимости или дополнительной консультации, пожалуйста, обращайтесь по телефону +7 (495) 545-44-62 или свяжитесь с нами.
Использование углекислого газа в производстве металлических изделий важно при сварке металла. Газовое облако защищает расплавленную область от активного кислорода. Он гарантирует однородность сварки и защиту от окисления. Совместно в металлургической промышленности.2 Также используется для
Диоксид углерода

Углекислый газ (двуокись углерода, CO2) образуется при взаимодействии двух элементов — кислорода и углерода. Углекислый газ образуется при сгорании углеводородов или углеродных соединений, при брожении жидкостей и в результате продуктов дыхания животных и человека. Он присутствует в атмосфере в небольших количествах. Растения поглощают углекислый газ из атмосферы и преобразуют его в органические компоненты. Когда этот газ исчезает из атмосферы, на Земле выпадает небольшой дождь и становится значительно прохладнее.
Углекислый газ тяжелее воздуха. Замерзает до -78°C При замерзании снег образуется из углекислого газа. При плавлении углекислый газ образует углекислоту. Отчасти благодаря своим свойствам углекислый газ иногда называют «одеялом» Земли. Он легко пропускает ультрафиолетовое излучение. Инфракрасное излучение испускается поверхностью углекислого газа в космосе.
Диоксид углерода доступен в жидкой форме, под высоким давлением и в газообразной жидкой форме при низких температурах. Газообразная форма углекислого газа извлекается из выхлопных газов при производстве спирта, аммиака и сжигании топлива. Газообразная форма диоксида углерода — это газ без запаха, цвета, нетоксичный, невзрывоопасный. В жидком состоянии углекислый газ представляет собой бесцветную жидкость без запаха. При уровне 5% углекислый газ накапливается на площади пола в плохо вентилируемых помещениях. Снижение процентного содержания кислорода в воздухе может привести к кислородному голоданию и удушью. Эмбриологи обнаружили, что клеткам человека и животных требуется всего около 7% углекислого газа и 2% кислорода. Углекислый газ является седативным средством для нервной системы и отличным анестетиком. Газ в организме человека участвует в синтезе аминокислот и обладает сосудорасширяющей активностью. Дефицит углекислого газа в крови приводит к спазму сосудов и повышенной секреции в гладких мышцах всех органов, носовых ходов, бронхов, а также полипов и аденоидов, и утолщению мембран из-за отложения холестерина.
Получение диоксида углерода
Углекислый газ может быть получен несколькими способами. В промышленности углекислый газ получают из доломита, известняка — природного карбонатного продукта — и обжигаемого газа. Газовую смесь промывают раствором карбоната калия. Смесь поглощает углекислый газ, который преобразуется в гидрокарбонат. Углеводородный раствор нагревается и разлагается с выделением углекислого газа. Промышленные методы получения углекислого газа закачиваются в бутылки.
В лабораторных условиях получение углекислого газа основано на взаимодействии бикарбонатов и карбонатов с кислотами.
Области применения диоксида углерода
В повседневной практике часто используется углекислый газ. В пищевой промышленности углекислый газ используется в качестве закваски для теста и консерванта. Он обозначается кодом E290 на упаковке продукта. Свойства углекислого газа также используются при производстве газированной воды.

Биохимики обнаружили, что смазывание углекислым газом очень эффективно для повышения эффективности различных культур. Однако этот метод смазки можно использовать только в теплицах. В сельском хозяйстве газ используется для создания искусственного дождя. Когда щелочная среда нейтрализуется, углекислый газ заменяет сильные минеральные кислоты. При хранении травы для создания газообразной среды используется углекислый газ.
В парфюмерной промышленности углекислый газ используется для производства ароматизаторов. В медицине углекислый газ используется в качестве антисептика в открытой хирургии.
При охлаждении углекислый газ превращается в «сухой лед». Жидкая двуокись углерода упаковывается в бутылки и отправляется потребителю. Углекислый газ в виде сухого льда используется для сохранения продуктов питания. При нагревании сухой лед испаряется без остатка.
Углекислый газ используется в качестве активатора при сварке проволокой. Во время сварки углекислый газ распадается на кислород и угарный газ. Кислород вступает в реакцию с жидким металлом и окисляет его.
В авиамоделизме углекислый газ используется в качестве источника энергии для двигателей. Углекислый газ в контейнерах используется для воздушного оружия.
В лабораторных условиях небольшая часть CO2. углеводороды, реакции с участием кислот. Углекислый газ является побочным продуктом реакций в производственных установках по извлечению кислорода и азота. CO2 хранится в цилиндрических установках. Вещество передается им.
Заключение
Диоксид углерода — простое и широко распространенное вещество, имеющее практическое применение в основных отраслях промышленности по всему миру. Он необходим для промышленности, медицины, производства продуктов питания и даже для нормальной жизни человека.
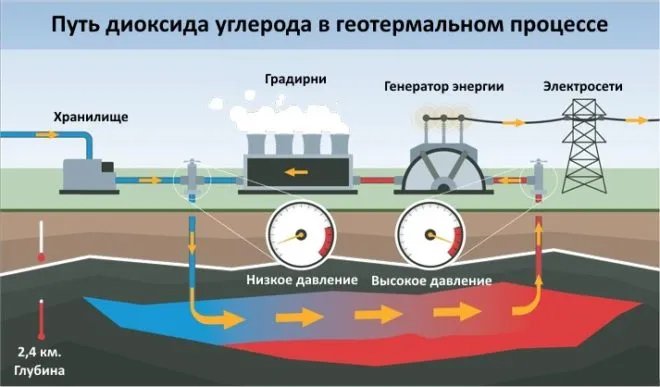
В последнее время CO2 используется в качестве основы для производства источников топлива (метанол). Его использование в качестве возобновляемого геотермального источника энергии также набирает популярность, увеличивая производство электроэнергии и сокращая выбросы газа.








