Эти основные принципы теории электролитического распада (ТЭР), означающие солюбилизацию (гидратацию) катионов и анионов, были завершены в 1891 году русским химиком И. Каблуковым. Используя теорию растворов Д. Менделеева, он доказал, что между растворителем и растворяемым веществом образуются химические связи.
Электролитическая диссоциация
Водные растворы некоторых веществ являются проводниками электричества. Эти вещества называются электролитами. Кислоты, основания, соли и расплавы некоторых веществ являются электролитами.
Процесс разложения электролита на ионы в водном растворе и его плавления под действием электрического тока называется электролизом.
Растворы некоторых веществ в воде не проводят электричество. Такие вещества называются неэлектролитами. К ним относятся многие органические соединения, такие как сахар и спирт.
Теория электролитической диссоциации
Теория электролитического распада была сформулирована шведским ученым С. Аррениусом (1887). Основными положениями теории С. Аррениуса являются.
-Электролиты растворяются (разделяются) на положительно и отрицательно заряженные ионы при растворении в воде.
-Под действием тока положительные ионы движутся к катоду (положительные ионы), а отрицательные ионы — к аноду (отрицательные ионы).
Разделение является обратимым процессом
Механизм электролиза заключается в ионно-дипольном взаимодействии между ионами воды и диполями (рис. 1).
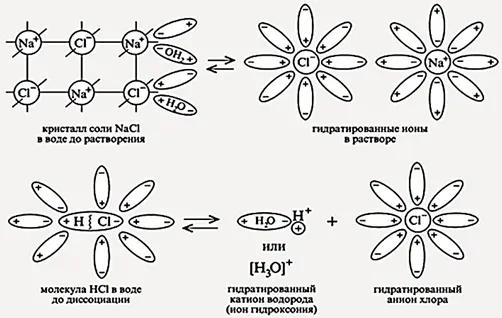
Рисунок 1.Электролиз растворов хлорида натрия.
Легче всего разделить вещества с ионными связями. Молекулы с полярными ковалентными связями (характер взаимодействия — диполь-дипольный) разлагаются аналогичным образом.
Диссоциация кислот, оснований, солей
При разложении кислот всегда образуются ионы водорода (H+), точнее, ионы водорода (H3O +), отвечающие за свойства кислоты (кислотность, маркерные эффекты, взаимодействие с основаниями и т.д.).
При разложении основания постоянно образуются ионы гидроксида водорода (OH-). Это отвечает за свойства основания (например, изменение цвета маркера, взаимодействие с кислотой).
Соли являются электролитами, и при их расщеплении образуются катионы металлов (или катионы аммония NH4 +) и анионы кислотных остатков.
Кислоты и полибазисные основания постепенно разделяются.
HSO4 -↔ H++SO4 2- (Шаг II)
Ca(OH)2 ↔ CaOH++OH- (стадия I)
Однако эта теория не могла учесть влияние тепла во время растворения. Например, при разбавлении серной кислоты водой колбу нагревают; при растворении нитрата аммония или аммиачной селитры в воде сосуд покрывают льдом.
Кажущаяся степень диссоциации.
Степень разложения зависит от концентрации и температуры раствора, а также от природы растворителя и растворяемого вещества.
Уравнение разложения может быть выражено как
Степень размерности может быть выражена следующим образом.
По мере увеличения концентрации раствора степень разложения электролита уменьшается. Это означает, что значение степени конкретного электролита не является постоянным.
Поскольку разложение является обратимым процессом, уравнение скорости реакции может быть записано следующим образом
Если размеры находятся в равновесии, то ритмы равны, и результатом является константа равновесия (константа размеров).
K зависит от природы растворителя и температуры, но не от концентрации раствора. Из уравнения следует, что чем больше число неразделенных молекул, тем меньше значение постоянной распада электролита.
Полибазовые кислоты разделяются по ступеням, каждая ступень имеет свое значение постоянной размерности.
При разделении полибазовых кислот легче всего отделить первый протон, но по мере увеличения заряда аниона отделить протон становится гораздо труднее из-за усиления притяжения. Например.
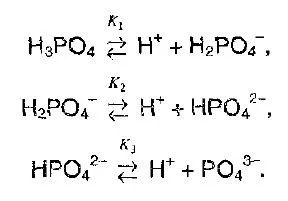
Константы разложения ортофосфорной кислоты должны сильно отличаться на каждой стадии.

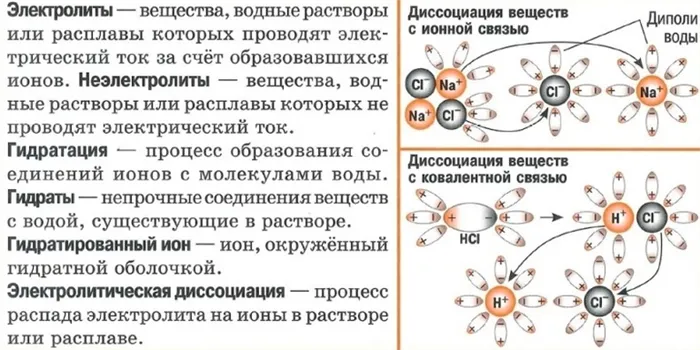
На первой стадии ортофосфорная кислота является умеренной кислотой, на второй — слабой, а на третьей — очень слабой.
Примеры констант равновесия для конкретных растворов электролитов.
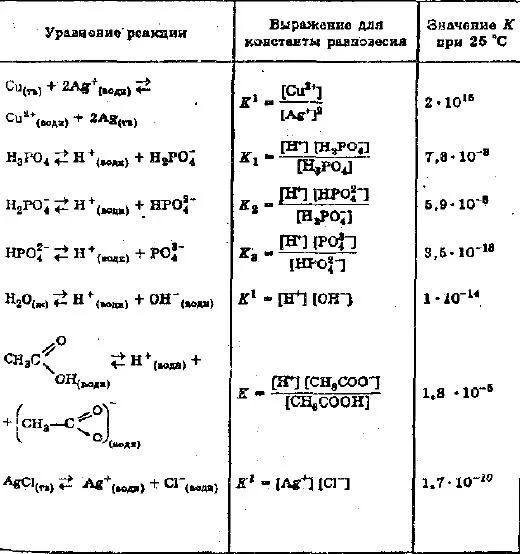
Если к раствору, содержащему ионы серебра, добавить ионы металлической меди, то концентрация ионов меди должна быть выше, чем концентрация серебра при равновесии.
Однако цена константы ниже.
Это указывает на то, что до достижения равновесия растворяется очень мало хлорида серебра.

Концентрации металлической меди и серебра вводятся в константу равновесия.
Ионное произведение воды .
В таблице выше приведены следующие данные
Эта константа называется ионным произведением воды и зависит только от температуры. Согласно распаду, на каждый 1 ион H+ приходится один гидроксид-ион. В чистой воде концентрация этих ионов одинакова: H+ = OH-.
Отсюда, H + = OH — =
При добавлении в воду посторонних веществ, таких как соляная кислота, концентрация ионов водорода увеличивается, но ионное произведение воды не зависит от концентрации.
Добавление щелочи увеличивает концентрацию ионов OH- и уменьшает водородный продукт.
Концентрации H+ и OH- взаимосвязаны. Чем выше один, тем ниже другой.
Кислотность раствора ( рН ).
Кислотность раствора обычно выражается как концентрация ионов H+. В кислой среде pH = 10 -7 моль/л, в щелочной среде pH > 10 -7 моль/л. Кислотность раствора выражается как отрицательный логарифм концентрации ионов H+ и называется pH.
Рассмотрим пример разложения уксусной кислоты.

Молекулярная концентрация C = 1 / V, заменяется уравнениями
Эти уравнения представляют собой закон разбавления В. Оствальда, согласно которому константа распада электролита не зависит от разбавления раствора.
В 1887 году шведский химик Аррениус сформулировал теорию распада электролитов. Теория объясняет, почему водные растворы солей, кислот и щелочей проводят электричество.
Механизм ЭД
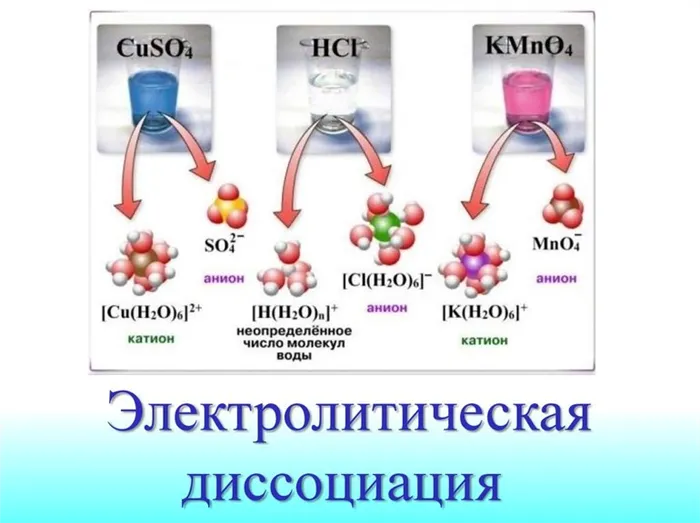
Когда соединение растворяется в воде, H2Молекулы O, которые являются биполярными, начинают ориентироваться вокруг ионов растворяющегося вещества. Полярная (+) молекула воды притягивается к отрицательному иону соединения и наоборот.
Межмолекулярные связи реагента ослабевают и разрушаются, позволяя ионам перемещаться через раствор. Там ионы соединяются с H2О и увлажнить. Это хорошо видно на примере ионизации NaCl.
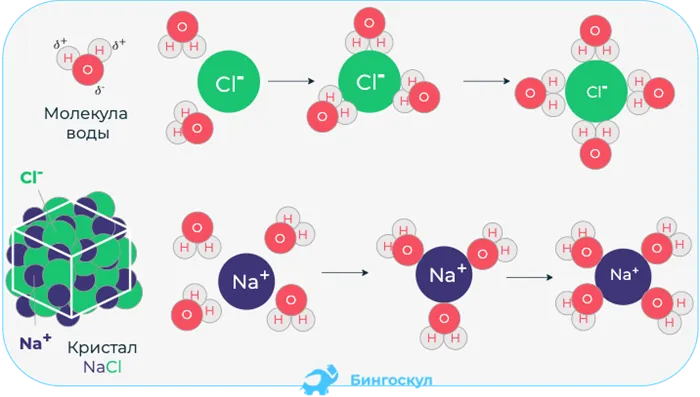
Схема электролитического разложения хлорида натрия на гидратированные ионы
Классификация и некоторые особенности диссоциации электролитных растворов
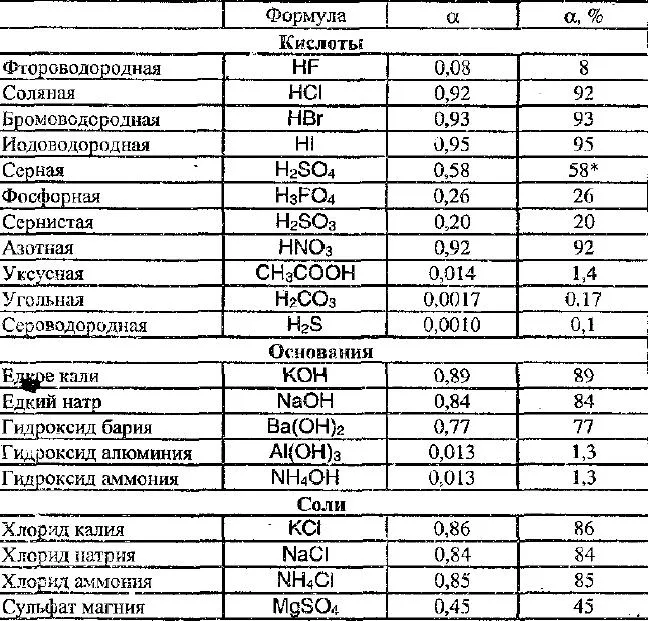
Исходя из степени ЭД, электролиты можно разделить на три группы (см. табл. 1).
Классификация электролитов
Сильные электролиты
Электролиты среднего диапазона
Слабые электролиты
Степень ценности (a)
α+ и анионы кислотных остатков.
(a) Для полиосновных кислот десорбция ионов H+ происходит поэтапно, причем наибольшая степень ионизации достигается на первом этапе.
(b) Из-за присутствия ионов H + кислота имеет кислый вкус и происходит окрашивание соответствующего маркера.
Как и кислоты, поликислотные основания постепенно разрушают гидроксид-ионы.
Цинк (OH)2 = ZnOH +OH-ZnOH+⇆Zn2++ OH-
Существует несколько вариантов этого процесса.
-
С образованием нормальных (средних) солей. Происходит полное замещение всех атомов водорода в кислоте на атомы металла.
Mg(OH)Cl⇆Mg(OH)+ Cl-Mg(OH)+⇆Mg2 + +OH-
Разложение также может привести к образованию двойных и смешанных солей.
Константа электролитической диссоциации
Наиболее распространенной характеристикой электролитов (особенно пациентов) является константа расщепления Kd.
В слабых электролитах ионизация неполная, поэтому существует баланс между невосстановленными молекулами и ионами. Процессы расщепления и связывания (образования молекул) происходят одновременно. Кe (a) по сравнению со степенью деградации дает более объективную характеристику ионизирующей способности электролита.
По мере увеличения Kee количество ионов увеличивается, и электролит становится сильнее. Для слабого электролита при заданной температуре константа разложения постоянна, тогда как для сильного электролита она изменяется в зависимости от концентрации раствора.
Кe и α связаны следующим уравнением: Кe = (α2-c)/(1-α), где c — молекулярная концентрация раствора.
На степень разложения особенно влияют природа растворителя, природа растворенного вещества, температура (в случае сильных электролитов степень разложения уменьшается с повышением температуры, но в случае пациентов она превышает максимум в диапазоне температур 60°C), концентрация раствора и введение в раствор синонимичных ионов.
Уравнение диссоциации
Уравнение распада электролита используется для регистрации процессов, происходящих в растворе.
Как указывает стрелка →, пробой сильных электролитов практически необратим.
Пробой слабых электролитов является обратимым процессом и осуществляется не полностью или не полностью, на что указывают стрелки βέ.
В.В.Еремин.При изучении книги «Химия.Книга «9 класс» под редакцией Еремина, «§13. ионообменные реакции и их условия» или решении ионных уравнений очень полезно знать, как составляется уравнение распада.
Противостояние титанов
Теория электролитического распада Аррениуса вызвала интенсивные дебаты среди ученых.
Химический мир разделился на два лагеря. Сторонники «естественной» теории Аррениуса считали, что ионный распад происходит независимо от внешней среды и что растворы представляют собой механические взвеси ионов и молекул воды.
Однако эта теория не могла учесть влияние тепла во время растворения. Например, при разбавлении серной кислоты водой колбу нагревают; при растворении нитрата аммония или аммиачной селитры в воде сосуд покрывают льдом.
Сторонники «химической» или гидратной теории, созданной Менделеевым, считали, что растворитель и сольвент взаимодействуют в растворе.
В этой битве многое было сломлено. Были выявлены самые худшие человеческие качества. Таким образом, несмотря на использование Аррениусом своего официального положения (он был назначен директором Нобелевского института физической химии в Стокгольме в 1905 году) и три номинации на Нобелевскую премию в 1905, 1906 и 1907 годах, Мендель так и не взял ее.
Но истина, как всегда, была посередине. В ходе дальнейших экспериментов ученые обнаружили, что растворитель и растворяемое вещество взаимодействуют, обеспечивая энергию, необходимую для разрушения решетки электролита. В ходе великой дискуссии умов родилась новая протолитическая или протонная теория кислот и оснований.
Согласно пятому утверждению, степень распада электролита варьируется от клетки к клетке. Она зависит от природы вещества и его концентрации в растворе.
СТЕПЕНЬ ДИССОЦИАЦИИ
Для количественной оценки выхода электролита было введено понятие степени деградации электролита.
Степень электролитической диссоциации (α) – отношение количества вещества электролита, распавшегося на ионы (nРазмеры.(n), количество вещества электролита, полученного в растворе (nВсего.):
Степень деградации также выражается в процентах, то есть 0%.< α < 100%.
Степень электролиза зависит от природы электролита, его концентрации в растворе и температуры. Степень электролиза увеличивается с увеличением разбавления и температуры.
Сравнивая степень электролиза при одинаковых условиях, можно оценить силу различных электролитов.
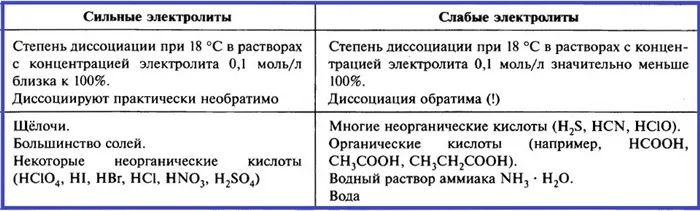
Всё об электрической диссоциации кратко в одной таблице.
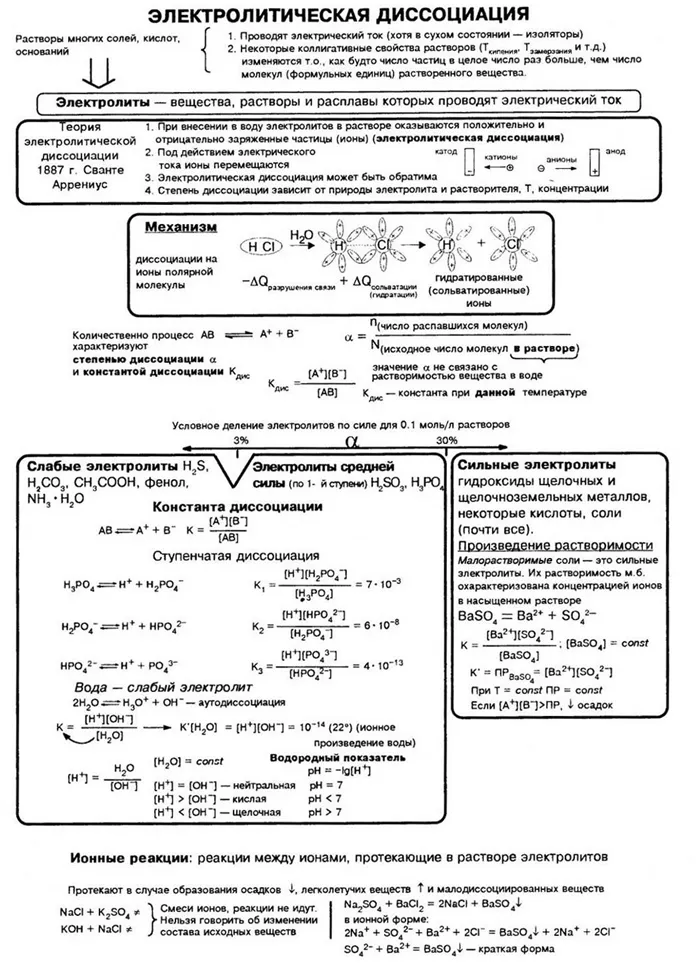
Для электролитического расщепления в таблице.
Обзор курса «Электролиз. Размерность».
Кислоты являются электролитами, и в их водных растворах образуется только один тип катионов — катион H+ (точнее, гидроксон-катион3O +).
Динамическое равновесие
Пациенты с электролитами не полностью разделены. При использовании этого решения процесс расщепления продолжается до определенной точки, а затем останавливается. Достигается динамическое равновесие. Это явление можно выразить в виде уравнения. Способность вещества распадаться на более мелкие частицы называется постоянной разложения или константой равновесия.
Чем активнее электролит, образующий ион, тем он сильнее и, следовательно, тем выше константа. Чем он слабее, тем ниже он будет. Значения фиксированного разбиения различных элементов, составляющих таблицу Mendeley, приведены в справочнике. Эти значения применимы только к водным растворам. Химические вещества ведут себя по-разному в неводных растворах.

Помимо воды, вещества могут растворяться в ацетоне, эфире, бензоле, спиртах и многих других жидкостях.
Основные положения теории
Электролиз является предметом научной теории, состоящей из пяти постов. Первый гласит, что при растворении электролитов в воде они разделяются на две категории ионов. Этот тип частиц представляет собой одну из возможных форм, в которых могут находиться химические вещества.
Индивиды и ионы обладают различными свойствами. Например, ионы натрия не образуют соединений с водой, в то время как индивиды натрия реагируют с водой. В результате взаимодействия образуются водород и щелочь. Индивидуальные и хлорид-ионы обладают разными свойствами. Первый токсичен, имеет желтый цвет и выделяет сильный запах, а второй не имеет запаха, бесцветен и небеден.
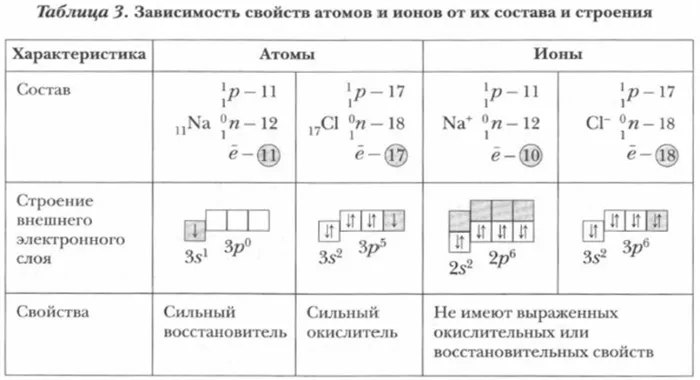
Когда человек или группа людей соединяют или дарят электроны, образуются ионы и отрицательные заряды. Выделяют простые и сложные ионы. В растворе эти частицы находятся в постоянном движении в виде отической смеси.
Суть следующей теории заключается в том, что расщепление вызывается взаимодействием между молекулами воды и электролита. При этом происходит разрушение химических связей последнего. В результате гидратации из молекул H2O образуются ионы. Эти частицы также называют гидратированными частицами. От негидратированных частиц их отличает наличие водной оболочки.

Третий принцип объясняет, как образуются катионы и анионы. При подаче электричества отрицательные ионы движутся вверх. Это представляет собой положительный полюс. Эти ионы называются анионами.
Положительно заряженные частицы движутся в сторону спуска — отрицательного полюса источника электричества. Эти частицы называются катионами. Поэтому ионы можно классифицировать в соответствии с их символами загрузки. Поскольку сумма катионов и анионов равна, раствор электролита всегда электрически нейтрален.
Согласно четвертому утверждению теории, электролиз с участием пациентов является обратимой процедурой. Одновременно с распадом вещества на ионы, последние объединяются.
Согласно пятому утверждению, степень электролиза варьируется от элемента к элементу. Она зависит от природы вещества и его концентрации в растворе.
Пациенты с электролитами не полностью разделены. При использовании этого решения процесс расщепления продолжается до определенной точки, а затем останавливается. Достигается динамическое равновесие. Это явление можно выразить в виде уравнения. Способность вещества распадаться на более мелкие частицы называется постоянной разложения или константой равновесия.
Электролитическая диссоциация
Когда Аррениус изучал растворы, он понял, что некоторые из них обладают электричеством. Чтобы понять, как именно это происходит, стоит вспомнить определение электричества. Это упорядоченное движение заряженных частиц. Поэтому эти частицы должны быть найдены в растворе.
Заряженные частицы, переносящие электричество, — это ионы. Они делятся на положительно заряженные катионы и отрицательно заряженные анионы.
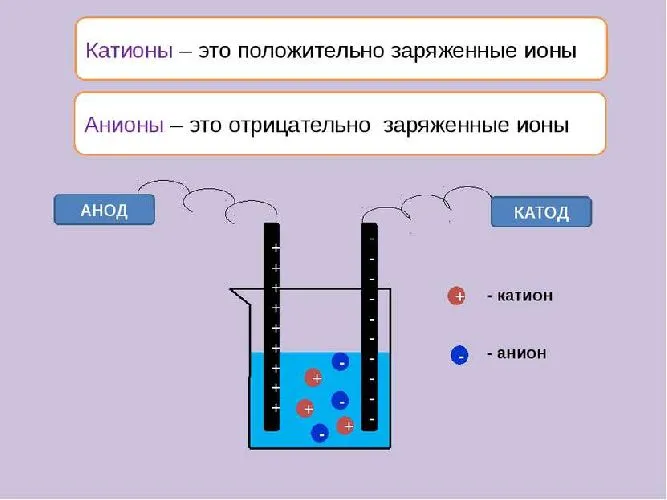
Рисунок 1. Катионы и анионы в воде.
Ионы образуются в результате разложения вещества. Это может происходить под действием молекул воды или при высоких температурах в расплавленных материалах. Расщепление молекул на ионы известно как электролитическое разложение.
Электролиты и неэлектролиты
Не все вещества в ионах разлагаются при контакте с водой. По этой причине существует различие междудве группы веществ:
- электролиты – молекулы распадаются на ионы;
- неэлектролиты – молекулы не распадаются на ионы.
Электролиты. Сложные неорганические вещества:.
- кислоты;
- основания;
- расплавы и растворы солей;
- твёрдые соли;
- некоторые твёрдые оксиды;
- гидроксиды.
Неэлектролиты — Большинство органических веществ. К ним относятся:.
Суть электролиза заключается в разрушении ковалентных полярных или ионных связей. Молекулы воды расщепляются на ионы, удаляя полярные молекулы и увеличивая полярность. При высоких температурах ионы в кристаллической решетке начинают вибрировать, и кристалл разрушается. Ковалентные неполярные связи, присутствующие в простых веществах, очень прочны и не разрываются от молекул воды.
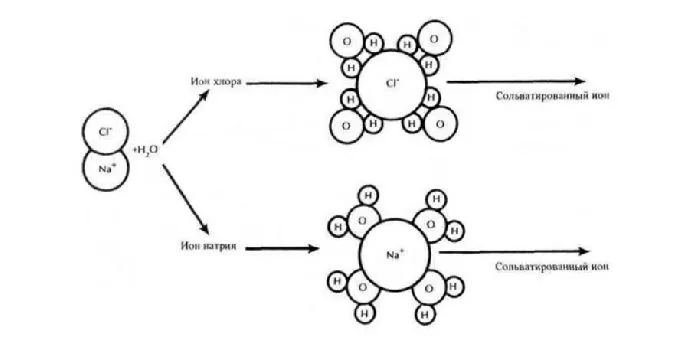
Рисунок 2.Молекулы воды образуют ионы натрия и хлорида.
Виды электролитов
Электролиз характеризуется степенью расщепления. Это величина, отражающая причину количества растворенных молекул по отношению к общему количеству молекул в веществе. Коэффициент разделения показывает соотношение молекул вещества, растворенного в ионах. Это выражается в средствах массовой информации
где n — число растворенных молекул, а n — общее число молекул.
Две группы электролитов сортируются по степени разделения.
- сильные – распадаются практически полностью в ненасыщенных растворах (сильные кислоты, соли, щёлочи);
- слабые – распадаются частично или не распадаются (слабые кислоты, малорастворимые соли, нерастворимые основания, гидроксид аммония).
Насыщенный раствор содержит небольшое количество растворенного вещества. Это означает, что в раствор можно добавить больше веществ.








