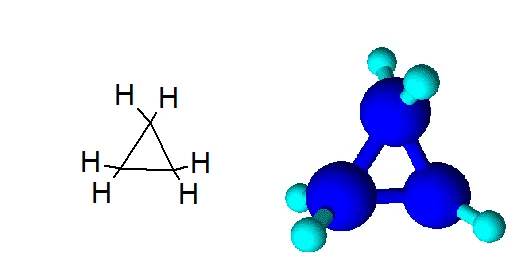
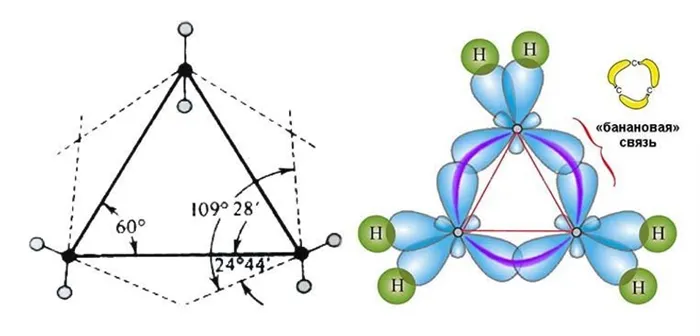
Молекулы малых циклических соединений характеризуются сильной угловой деформацией из-за большого отклонения тетраэдрического угла 109°28`109°28`. В тримерной молекуле циклопропана, где валентные углы в тримерном круге должны составлять 60°60°, они особенно велики:
Строение, получение и свойства циклоалканов
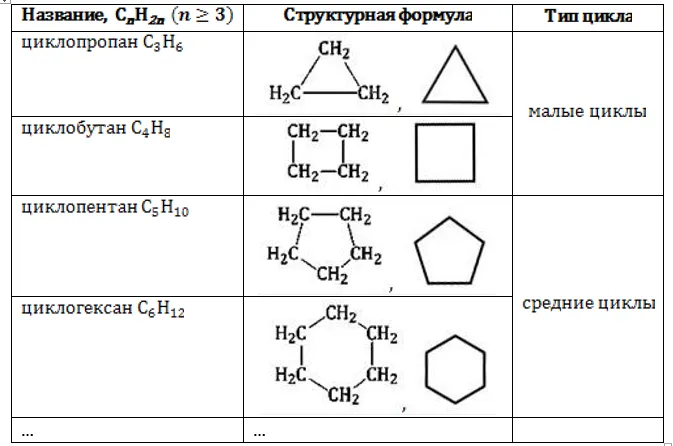
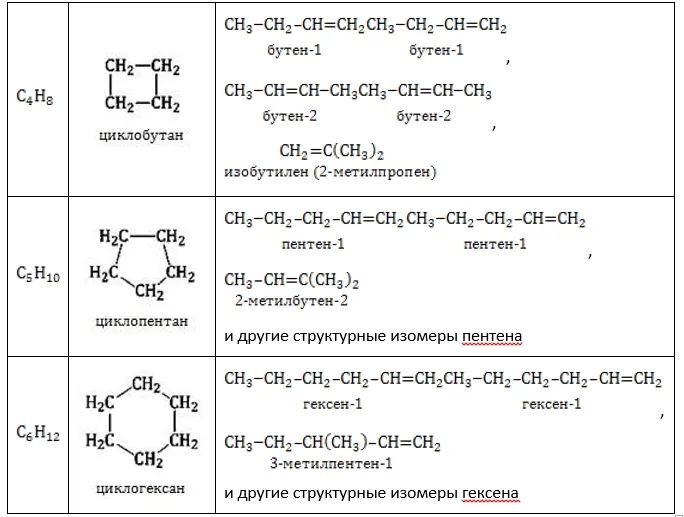
Циклоалканы (циклопарафины) — это насыщенные органические соединения, в молекулах которых атомы углерода связаны в циклы. Общая формула: CnH2n. Строение, получение и свойства циклоалканов отличаются от свойств обычные алканы с одинаковым числом атомов углерода.
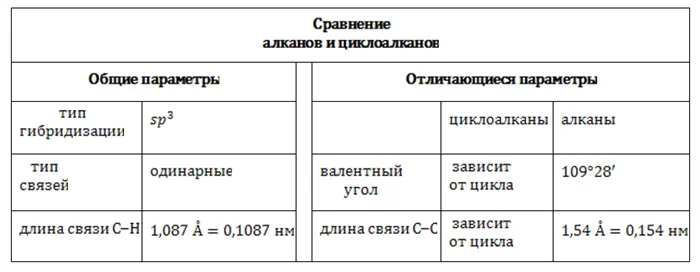
В молекулах циклоалканов Атомы углерода соединены друг с другом σ-связями. Стабильность циклопарафинов, т.е. прочность связей С-С, увеличивается с ростом числа атомов углерода, образующих цикл. Циклы делятся на малые ( C3, С4) и регулярные циклы ( C5 – С7 ).
Циклопропан считается представителем малого цикла:
- Молекула циклопропана представляет собой плоский цикл, образованный тремя атомами углерода; атомы водорода при этом расположены вне его плоскости и занимают энергетически невыгодное («заслоненное») положение, что способствует увеличению «напряженности» цикла и его неустойчивости.
- Валентные углы в плоском равностороннем треугольнике принимают значение равное 60°. А для sp 3 -гибридизованного атома углерода это значение соответствует 109,5°. В случае молекулы циклопропана, sp 3 -гибридизованные орбитали атомов углерода перекрываются между собой вне прямой, соединяющей ядра атомов. Образующиеся σ-связи с подобным способом перекрывания называют «банановыми». Их свойства обладают сходными чертами с π-связями, например, вступают в реакции присоединения.
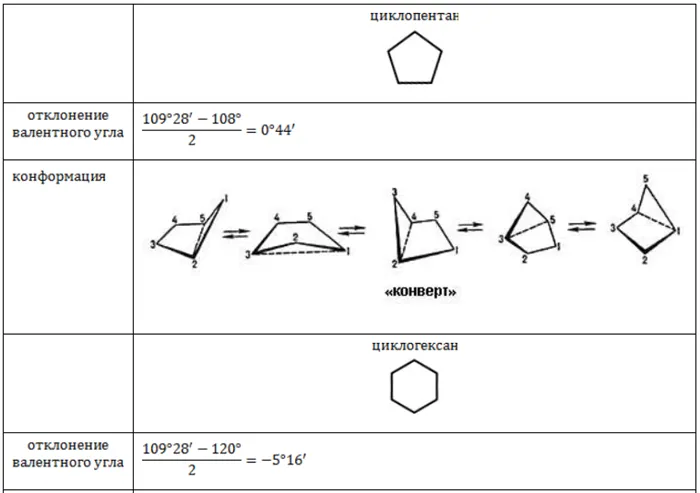
В отличие от тримерных циклов, стабильность пентамерных и гексамерных циклических алканов настолько высока, что они не поддаются деградации.
Показательным примером общего цикла является следующий цикл циклогексан .
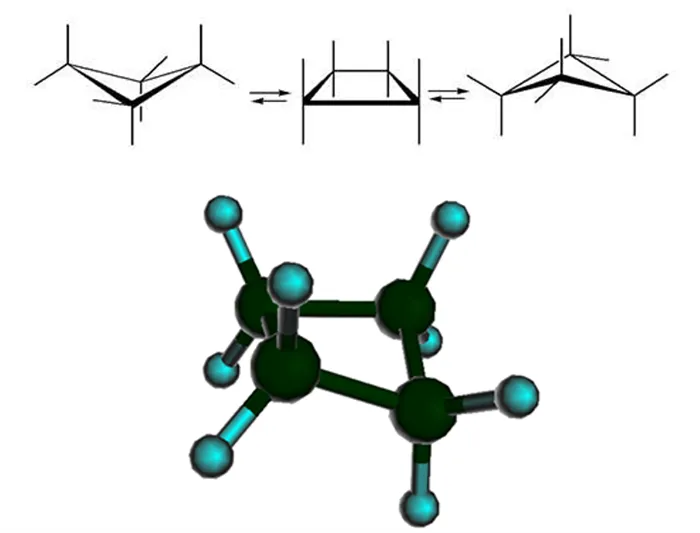
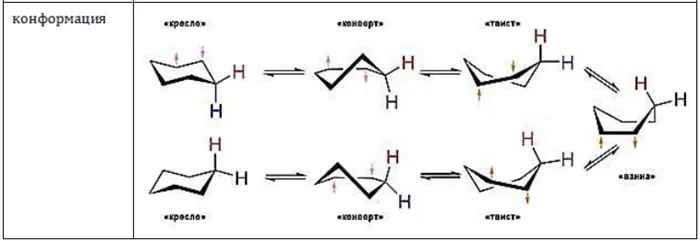
Для молекулы циклогексана она характеризуется не плоской структурой, а различными конфигурациями формы. С энергетической точки зрения наиболее благоприятными являются конфигурация кресла (более устойчивая) и конфигурация ванны. Валентные углы, образованные гибридными орбиталями атомов углерода в круге, составляют 109,5°, а атомы водорода соседних атомов углерода находятся в энергетически выгодном положении друг к другу.
Тетраэдрическое расположение связей вокруг каждого атома углерода способствует большей стабильности нормальных циклов по сравнению с малыми циклами. Реакции замещения возможны, реакции присоединения невозможны.
Физические свойства циклоалканов
При нормальных условиях циклоалканы кипят и плавятся при более высоких температурах, чем их алканы. По мере увеличения размера цикла температура кипения и плавления повышается. Циклоалканы C3 — С4 газы, C5 — С16 — являются жидкостями, C17 и выше — твердые вещества. Растворимость циклических алканов в воде очень низкая.
- Переработка нефти (получают циклогексан и его производные)
- Реакция отщепления.
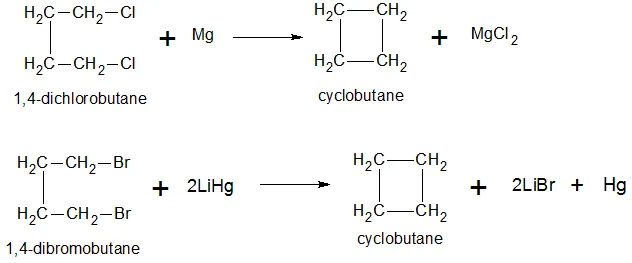
Когда два атома галогена извлекаются из дигалогенированных производных алкана получают тетрамеры и тетрамеры циклоалканы:
Методом Ружичка получают циклогексан и циклопентан. Метод основан на воздействии высоких температур на соли дикарбоновых кислот в отсутствие воздуха.
- Реакция гидрирования ароматических углеводородов в присутствии катализатора каталитического.
Путем нагревания бензола или его гомологов и водорода в присутствии никелевого катализатора получают циклогексан или их производные:
Химические свойства циклоалканов
Стабильность и, следовательно, реактивность коротких циклов и нормальных циклов значительно различаются.
Короткие циклы, такие как циклопропан и циклобутан, демонстрируют тенденцию к реакциям сложения, в то время как частые циклы (циклопентан и циклогексан) более характерны для реакций замещения.
1. Реакции присоединения
- Взаимодействие с сильными карбоновыми кислотами:

2. Реакции замещения (радикальный механизм)


3. Реакция дегидрирования
Присутствие катализатора приводит к образованию бензола:

4. Реакция окисления
Как минорные, так и нормальные циклы приводят к образованию двухосновных карбоновых кислот при окислении сильными окислителями (например, 50 % азотной кислотой, перманганатом натрия, дихроматом калия):
Молекулы малых циклических соединений характеризуются сильной угловой деформацией из-за большого отклонения тетраэдрического угла 109°28`109°28`. В тримерной молекуле циклопропана, где валентные углы в тримерном круге должны составлять 60°60°, они особенно велики:
Циклоалканы
Циклоалканы (циклопарафины, нафтены) — это циклические насыщенные углеводороды, химическая структура которых схожа со структурой алканов. Они содержат только простые одиночные σ-связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют более высокую плотность и более высокие температуры плавления и кипения, чем их алканы. Общая формула для их гомологического ряда: CnH2n.
Номенклатура и изомеры циклоалканов
Названия циклоалканов образуются путем добавления префикса «цикло-» к названию алкана с соответствующим номером: Циклопропан, циклобутан и т.д.
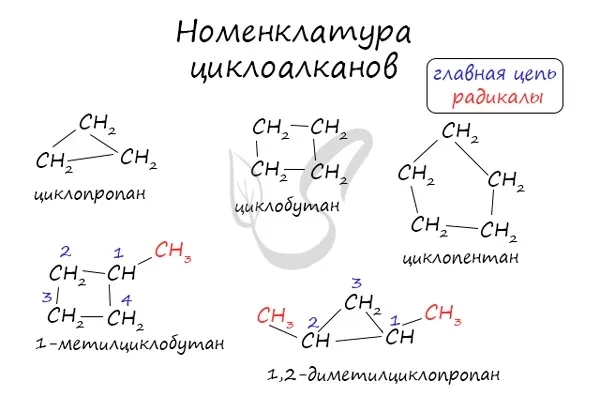
Как и в случае с алканами, атомы углерода циклоалканов находятся в sp 3 гибридизации.
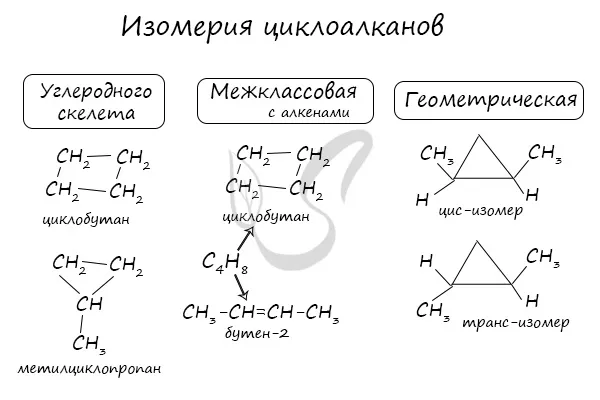
Помимо изомерии углеродного скелета, для циклоалканов характерны внутримассовые изомеры с алкенами и пространственно-геометрические изомеры в виде цис- и транс-изомеров.
Получение циклоалканов
-
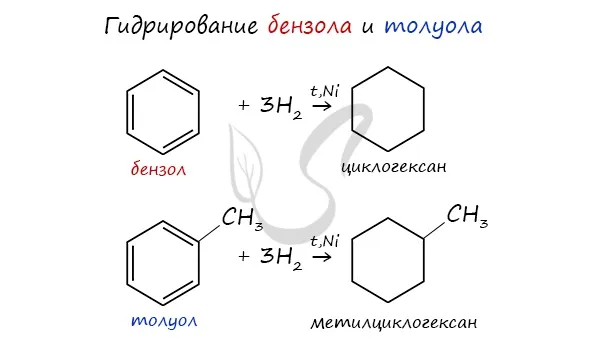
Из ароматических углеводородов
Циклоалканы можно получить Гидрогенизация (присоединение водорода) бензола и его гомологов.
В присутствии катализатора и при повышенной температуре алканы могут образовывать цикл отщепления водорода.
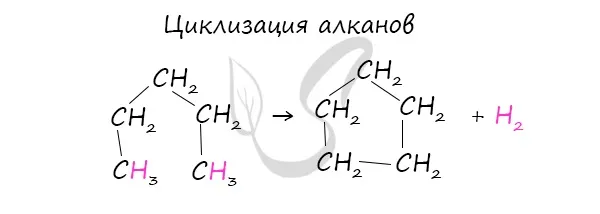
-
Абгалогенирование дигалогенированных алканов (межмолекулярная реакция Вюрца).
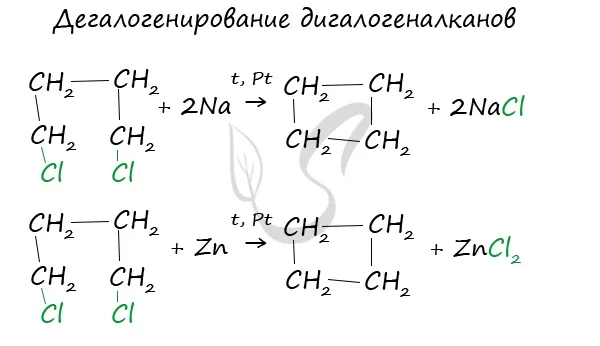
Химические свойства циклоалканов
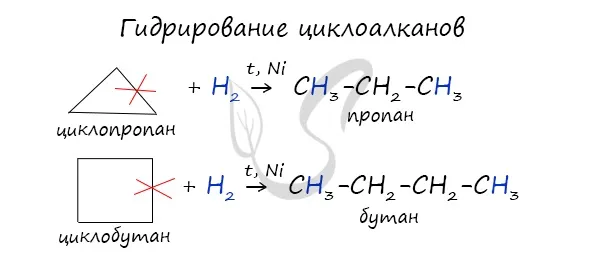
Важно отметить, что циклопропан и циклобутан подвергаются реакциям присоединения, в результате которых образуются свойства ненасыщенные соединения. Для циклопентана и циклогексана Реакции гидрогенизации не характерны для циклопентана; в основном они протекают через реакции замещения.
Циклопропан и циклобутан легче вступают в реакции гидрогенизации. Циклопентан и циклогексан не реагируют в реакциях гидрогенизации (в американских вопросах они не реагируют, но в действительности эти реакции идут, просто они чрезвычайно трудны).
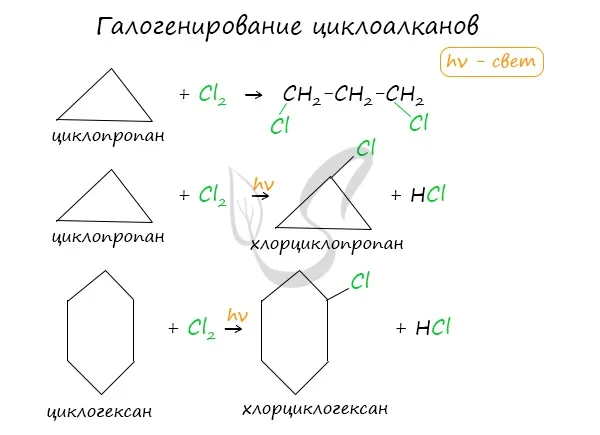
Без освещения циклопропан и циклобутан реагируют с хлором путем сложения. При освещении хлор образует свободные радикалы, и реакция протекает по механизму замещения, как и в случае с алканами.
У циклопентана и циклогексана Реакция протекает только по механизму замещения.
Циклопропан и циклобутан участвуют в реакциях гидрогалогенирования по механизму присоединения.
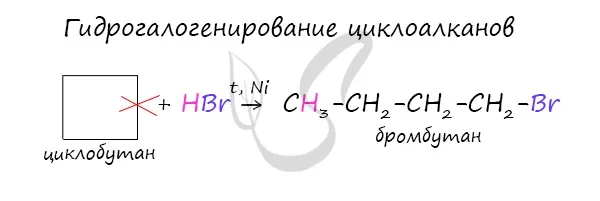
Когда водород удаляется от циклогексана образуется бензол, а в присутствии радикалов образуются гомологи бензола.
При нагревании с катализатором — AlCl3 циклоалканы образуют изомеры.

© Юрий Сергеевич Беллевич 2018-2022
ЦИКЛОГЕКСАН — бесцветная жидкость; температура кипения 80,7 °C. Он содержится в нефти и образуется при гидрогенизации бензола. Сырьем является для получения Адипиновая кислота, капролактам, растворитель. См. рис. Циклогексан… Большой технический энциклопедический словарь
Циклогексан
Получен гидрированием бензола в жидкой фазе при t 150-250°C и 1-2,5 МПа (выход 99%), также получен дистилляцией из нефтепродуктов.


Пример конфигураций с шестью циклами циклогексана 1 — «кресло»; 3, 5 — конфигурации «твист»; 4 — «ванна»; 2 — «полукресло» или «конверт».
| Углеводороды | |
|---|---|
| Алканы | Метан — этан — пропан — пропан — бутан — бутан — пентан — гексан — гексан — гептан — октан — нонтан — декан — андекан — додекан — тридекан — тетрадекан — гексадекан — эйкозан . |
| Alkenia | Этилен — Пропен — Пропен — Бутен — Пентен — Гексен — Гептен — Октен . |
| Алкины | Ацетилен — Пропилен — Пропилен — Бутилен |
| Диен | Пропадиен — Бутадиен — Изопрен |
| Другие ненасыщенные | Винилацетилен — Диацетилен |
| Циклоалканы | Циклопропан — Циклопропан — Циклопентан — Циклогексан — Декалин — Индан |
| Ароматика | Бензол — Толуол — Толуол — Диметилбензол — Этилбензол — Пропилбензол — Кумен — Стирол — Фенилацетилен — Индан — Циклобутадиен — Дифенил — Дифенилметан — Терфенилметан |
| Полициклические | Нафталин — Антрацен — Антрацен — Пентацен — Фенантрен — Пирен — Пирен — Бензпирен — Азулен — Хризен |
- Циклоалканы
- Углеводороды
- Продукция основного органического синтеза
Фонд Викимедиа. 2010.
Полезное
Смотреть что такое «Циклогексан» в других словарях:
циклогексан — циклогексан …. Орфографический словарь
ЦИКЛОГЕКСАН — (C6H12), бесцветный жидкий углеводород, встречающийся в природе в сырой нефти, но производимый для промышленного применения путем реакции между водородом и бензолом в присутствии катализатора. Циклогексан относится к группе соединений….
ЦИКЛОГЕКСАН — C6H12, бесцветная жидкость, с температурой плавления 80,74°C. Он содержится в нефти и образуется при гидрогенизации бензола. Сырьевые материалы для получения Капролактам, растворитель … Большой энциклопедический словарь
циклогексан — Синонимы: 5 — гексаметилен (3) — нафтений (4) — растворитель (67) … Словарь синонимов
При работе с сильными окислителями (например, 50% азотной кислотой). на циклогексан образует адипиновую кислоту (гексанедионовая кислота) в присутствии катализатора.
Способ получения циклогексанола из цикло-гексана

Изотоп 12 o.e.g., свидетельство о регистрации,1 выданное Государственным штабом тяжелой промышленности, зарегистрированное в Государственном реестре изобретений Республики Беларусь,1 euos. получен 3 Cyclohexanol in Industry, Inc. выпущен 4 июля 1936 года и опубликован 30 сентября 1933 года 3. получается путем гидрогенизации фенола. В литературе по патентам (E.R.339592, 1929) есть примечание о получении циклогексанола из циклогексена Под действием серной или фосфорной кислоты или различных органических кислот, но исключительно в присутствии катализаторов, авторы настоящего изобретения разработали способ получения циклогексанола из циклогексена серной кислоты без катализатора. Суть предлагаемого метода заключается в следующем что циклогексен К серной кислоте добавляют серную кислоту в таком количестве, чтобы температура реакционной смеси не поднималась выше комнатной температуры; по окончании поглощения серной кислоты реакционную смесь разбавляют до серной кислоты. циклогексена Серная кислота, реакционную смесь разбавляют ледяной водой и подвергают паровой дистилляции. Верхний слой концентрата отделяется, сушится и перерабатывается.циклогексена с серной кислотой, было обнаружено, что выход циклогексанолВыход зависит от серной кислоты реакции. В очень крепком гексаноле с 70-80 % серной кислоты скорость реакции при комнатной температуре. Температура близка к температуре окружающей среды. циклогексеиклГексан (по данным автора). циклогексето становится вы.циклогексанол более действительного сырья сырой нефти, чем то, которое описано в 42550) составляет 80″.получать Целью изобретения является получение более дешевого и устойчивого углеводородного сырья из нефтяного фенола. Метод получения из циклогексена, отл что к циклогексену Кислота добавляется к лизату трейсера при температуре реакции выше температуры окружающей среды реакционной смеси. к циклогексанолМетод лизита заключается в повышении температуры реакции до точки, где отсутствует катализатор 0 80» серы, чтобы масса не была расплавленной. 831 ст. Печатная работа
В молекулах циклоалканов Атомы углерода соединены друг с другом σ-связями. Стабильность циклопарафинов, т.е. прочность связей С-С, увеличивается с ростом числа атомов углерода, образующих цикл. Циклы делятся на малые ( C3, С4) и регулярные циклы ( C5 – С7 ).
Реакции присоединения (малые циклы (n=3,4)) — сходство с алкенами
1. гидрогенизация
Циклопропан, циклопропан, циклобутан очень легко присоединяют водород к соответствующим нормальным алканам.

2. галогенирование
Малые циклы (C3 — С4) может связывать бром (хотя реакция протекает сложнее, чем с пропеном или бутеном). Реакция с алкенами происходит при комнатной температуре, для циклоалканов и требуется отопление.

3. гидрогалогенирование.
Только небольшие циклы при нагревании снова реагируют с галогеноводородами.

Присоединение к гомологам циклопропана происходит по правилу Марковникова.

Реакции замещения (обычные циклы (n=5-7)) – сходство с алканами
1. галогенирование

2. нитрование

Реакции отслоения (физиологические циклы (n=5-7)) — Сходство с алканами
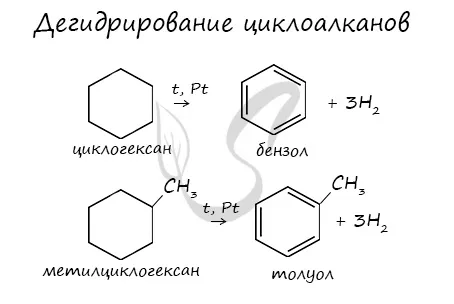
1. дегидрирование
Эти соединения вступают в реакции дегидрирования, как алканы.
Дегидрирования циклогексана (реакция Зелинского-Казанского) и их алкилпроизводные.
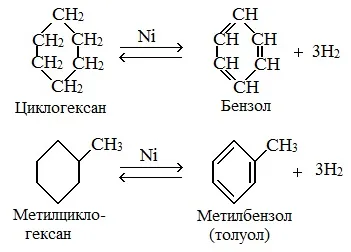
Реакции окисления
1. реакция горения

2. окисление в присутствии катализатора.
При работе с сильными окислителями (например, 50% азотной кислотой). на циклогексан образует адипиновую кислоту (гексанедионовая кислота) в присутствии катализатора.

Сравнение свойств
Столь резкое отличие в свойствах циклоалканов В зависимости от размера цикла, необходимо рассматривать не общий гомолог ряд циклоалканов, но их отдельные серии в зависимости от размера цикла.
Например, гомологический ряд циклопропана включает: циклопропан C3Н6, метилциклопропан C4Н8, циклопропан-этил C5Н10 и т.д.
Теги: циклоалканы
То есть, если циклоалканы малые циклы похожи на алкены, характеризуются реакцией полимеризации, твердым и мягким окислением перманганатом? А для циклоалканов нормального цикла — реакция изомеризации; я не утверждаю, просто интересно 🙂 🙂 🙂 🙂
ЦИКЛОГЕКСАН — C6H12, бесцветная жидкость, с температурой плавления 80,74°C. Он содержится в нефти и образуется при гидрогенизации бензола. Сырьевые материалы для получения Капролактам, растворитель … Большой энциклопедический словарь
Циклогексан с водой катализатор
Химические свойства циклоалканов в значительной степени зависит от размера цикла, который определяет его стабильность.
Тримерные и тетрамерные циклы (малые циклы) являются насыщенными, но все же сильно отличаются от всех других предельных углеводородов. Валентные углы в циклопропане и циклобутане намного меньше, чем обычный тетраэдрический угол 109°28′, свойственкоторый связан с sp 3 -гибридизованным атомом углерода.
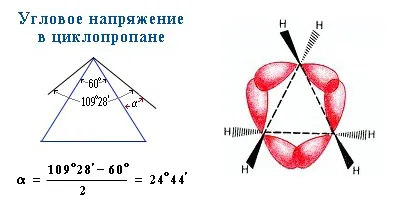
Это приводит к высокой интенсивности этих циклов и их склонности к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные подвергаются реакциям присоединения, которые имеют характер ненасыщенных соединений. Легкость реакций сложения уменьшается по мере уменьшения силы цикла в серии:
циклопропан > циклобутан >> Циклопентан.
Наиболее стабильными являются 6-членные циклы, в которых отсутствуют угловые и другие напряжения.
В циклах (начиная с C5), угловое напряжение снимается из-за непланарной структуры молекул. Поэтому для циклоалканов (С5 и выше), из-за их стабильности типичными являются реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
Реакции присоединения (малые циклы (n=3,4)) — сходство с алкенами
1. гидрогенизация
Циклопропан, циклопропан, циклобутан очень легко присоединяют водород к соответствующим нормальным алканам.

2. галогенирование
Малые циклы (C3 — С4) может связывать бром (хотя реакция протекает сложнее, чем с пропеном или бутеном). Реакция с алкенами происходит при комнатной температуре, для циклоалканов и требуется отопление.

3. гидрогалогенирование.
Только небольшие циклы при нагревании снова реагируют с галогеноводородами.

Присоединение к гомологам циклопропана происходит по правилу Марковникова.

Реакции замещения (обычные циклы (n=5-7)) – сходство с алканами
1. галогенирование

2. нитрование
Циклоалканы
Циклоалканы (циклопарафины, нафтены) — это насыщенные циклические углеводороды, химическая структура которых аналогична структуре алканов. Они содержат только простые одиночные σ-связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют более высокую плотность и более высокие температуры плавления и кипения, чем их алканы. Общая формула для их гомологического ряда: CnH2n.
Номенклатура и изомеры циклоалканов
Названия циклоалканов образуются путем добавления префикса «цикло-» к названию алкана с соответствующим номером: Циклопропан, циклобутан и т.д.

Как и в случае с алканами, атомы углерода циклоалканов находятся в sp 3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерны внутримассовые изомеры с алкенами и пространственно-геометрические изомеры в виде цис- и транс-изомеров.

Получение циклоалканов
В промышленности циклоалканы получают По-разному:
Циклоалканы можно получить Гидрогенизация (присоединение водорода) бензола и его гомологов.

В присутствии катализатора и при повышенной температуре алканы могут образовывать цикл отщепления водорода.

В лабораторных условиях циклоалканы можно получить в результате реакции альфа-галогенирования дигалогенированных алканов.
-
Абгалогенирование бихлоралканов (межмолекулярная реакция Вурца).

Химические свойства циклоалканов
Важно отметить, что циклопропан и циклобутан подвергаются реакциям присоединения, в результате которых образуются свойства ненасыщенные соединения. Для циклопентана и циклогексана Реакции гидрогенизации не характерны для циклопентана; в основном они протекают через реакции замещения.
Циклопропан и циклобутан легче вступают в реакции гидрогенизации. Циклопентан и циклогексан не реагируют в реакциях гидрогенизации (в американских вопросах они не реагируют, но в действительности эти реакции идут, просто они чрезвычайно трудны).

Без освещения циклопропан и циклобутан реагируют с хлором путем сложения. При освещении хлор образует свободные радикалы, и реакция протекает по механизму замещения, как и в случае с алканами.
У циклопентана и циклогексана Реакция протекает только по механизму замещения.

Циклопропан и циклобутан участвуют в реакциях гидрогалогенирования по механизму присоединения.

Когда водород удаляется от циклогексана образуется бензол, а в присутствии радикалов образуются гомологи бензола.

При нагревании с катализатором — AlCl3 циклоалканы образуют изомеры.

© Беллевич Юрий Сергеевич 2018-2021 гг.
Эта статья была написана Юрием Сергеевичем Беллевичем и является интеллектуальной собственностью Юрия Сергеевича Беллевича. Воспроизведение, распространение (включая копирование на другие сайты и интернет-ресурсы) или иное использование информации и объектов без предварительного разрешения правообладателя преследуется по закону. Для получения Если вы хотите получить разрешение на использование любой части этой статьи или ее содержания, пожалуйста, свяжитесь с нами. Юрий Беллевич. .
Acetyl

Он является пилотом ряда органических реакций.
Наведите указатель мыши на ячейку элемента, чтобы увидеть получить его краткое описание.
Чтобы получить Чтобы получить подробное описание элемента, щелкните на его названии.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |








