Важная реакция сложных эфиров — это их реакция с водой в присутствии кислоты или щелочи. Эта реакция называется гидролизом. Гидролиз является противоположностью реакции этерификации. Например, при гидролизе этилэтаната в присутствии сильной минеральной кислоты образуется этилэтанолевая кислота и этанол. Эта реакция является обратимой.
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, Химические и физические свойства, строение.
| Сложные эфиры — это органические вещества, молекулы которых содержат углеводородные остатки, разделенные карбоксильной группой -COO-, т.е. R1-COOH-R2. |
Общая формула соединения: глицерил тристеарат. сложных эфиров: СnH2nO2
Классификация сложных эфиров
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина. |

- Сложные эфиры многоосновных органических кислот.
Например, общая формула для сложных эфиров из CnH2n-2O4
Номенклатура сложных эфиров
В названии сложного эфира Сначала укажите алкильную группу, присоединенную к кислороду, а затем кислоту, заменив суффикс в названии кислоты ( -oic acid ) на суффикс -oat.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метил метаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Эскиз урока химии «Соединение эфиры. Жиры». Для учебных целей приведены выдержки из учебника «Химия. 10 класс : учебник для общеобразовательных учреждений : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — M. : Просвещение. Выберите другое действие:
Номенклатура
Названия сложных эфиров Они состоят из корня и названия кислоты с суффиксом «-at». Например:
Также используются тривиальные названия составной кислоты:
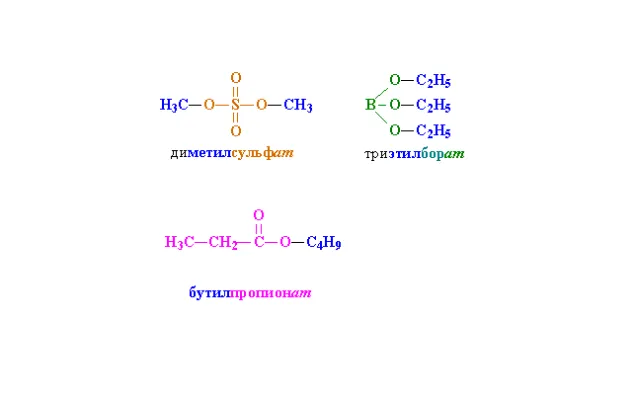
Рисунок 1. Структурные типы. сложных эфиров с названиями.
Классификация
В зависимости от их происхождения. сложные эфиры 1:
- эфиры карбоновых кислот – содержат углеводородные радикалы;
- эфиры Неорганические кислоты — включают остатки минеральных солей (C2H5OSO2OH, (CH3O)P(O)(OH)2, C2H5ONO).
(C(O2), которые являются наиболее разнообразными сложные эфиры карбоновых кислот. От сложности структуры зависят от их физических свойства. Эфиры низших карбоновых кислот представляют собой летучие жидкости с приятным запахом, а высшие эфиры — твердые вещества. Это нерастворимые соединения, которые плавают на поверхности воды.
Виды сложных эфиров В следующей таблице приведен обзор сложных эфиров карбоновых кислот.
Описание
Примеры
Жидкости, молекулы которых содержат не более восьми атомов углерода. Они обладают фруктовым ароматом. Состоит из одноатомных спиртов и карбоновых кислот.
Жидкости (масла) и твердые вещества, содержащие от девяти до 19 атомов углерода. Они состоят из глицерина и остатков карбоновых кислот (жирных кислот).
Оливковое масло представляет собой смесь глицерина с остатками пальмитиновой, стеариновой, олеиновой и линолевой кислот.
Твердые вещества с 15-45 атомами углерода

Рисунок 2 Воск.
Сложные эфиры Карбоновые кислоты являются основными составляющими ароматических эфирных масла, содержащиеся во фруктах, цветах и ягодах. Они также содержатся в пчелином воске.

Рисунок 3. Эфирные масла.
Получение
Получают сложные эфиры несколькими способами:
-
Реакция этерификации карбоновых кислот со спиртами:
Химические свойства сложных эфиров обусловлены функциональной группой -COOH. Самый важный свойства сложных эфиров описаны в таблице.
Реакция
Описание
Уравнение
При нагревании в воде он разлагается на кислоту и спирт. Под воздействием щелочи образуются соль и спирт.
Реакция возможна при наличии нескольких связей
Радикалы замещаются спиртовым остатком и аминогруппой
Сложные эфиры используются в косметике, лекарствах и в пищевой промышленности в качестве ароматизаторов, растворителей и наполнителей.
Эскиз урока химии «Соединение эфиры. Жиры». Для учебных целей приведены выдержки из учебника «Химия. 10 класс : учебник для общеобразовательных учреждений : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — M. : Просвещение. Выберите другое действие:
Сложные эфиры
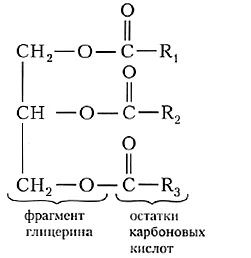
Сложные эфиры — Они являются производными карбоновых кислот, в молекулах которых атом водорода карбоксильной группы заменен на углеводородный радикал (рис. 1).
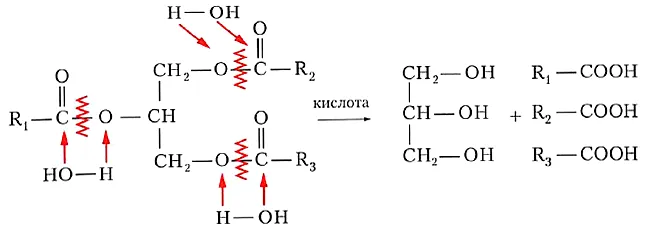
Рисунок 1: Молекулярная структура сложного эфира.
Сложные эфиры Низшие карбоновые кислоты и простые спирты — летучие жидкости, легко растворимые в воде, обычно имеют приятный запах и легче воды (например, плотность изомеров ацетата составляет 0,876 г/см3 ).
Сложные эфиры высшие спирты и карбоновые кислоты — твердые вещества, воски, например, ацетилпальмитат эфир (в сперматозоиде, одна из нуклеиновых кислот, участвующих в передаче наследственных признаков) и пальмитиновая кислота миристил пальмитат эфир (содержится в пчелином воске).
Получение сложных эфиров
Основные способы получения сложных эфиров — К ним относятся:
— взаимодействие кислот со спиртами
— взаимодействие безводных карбоновых кислот со спиртами
Химические свойства сложных эфиров обусловлены наличием функциональной группы. Наиболее важной является реакция гидролиза:
Сложные эфиры Он вступает в реакцию со следующими веществами:
— спирты (реакция переэтерификации)
— галогенирование, если углеводородный радикал представляет собой кратную связь
Применение сложных эфиров
Сложные эфиры для производства искусственных дистиллятов, используемых в производстве фруктовой воды, кондитерских изделий, косметики, ароматизаторов для моющих средств и т.д.
| Задание | Какая масса метанола образуется при гидролизе метилацетата (масса 10 г)? |
| Решение | Напишите уравнение гидролиза метила. эфира уксусной кислоты: |
Определите количество метилацетата, используя массу из задачи (молярная масса равна 84 г/моль):
В соответствии с уравнением n (CH3— C(O)O- CH3) = n (CH3OH) = 0,12 моль. Рассчитайте массу метанола (молярная масса равна 32 г/моль):
| Задание | Определите массу уксусной кислоты, которая составляет. получить В реакции омыления этилацетата массой 180 гр. |
| Решение | Напишите уравнение реакции гидролиза этилового эфира эфира уксусной кислоты используя брутто формулы: |
Рассчитайте количество этилацетата (молекулярная масса — 88 г/моль), используя значение массы из задачника:
Согласно уравнению реакции, количество молей этилацетата и уксусной кислоты одинаково:
Затем можно определить массу уксусной кислоты (молекулярная масса составляет 60 г/моль):
м(CH3COOH)= n (CH3COOH) × M (CH3COOH) = 2 × 60 = 120 г.
Вывод: Рассмотренные методы экстракции масла. эфирных Масла просты и не требуют дорогостоящего оборудования. Те, у кого есть доступ к свежим растениям или цветам, могут даже приготовить их дома. Составы, полученные из растительных экстрактов, безопасны для человеческого организма.
Как получить сложный эфир
Процесс получения сложных эфиров Это называется реакцией этерификации. Используя общие формулы, эта реакция описывается следующим уравнением.
Именно реакция этерификации в 1759 году возникла в результате взаимодействия уксусной кислоты с этиловым спиртом. был получен первый сложный эфир — этиловый эфир уксусной кислоты:

Обратите внимание на то, как построено имя. сложного эфира. Он состоит из четырех слов, которые указывают на название углеводородного радикала и исходной кислоты. Например, продуктом реакции муравьиной кислоты с метиловым спиртом является метил эфир муравьиной кислоты:
Катион водорода на схеме реакции указывает на то, что реакция этерификации происходит в присутствии кислотного катализатора.
Сложные эфиры Низкомолекулярные углеводороды — это легковоспламеняющиеся жидкости с характерным, часто приятным запахом. Они нерастворимы в воде, но легко растворяются в различных органических веществах.
Реакции гетерогенности обратимы. В присутствии кислот сложные эфиры Они гидролизуются в присутствии кислот, что можно считать обратимой реакцией. их получению:
Гидролиз в присутствии щелочей сложных эфиров В присутствии щелочей гидролиз необратим, поскольку образовавшаяся кислота соединяется со щелочью, образуя соль.способной вступать в реакцию со спиртом:
Нахождение в природе и применение сложных эфиров
Сложные эфиры В природе они встречаются нечасто. Неповторимый аромат цветов и фруктов часто обусловлен присутствием веществ этого класса. Состав эфиры Имея высокий молекулярный вес, они называются восками. Пчелиный воск представляет собой смесь сложных эфиров, образуются из карбоновых кислот и спиртов с длинными углеводородными цепями.
Синтетические сложные эфиры Он используется в пищевой промышленности в качестве добавки для придания напиткам и кондитерским изделиям фруктового вкуса. Благодаря своей хорошей растворимости способности сложные эфиры они содержатся в растворителях для лаков и красок.
Сложные эфиры подвержены гидролизу (разложению водой), который происходит двумя способами: кислотным и щелочным. Давайте рассмотрим каждый из этих типов.
Получение простейшего косметического средства на основе.
Получение сложных эфиров и эфирных Масла. Гипотеза, полученные в школьной лаборатории и дома. сложные эфиры и эфирные Масла могут использоваться для изготовления духов и в Рис. 3. Рисунок 3. сложных эфиров Из масел методом этерификации.
Уксусная кислота, кислота, удельный заряд, повышение температуры, волокно, растворитель для реакции, реакционная масса, молекулярный кислород, бензойная кислота, время пребывания. Микроорганизмы в ферментационной жидкости | статья в журнале.
К вопросу о компонентном составе эфирного масла Mentha.
Получение сложных эфиров и эфирных Масла Однако, поскольку настойка одуванчика имеет неприятный запах, ее не следует использовать в качестве ингредиента парфюмерной композиции. Инфузированные масла отличаются тем, что они не используются в качестве ингредиента для использования в аромате. от эфирных Качество масел отличается от качества других масел.
Производство пектина в промышленных условиях обеспечивает сложное производство с
Таким образом, для получения Пищевой пектин Пектиновые экстракты из сырья подсолнечника
Растительное сырье является богатым источником функциональных ингредиентов, главным образом.
Сравнение различных видов химических предобработок соломы.
Биомасса растений является наиболее распространенным возобновляемым источником энергии в природе.
Для облегчения процесса гидролиза растительное сырье подвергается предварительной обработке.
При смешивании уксусной кислоты и перекиси водорода образуется надуксусная кислота.








