Чтобы понять это, представьте себе чашку чая. Если добавить столовую ложку сахара и не перемешивать, сахар очень медленно и равномерно распределится в стакане. Однако, если перемешать ложкой, то скорость увеличивается!
Скорость химической реакции, ее зависимость от различных факторов
Скорость химической реакции — это изменение количества одной из реакций в час. При определенных условиях скорости химических реакций протекают с различными интервалами. Например, в водных растворах они движутся быстрее, чем на твердых поверхностях. Самые быстрые процессы происходят при взрыве газовой смеси. Понятие скорости реакции описывает изменение количества реактантов и продуктов реакции за определенный период времени. В зависимости от условий реакции различают гомогенные и гетерогенные процессы.
Гомогенные реакции протекают в однородной среде: газовой или водной. Реакторные взаимодействия происходят не точечно, а по всему объему. Скорость этой реакции рассчитывается с помощью следующих типов
Δn: Δtv= vОднородность.;
- n – обозначает разницу количества исходного (редко продукта) вещества в молях,
- t – временной отрезок, за который прошла реакция,
- V – объем газа.
Отношение химического количества вещества к опухоли выражается как концентрация ДК. В результате человек получает упрощенную форму
Δc: Δt= vОднородность.
Этот тип подходит для реакций, в которых все вещества находятся в одинаковом кумулятивном состоянии. Например, газы, жидкости.
Гетерогенные реакции характеризуются процессами, происходящими на двух экзистенциальных поверхностях контакта в различных кумулятивных ситуациях. Например, между газом и жидкостью, газом и твердым телом, жидкостью и твердым телом, двумя несмешивающимися жидкостями. Этот процесс характеризуется следующими типами.
Δc: Δts = mol: s*m 2 = v неравномерно, где
- S – площадь соприкосновения реагентов,
- t – время, за которое протекает процесс,
- c – концентрация реагирующих веществ.
При расчете типа существуют неопределенности. Процесс протекает при определенных условиях температуры, концентрации, площади и катализатора. Когда они изменяются, это влияет на скорость химической реакции.
Температура
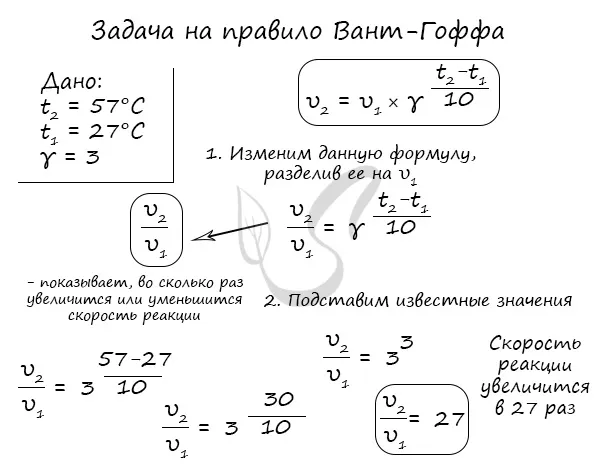
Повышение температуры ускоряет химический процесс. Это изменение объясняется следующим правилом Вант-Гоффа
- • Поднятие температуры на 10°С вызывает ускорение химической реакции в 2-4 раза. Скорость увеличивается с каждыми 10 единицами температуры.
В пробирке молекулы не увеличивают свою подвижность при повышении температуры. Однако они постоянно инвертируются друг относительно друга, что ускоряет процесс. Это правило объясняется уравнением
- vT1 – исходная скорость реакции,
- vT2 – конечная скорость процесса,
- у –коэффициент, который рассчитывается для каждой реакции,
- 10 – показывает увеличение на каждые 10°С.
Это правило действует не всегда, поскольку некоторые вещества могут испаряться, разлагаться или полностью разрушаться при повышении температуры.
Экзотермические и эндотермические реакции
Экзотермические реакции сопровождаются выделением большого количества тепла. Этот процесс быстрый и простой. При любой реакции кожи выделяется большое количество тепла. Это представляет собой энергию и записывается как +q.
Эндотермические реакции, с другой стороны, требуют большого количества энергии из внешних источников. Для проведения этих реакций реагенты нагревают в течение длительного времени. Они работают медленно в течение длительного времени и обозначаются -q.
Влияние температуры на такие системы влияет на скорость по-разному. Во внешних реакциях скорость уменьшается по мере увеличения скорости и наоборот. В эндотермических реакциях скорость увеличивается.
Во-первых, скорость реакции увеличивается, поскольку возрастает число столкновений частиц, а во-вторых, увеличивается число активных конкурентов. Именно активная конкуренция частиц приводит к этим взаимодействиям. Для того чтобы такая конкуренция имела место, частицам необходим определенный запас энергии.
Скорость химической реакции
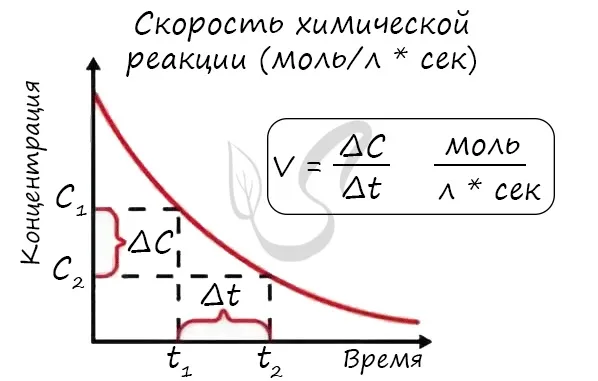
Скорость химической реакции является фундаментальным понятием в химической кинетике и описывает отношение количества реакции (моль) к периоду времени, в течение которого происходило взаимодействие.
Скорость реакции представляет собой изменение концентрации реагирующего вещества в единицу времени. Единицей измерения для гомогенных реакций является моль/л*секунда. Естественный смысл заключается в том, что каждую секунду количество одного вещества преобразуется в другое вещество в единицах объема.
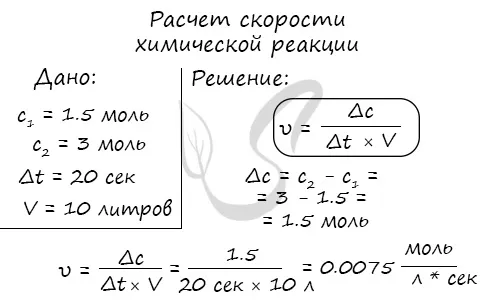
Мы столкнулись с проблемой, в которой даны молекулярная концентрация, время и объем вещества до и после реакции. Необходимо рассчитать скорость реакции. Например, попробуйте решить такую простую задачу.
Молекулярная концентрация вещества до реакции составляла 1,5 моль/л. После реакции она составила 3 моль/л. Объем смеси составлял 10 литров, реакция продолжалась в течение 20 секунд. Рассчитайте скорость реакции.
Влияние природы реактантов.
При изучении кумулятивного состояния вещества возникает вопрос: где реакция протекает быстрее: между газами, растворами или твердыми телами?
Обратите внимание, что самые быстрые скорости реакций наблюдаются между растворами в жидкостях. В газах он работает немного медленнее.

Если реакция гетерогенная (жидкость + твердое тело, газ + твердое тело, жидкость + газ), то важную роль играют поверхности контакта реагирующих веществ.
Очевидно, что большое количество железа в соляной кислоте реагирует гораздо дольше, чем измельченное железо (железные опилки).

Химическая активность также играет важную роль. Например, на вопрос «какой металл, Fe или Ca, быстрее реагирует с серой? Кальций находится слева от железа в последовательности активности металлов и поэтому предпочитает кальций, делая кальций более активным, чем железо.

Реакция металлов с водой требует другого подхода, необходимо учитывать индивидуальные радиусы. Например, для ответа на вопрос «какой металл быстрее реагирует с водой, Li или K», используется калий, поскольку он имеет больший атомный радиус. Калий реагирует с водой быстрее, чем литий.
Для правильного ответа на вопрос о скорости реакции может потребоваться знание активности кислоты. Более подробно это будет рассмотрено в разделе «Гидролиз», а пока отметим. Чем сильнее (активнее) кислота, тем быстрее протекает реакция.
Например, реакция между магнием и серной кислотой протекает гораздо быстрее, чем реакция между магнием и уксусной кислотой. Причина этого заключается в том, что серная кислота является сильной (активной) кислотой, тогда как уксусная кислота — слабая кислота и поэтому менее активна.
Как упоминалось ранее, слабые кислоты и сильные основания были изучены в области гидролиза.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции. При уменьшении концентрации реагирующего вещества скорость реакции увеличивается, при уменьшении — уменьшается.
Ниже объясняется одна деталь, которая может быть важна, если в реакции участвуют газы. При увеличении давления концентрация вещества в единице объема увеличивается (представьте, что газ сжат). Поэтому, если между исходными веществами есть газ, повышение давления увеличивает скорость реакции.
Поэтому ускоряющее действие катализатора заключается в снижении энергии активации основной реакции. Каждая промежуточная реакция с участием катализатора протекает при более низкой энергии активации, чем каталитическая реакция.
Концентрация
Фактическое число столкновений также можно варьировать, изменяя концентрацию реактивов. Понятие концентрации обычно используется для газов и жидкостей, поскольку в случае газов и жидкостей частицы быстро движутся и активно перемешиваются. Чем выше концентрация реагирующих веществ (жидкости или газа), тем больше число фактических столкновений и тем выше скорость химической реакции.
На основе многочисленных экспериментов в исследованиях норвежских ученых П. Грюденберга и П. Верге в 1867 году, русского ученого Н. Бекетова в 1865 году был выведен основной закон химических кинетических реакций от реактивных концентраций. Вещество:.
Скорость химической реакции прямо пропорциональна произведению концентрации реагирующего вещества на силу, равную коэффициенту в уравнении химической реакции.
Для химических реакций вида: AA + BB = CC + DD закон активной массы гласит
где v — скорость химической реакции, и
ca и вb — концентрации веществ A и B соответственно, моль/л
K — коэффициент пропорциональности, скорость реакции.
Например, для реакций в слое аммиака:.
Закон активной массы выглядит следующим образом
Константа скорости реакции показывает, с какой скоростью будет реагировать вещество, если его концентрация равна 1 моль/л/л или его продукт равен 1. Константы скорости химических реакций зависят от температуры и не зависят от реактантов.
Закон активной массы не учитывает концентрацию твердого вещества, так как оно обычно реагирует на поверхности и количество реагирующих частиц на единицу поверхности не меняется.
В большинстве случаев химические реакции состоят из множества простых этапов, поэтому химическое уравнение дает только общее или конечное уравнение происходящего процесса. В этом случае скорость химической реакции зависит (или не зависит) от концентрации реактора, промежуточных продуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально или на основе анализа предполагаемого механизма реакции. Как правило, скорость сложных химических реакций определяется скоростью медленных шагов (периферийных шагов).
Давление
Концентрация газа напрямую связана с давлением. При повышении давления концентрация газа увеличивается. Математическим выражением этой зависимости (для идеальных газов) является уравнение Менделеева-Клапейрона.
Таким образом, если между реагентами находится газообразное вещество, увеличение давления приведет к увеличению скорости химических реакций и уменьшению давления.
Например. Как изменилась реакция плавиковой извести с оксидом кремния:.
Реактив не содержит газа, карбонат кальция нерастворим в воде, а оксид кремния представляет собой твердое вещество. Газ представляет собой продукт углекислого газа. Однако продукт не влияет на скорость непосредственной реакции.
Катализатор
Другой способ увеличить скорость химической реакции — направить ее по другому пути. Например, заменив непосредственное взаимодействие с третьим веществом K серией последовательных реакций с веществами A и B (которая имеет более низкий барьер активации) и при определенных условиях развивается быстрее, чем непосредственная реакция. Это третье вещество называется катализатором.
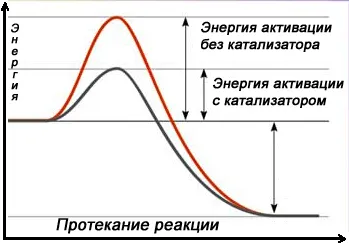
Катализатор — это химическое вещество, участвующее в химической реакции, которое изменяет ее скорость и направление, но не расходуется в ходе реакции (не изменяется в количестве или составе в конце реакции). Примерный каталитический механизм реакции A + B может быть выражен как.
AK + B = AB + K
Процесс изменения скорости реакции путем взаимодействия с катализатором известен как катализ. Катализаторы широко используются в промышленности, когда необходимо увеличить скорость реакции или направить ее в определенное русло.
В зависимости от фазового состояния катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ — это когда реактанты и катализатор находятся в одной фазе (газ, раствор). Типичный гомогенный катализ включает кислоты и основания и органические амины.
Гетерогенный катализ — это когда реактанты и катализатор находятся в разных фазах. Как правило, гетерогенный катализ является твердым. Поскольку такие каталитические взаимодействия происходят только на поверхности вещества, важным требованием для катализа является большая площадь поверхности. Гетерогенные катализаторы характеризуются высокой пористостью, что увеличивает площадь поверхности катализатора. Поэтому общая площадь поверхности некоторых катализаторов может достигать 500 квадратных метров на грамм катализатора. Большая площадь поверхности и пористость обеспечивают эффективное взаимодействие с реагентами. Гетерогенные катализаторы включают металлы, цеолиты и кристаллические минералы группы алюмосиликатов (соединения кремния и алюминия).

Примером гетерогенного катализа является синтез аммиака
Al и пористый Fe2O3 и K2O.
Хотя сам катализатор не расходуется в ходе химической реакции, другие вещества, которые связываются с активным центром катализатора и мешают его работе, накапливаются на его поверхности (отравление катализатора). Их необходимо периодически удалять путем регенерации катализатора.
В биохимических реакциях ферментные катализаторы доказали свою высокую эффективность. Ферментные катализаторы работают эффективно и избирательно со 100% селективностью. К сожалению, существуют некоторые ограничения для реализации процессов, катализируемых ферментами, в промышленных масштабах, поскольку ферменты очень чувствительны к повышению температуры, умеренной кислотности и другим факторам.
Если константа скорости k при температуре T1известна, определяется константа скорости k при другой температуре T.2Его легко получить, взяв логарифм уравнения Аррениуса для T1 и T2:.
Фактчек
- Скорость химической реакции – быстрота её протекания. То есть она показывает, насколько быстро расходуются реагенты и образуются продукты.
- Скорость абсолютно всех реакций зависит от температуры и от природы реагентов.
- Скорость некоторых реакций зависит ещё от нескольких факторов:
- газы зависят от давления и объема реакционного сосуда;
- катализатор применим только для каталитических реакций;
- концентрация вещества влияет чаще всего только на жидкости и газы;
- площадь соприкосновения реагентов – только на те реакции, где есть хотя бы один твердый реагент.
Задача 1. Что происходит в скорости реакции при увеличении концентрации водорода в следующей реакции: H2 + Cl2 = 2HCl
Задача 2. Факторы, не влияющие на скорость реакции: 6Li + N2 = 2Li3N
- Давление
- Добавление катализатора
- Температура
- Площадь поверхности соприкосновения веществ
Задача 3. Фактор, влияющий на скорость реакции: NaOH + HCl = NaCl + H2O
- Давление
- Разбавление смеси водой
- Добавление катализатора
- Площадь поверхности соприкосновения веществ
Ответы: 1. -1; 2.-2; 3.-2.
Химическая активность также играет важную роль. Например, на вопрос «какой металл, Fe или Ca, быстрее реагирует с серой? Кальций находится слева от железа в последовательности активности металлов и поэтому предпочитает кальций, делая кальций более активным, чем железо.
Скорость химических реакций. Факторы, влияющие на скорость химических реакций

В этом видеоклипе рассматривается скорость реакции и ее зависимость от различных факторов. Видеоурок включает материал по катализу и катализаторам, а также уравнения для расчета средних скоростей гомогенных и гетерогенных реакций.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам по этому и другим наборам, необходимо приобрести их в каталоге и добавить в личный кабинет.

Конспект урока «Скорость химических реакций. Факторы, влияющие на скорость химических реакций»
Кинетика химических реакций — это раздел химии, изучающий скорости и механизмы химических реакций.
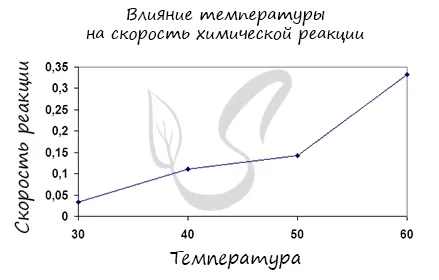
Химические реакции протекают с разной скоростью. Лаки и краски на картинах ремесленников носились веками. Процессы ржавления также протекают очень медленно. Взрывы — это мгновенная реакция, и процесс нейтрализации происходит прямо на ваших глазах.

Для осуществления химической реакции взаимодействующие частицы должны быть активными. Они должны увеличить свою энергию, чтобы преодолеть энергетический барьер, называемый энергией активации. Если активирующее действие низкое, то и скорость реакции высокая.

В химии исследуется вещество или ряд веществ, называемых системой. В этой системе части можно отличить от других частей — это и есть фаза.
Если система состоит из одной фазы, она называется однородной. Гомогенные системы — это газовые смеси или растворы. Гетерогенные или неоднородные системы — это системы, состоящие из различных фаз. Например, это смеси, состоящие из смесей твердых веществ, газы и твердые вещества, состоящие из жидкостей и твердых веществ, и смеси, состоящие из смесей.
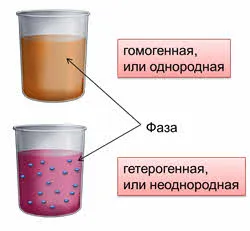
Поэтому реакции, происходящие в гомогенных системах, называются гомогенными реакциями, а реакции, происходящие в гетерогенных системах, называются гетерогенными реакциями. Равномерные реакции происходят во всей смеси, в то время как гетерогенные реакции происходят на границе раздела фаз.
Скорость гомогенной реакции — это количество вещества, прореагировавшего или образовавшегося в результате реакции за единицу времени в единице объема системы.

В этом типе в реакцию вступает определенное количество молекул вещества в определенное время, te — время, ve — объем системы.
Учитывая, что причиной отношения числа молекул к объему реакционной смеси является молекулярная концентрация, скорость гомогенной реакции можно определить по типу, где молекулярная концентрация используется с молекулами. В этом типе CE — это молекулярная концентрация реагирующего вещества в определенное время.
Следовательно, скорость гомогенной реакции выражается в моль в секунду и равна изменению концентрации реакции в единицу времени.
Поскольку скорость химической реакции может быть только положительной, признаки«положительный». отрицательный» символ, если концентрация молекул равна концентрации продуктов реакцииКонцентрация продукта реакции и символ «минусЕсли молекулярная концентрация равна концентрации исходного вещества.








