Щелочи реагируют с простыми неметаллами (кроме газов, азота, кислорода, водорода и углерода).
Что такое щелочные металлы
В группу щелочных металлов входят следующие металлы: литий Li, натрий Na, калий K, рубин Rb, цезий Cs и франций Fr. Они относятся к главной подгруппе группы I периодической таблицы. Все эти металлы похожи тем, что имеют один электрон во внешней электронной оболочке (Таблица 18). Щелочные металлы являются S-элементами. Электроны во внешней электронной оболочке атома щелочного металла находятся дальше от ядра, чем у других элементов того же периода. Это означает, что радиус атома щелочного металла больше, чем радиусы других элементов того же периода. В этом контексте.
Валентные электроны во внешнем слое атомов щелочных металлов отскакивают от ядра и превращаются в положительно заряженные ионы. Это связано с тем, что соединения между щелочными металлами и другими элементами основаны на типе ионной связи.
В окислительно-восстановительных реакциях щелочные металлы действуют как мощные восстановители, и эта способность возрастает от металла к металлу по мере увеличения атомного заряда атома.
Среди металлов щелочные металлы обладают самой высокой химической активностью. В ряду Тенденции все щелочные металлы находятся в начале ряда. Электроны во внешней электронной оболочке являются единственными валентными электронами. Поэтому щелочные металлы являются одновалентными во всех соединениях. Степень окисления щелочных металлов обычно равна +1. Физические свойства щелочных металлов перечислены в таблице 19.
Типичными представителями щелочных металлов являются натрий и калий. ■26. дать общее описание щелочных металлов по следующей схеме: а) сходства и различия в строении атомов щелочных металлов; б) особенности поведения щелочных металлов в окислительно-восстановительных реакциях; в) соединения типа кристаллической решетки в щелочах; г — особенности изменения физических свойств металлов в зависимости от радиуса атомов. (См. ответ).
Натрий
Электронная конфигурация атома натрия — ls22s 2 2p 63s1. Структура внешнего слоя:.

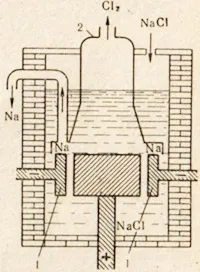
Натрий встречается в природе только в виде солей. Наиболее распространенными натриевыми солями являются поваренная соль NaCl, минеральный сильвинит KCl-NaCl и некоторые сульфиды, такие как GlauberNa2SO4-10H2O, обнаруженные в больших количествах в заливе Кара-Богаз-Гол в Каспийском море. Металлический натрий получают из поваренной соли NaCl путем электролиза расплавленной соли. Аппарат для электролиза показан на рисунке 76.76 Электроды погружены в расплавленную соль. Анодное и катодное пространства разделены мембраной, которая отделяет образующийся хлор от натрия, поэтому обратная реакция не происходит. Положительные ионы натрия принимают электроны от катода и превращаются в нейтральные атомы натрия. Нейтральные атомы натрия концентрируются на катоде в виде расплавленного металла. Процесс, происходящий на катоде, можно выразить так: Na + +Na0. Ионы натрия на катоде восстанавливаются, потому что катод принимает электроны, а принятие электронов атомом или ионом — это восстановление. На аноде ионы хлора высвобождают электроны. Это означает, что происходит процесс окисления и свободной эмиссии
Это можно представить в виде следующей диаграммы
Полученный металлический натрий имеет серебристо-белый цвет и легко режется ножом. Натриевые срезы имеют сильный металлический блеск при осмотре сразу после резки, но быстро тускнеют из-за очень быстрого окисления металла.
При окислении натрия в небольшом количестве кислорода при температуре около 180° получается оксид натрия: 4Na + O2=2Na2O. при сжигании кислорода образуется пероксид натрия: 2Na + O2=Na2O2. натрий горит ослепительным желтым пламенем. Натрий легко и быстро окисляется, поэтому его хранят под слоем парафина или парафина. Парафин предпочтительнее, потому что небольшое количество воздуха растворяется в парафине, и окисление натрия происходит медленно, но все же.
Натрий может давать соединения с водородом — гидрид NaH, где водород указывает степень окисления.1 Он выглядит как соль и по характеру химической связи и значениям степени окисления отличается от летучих гидридов элементов главной подгруппы IV-VII групп. Металлический натрий может реагировать не только с кислородом и водородом, но и со многими простыми и сложными веществами. Например, при измельчении в ступке, содержащей серу, натрий бурно реагирует с ней, образуя сульфид натрия: 2Na + S = Na2S
Реакция сопровождается блеском, поэтому держите раствор подальше от глаз и оберните руки полотенцем. Для реакции необходимо брать небольшие кусочки натрия. Натрий сильно сгорает в хлоре с образованием хлорида натрия. Это особенно заметно в трубках с хлоридом кальция, где поток хлора проходит через расплавленный и сильно нагретый натрий.2Na+ Cl2=2NaCl Натрий реагирует как с простыми веществами, так и с простыми веществами. Пример: вода используется для вытеснения водорода, так как это очень активный металл. Расположенный слева от водорода в ряду интенсивностей, он легко вытесняет последний водой: 2Na + 2H2O = 2NaOH+H2Если щелочной металл попал в ловушку, то огонь, не может быть потушен водой. Лучше всего покрыть пищевой содой. В присутствии натрия бесцветное пламя газовой горелки становится желтым. Металлический натрий может использоваться в качестве катализатора для органических композиций, например, в производстве синтетического бутадиенового каучука. Он служит исходным материалом для производства других соединений натрия. Перекись натрия.
Кислородные соединения натрия. Едкий натр
Кислородные соединения натрия, как уже упоминалось, это оксид натрия Na2O и пероксид натрия Na2O2. Оксид натрия Na2O не имеет особого значения. Он бурно реагирует с водой, образуя каустическую соду: Na2O+H2O=2NaOH Пероксид натрия Na202 представляет собой желтоватый порошок. Он имеет ту же структуру, что и H2O2, и поэтому может рассматриваться как разновидность соли перекиси водорода. Как и перекись водорода, перекись натрия является мощным окислителем. Под воздействием воды перекись водорода образуется со щелочью: Na2O2 + H2O = H2O2 + 2NaOH Перекись водорода также образуется под воздействием разбавленной кислоты в перекись натрия: Na2O2 + H2SO4+ можно использовать для отбеливания всех возможных материалов.
Очень важным соединением натрия является гидроксид натрия или каустическая сода, NaOH. Его также называют каустической содой или просто едким натром. Гидроксид натрия получают электролизом поваренной соли, самого дешевого природного соединения натрия, причем в этом случае используется не расплавленная соль, а солевой раствор (рис. 77). Описание процесса электролиза растворов поваренной соли см. в §33. §33. На рис. 77 показано, что анодное и катодное пространства разделены отверстием. Это делается для того, чтобы полученные продукты не взаимодействовали друг с другом. Cl2 + 2NaOH = NaClO + NaCl+H2O.
Гидроксид натрия представляет собой твердое белое кристаллическое вещество, полностью растворимое в воде. Когда гидроксид натрия растворяется в воде, выделяется много тепла, и раствор становится очень горячим. Гидроксид натрия следует хранить в хорошо закупоренных контейнерах, чтобы защитить его от проникновения водяного пара, который может разжижить его, и углекислого газа, который может превратить гидроксид натрия в карбонат натрия: 2NaOH + CO2 = H2O2+Na2. Гидроксид натрия является типичным веществом. щелочь, поэтому меры предосторожности при обращении с ним такие же, как и с другими щелочами. Гидроксид натрия используется во многих отраслях промышленности, включая переработку нефтепродуктов, производство мыла из жиров, бумажную промышленность, производство искусственных волокон и красителей, а также медицину. (рис. 78).
-Обратите внимание на использование каустической соды.
Среди натриевых солей NaCl является основным ингредиентом каустической соды и пищевой соды (более подробную информацию об этой соли см. на стр. 164), соды Na2CO3 (см. стр. 278), сульфата Na2SO4 (см. стр. 224) и нитрата натрия NaNO3 (см. стр. 250). Самое важное.

■32. Объясните, как получают каустическую соду путем электролиза соли? (См. ответ.) 33. Гидроксид натрия получается в результате действия карбоната натрия и извести. Составьте молекулярную и ионную формы уравнения этой реакции, а также рассчитайте количество соды, содержащей 95% карбоната, необходимое для получения 40 кг каустической соды. 34.Почему пробка «прилипает» к раствору каустической соды, когда он хранится во флаконе с абразивной пробкой, и ее нельзя удалить? Если флакон оставить перевернутым в воде на некоторое время, пробку можно свободно удалить. Уравнение реакции объясняет, какой процесс происходит в этом случае. 35.Написать уравнения реакций в молекулярной и ионной форме, описывающие свойства каустической соды как типичной щелочи. 36.Какие меры предосторожности следует соблюдать при работе с каустической содой? Какие меры первой помощи следует предпринять в случае ожога каустической содой? (См. ответы)
Это литий, калий, натрий, цезий, рубидий и франций. Только эти металлы называются щелочными. Они названы так потому, что при взаимодействии с водой образуют щелочи.
Общее описание
Активированные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и солончаковых почв:.
Электронная конфигурация щелочных металлов равна ns1, а щелочных земель — ns2.
Следовательно, постоянная валентность щелочных металлов — I, а земельных щелочных металлов — II. Благодаря низкому числу валентных электронов на внешнем энергетическом уровне, активные металлы обладают сильными свойствами восстановительного фактора и предоставляют внешние электроны для реакции. Чем выше число энергетических уровней, тем меньше привязка внешних электронов к отдельному ядру. Таким образом, свойства металла увеличиваются по группам сверху вниз.
Из-за своей активности металлы I и II групп встречаются в природе только в составе горных пород. Чистые металлы разделяются с помощью электролиза, тяги и реакций замещения.
Физические свойства
Щелочные металлы имеют серебристый и белый блеск. Сетционы — это серебристые металлы. Это самые активные и мягкие металлы. Натрий, калий, лубид и цезоль режут ножом. Их мягкость напоминает свечу.

Рисунок 2.Натрий разрезают ножом.
Щелочные земли имеют серый цвет. По сравнению со щелочными металлами они более твердые и плотные. Только сторонин можно разрезать ножом. Самый плотный металл — радио (5,5 г/см3).
Самыми легкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми и сложными соединениями, образуя соли, оксиды и щелочи. Основные свойства активных металлов приведены в таблице ниже.
AC
Щелочные металлы
Щелочь.
В воздухе витает любовь к себе. Пероксиды (ро2), за исключением лития и натрия. Литий образует оксиды при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
Защитные оксиды быстро образуются на воздухе. Самовосстанавливается при нагревании до 500°C.
Реагирует при нагревании с серой, водородом и фосфором.
Только литий реагирует с азотом; литий и натрий реагируют с углеродом.
Он бурно реагирует с образованием галогенированных:.
Образуется щелочь. Чем ниже металл в группе, тем активнее реакция. Литий реагирует спокойно, натрий реагирует с желтым пламенем, блестящие калий, цезий и лубид взрываются.
Они реагируют более активно, чем щелочные металлы, и достигают комнатной температуры.
В терпеливых и разреженных кислотах реагирует со взрывами. В органических кислотах он образует соли.
Только бериллий является единственным металлом, который вступает в реакцию:.
Все металлы вступают в реакцию, кроме бериллия. Замените наименее активный металл:.

Рисунок 3.Реакция калия с водой.
Щелочные и щелочноземельные металлы могут быть обнаружены с помощью качественных реакций. При горении металлы приобретают специфический цвет. Например, натрий горит желтым пламенем, калий — фиолетовым, барий — светло-зеленым, а кальций — темно-оранжевым.
Как правило, щелочные металлы встречаются в природе в виде минеральных солей, таких как хлорид, грязь, йод, карбонат и нитрат. Основные минералы, в которых присутствуют щелочные металлы:.
Строение атомов щелочных металлов:
Особенностью структуры атомов щелочей является то, что они содержат электроны на внешнем энергетическом уровне. Электронная конфигурация — ns 1. Щелочные металлы принадлежат к семейству.
Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, поскольку в интересах энергии устранять электроны и приобретать неактивные газы. Поэтому все щелочные металлы характеризуются своими восстановительными свойствами. Это подтверждается их низкими значениями динамической ионизации (атом каэсана имеет самый низкий потенциал ионизации) и их электронами. В результате в большинстве соединений щелочной металл присутствует в виде одного катиона.
Таким образом, электронная конфигурация лития для человека — 1S 2 2S 1. Атом лития состоит из активно заряженного ядра (+3), вокруг которого три электрона перемещаются в отдельные оболочки (два S-потребителя). Литий относится ко второму периоду и поэтому имеет только две оболочки. Один из них — внешний. В этом случае два электрона находятся на внутреннем уровне и один на внешнем. Первая — внутренняя оболочка представлена S-образной тележкой. Вторая — внешняя оболочка представлена S-Trolley. На внешнем энергетическом уровне атома цезана на орбитали 2S находится однозначный электрон. Электроны во внешней оболочке называются валентными электронами и отвечают за образование химических связей. Ядро атома лития состоит из трех протонов и четырех нейтронов.
Радиус атома лития составляет 145 пм. Ионизация атома лития (первый электрон) составляет 5,39 эВ (519,9 кДж/моль). Электронная воздушность лития составляет 0,98 (по шкале Полинга).
Электронная конфигурация натрия — 1S 2 2S 2P 6 3S 1. Натрий состоит из активно заряженного ядра (+11), вокруг которого в трех оболочках движутся 11 электронов. Таким образом, 10 электронов располагаются на внутреннем уровне и один на внешнем. Натрий находится в третьей фазе и поэтому имеет только три оболочки. Первая — внутренняя оболочка представлена S-орбиталью. Вторая — внутренняя оболочка представлена S- и P-тележкой. Третья — внешняя оболочка представлена S-образной тележкой. На внешнем энергетическом уровне атома натрия орбиталь 3 имеет невероятное количество электронов. Второе — ядро атома натрия состоит из 11 протонов и 12 нейтронов.
Световой луч атома натрия составляет 190 пм. Потенциал ионизации натрия составляет 5,14 эВ (495,6 кДж/моль). Электронная воздушность натрия составляет 0,93 (по шкале Полинга).
Электронная конфигурация калия — 1S 2 2S 2 2p 6 3S 2 3p 6 4S 1. Человек калия состоит из активно заряженного ядра (+19), вокруг которого в четырех оболочках движутся 19 электронов. Таким образом, 18 электронов располагаются на внутреннем уровне и один на внешнем. Поскольку калий находится в четвертой фазе, всего имеется четыре снаряда. Первая внутренняя оболочка представлена S-образной тележкой. Вторая и третья — внутренние оболочки представлены S- и P-тележками. Четвертая — внешняя оболочка представлена S-образной тележкой. Внешний энергетический уровень атома калия, орбиталь 4S, имеет неподтвержденный электрон. Второе — ядро атома калия состоит из 19 протонов и 20 нейтронов.
Луч калия составляет 235 пм. Потенциал ионизации калия составляет 4,34 эВ (418,5 кДж/моль). Количество электронов калия составляет 0,82 (шкала полинга).
Электронная конфигурация атома рубидия 1s22s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 65s1. Атом рубидия состоит из положительно заряженного ядра (+37), вокруг которого в пяти оболочках движутся 37 электронов. Таким образом, 36 электронов находятся на внутренней поверхности и один электрон — на внешней. Рубидий находится в пятой фазе и поэтому имеет в общей сложности пять оболочек. Первая внутренняя оболочка представлена s-орбиталью. Вторая и четвертая — внутренние оболочки представлены s- и p-орбиталями. Третья — внутренняя оболочка представлена s-, p- и d-орбиталями. Пятая — внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома рубидия на орбитали 5s находится неспаренный электрон. Ядро атома рубидия состоит из 37 протонов и 48 нейтронов.
Физические свойства щелочных металлов:
Все щелочные металлы серебристо-белые (кроме цезия, который серебристо-желтый), очень легкие, мягкие и растекающиеся, их можно резать скальпелем и ножом. Щелочные металлы имеют низкую плотность. Например, литий, натрий и калий легче воды и вступают в реакцию, плавая на поверхности. Щелочные металлы обладают высокой тепло- и электропроводностью. Их температуры плавления и кипения низкие.
Плотность, температура плавления, температура кипения и твердость щелочных металлов уменьшаются с увеличением порядкового номера.
Химические свойства щелочных металлов:
Все щелочные металлы высокоактивны. Они особенно эффективны при реакции с водой, кислородом, галогенами и другими соединениями. Поэтому щелочные металлы хранятся под слоем парафина или в запаянных ампулах. В соединениях щелочные металлы проявляют только +1 степень окисления. Все соединения щелочных металлов являются по существу ионными. Почти все соединения растворимы в воде.
По мере увеличения порядкового номера щелочные металлы проявляют более сильные металлические и более слабые неметаллические свойства, их восстановительная способность увеличивается, а щелочная реакционная способность возрастает.








