Серная кислота производится промышленным способом из диоксида серы (SO)2Он образуется при сгорании серы или диоксида серы. Два основных процесса образования кислоты:
Серная кислота
серная кислота H2Итак.4 -сильная дибазовая кислота, соответствующая высшему состоянию окисления (+6) серы. При нормальных условиях концентрированная серная кислота представляет собой маслянистую жидкость без запаха, цвета, с кисловатым «медным» вкусом. В технике серной кислотой называют смесь воды и безводной серной кислоты SO3. В случае молекулярного соотношения SO3 : H2O< 1, то это водный раствор серной кислоты, если >1 — раствор SO3 в серной кислоте (дымящаяся серная кислота).
Физические и физико-химические свойства
18 oCpK очень сильная кислотаa (1) = -2,8, pKa (2) = 1,92 (K₂1,210 -2), длины внутримолекулярных связей S = O 0,143 нм, S-OH 0,154 нм, углы HOSOH 104°, OSO 119°, кипячение с образованием азеотропной смеси (98, 3% H2Итак.4 и 1,7% H2O) с температурой кипения 338,8°C. Серная кислота, соответствующая 100% H2Итак.4, в составе (%): H2Итак.4 99,5, HSO4 — 0.18, H3Итак.4 +-0.14, H3O +-0.09, H2S2O7+-0.04, -0.04, HS2O7—0.05. Смешать воду и SO3во всех соотношениях. В водном растворе серная кислота почти полностью растворяется в H+, HSO4 -, и SO₄2-. образуя гидрат H2Итак.4-n H2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Масло также содержит пировиноградную кислоту, которая образуется в результате реакции
.» width=»» height=»» />
Температура кипения раствора серной кислоты повышается с увеличением концентрации, достигая 98,3% H.2Итак.4.
Свойства водных растворов серной кислоты и олеума| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2Итак.4 | Итак.3 (свободный) | |||
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения нефти с увеличением содержания SO3 содержание снижается. По мере увеличения концентрации раствора серной кислоты давление паров всего раствора снижается до 98,3% H.2Итак.4 достигается минимум. По мере снижения содержания SO3 растение, общее давление пара над ним увеличивается. Давление пара водных сульфатных и масляных растворов можно рассчитать по следующему уравнению
\ \ \ \ \ rm \> \> \> \> \> \> 2126 «width =» «» height =» «» />
Значения коэффициентов A и B зависят от концентрации серной кислоты. Пары раствора серной кислоты состоят из смеси паров воды, H2Итак.4 и т.д.3и состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
Разложение увеличивается с повышением температуры:.
.» width=»» height=»» />
Уравнение постоянного равновесия в зависимости от температуры:
Химические свойства
Серная кислота является мощным окислителем, особенно при нагревании и в концентрированном виде, окисляя HI и частично HBr свободными галогенами, а углерод — CO2и S — SO.2S до SO окисляет многие металлы (например, Cu, Hg). В ходе процесса серная кислота восстанавливается до SO2и под действием самых мощных восстановителей — S и H2S. обогащенный H2Итак.4 Он частично восстанавливается водородом и поэтому не подходит для сушки. Разбавить H2Итак.4 Когда производится водород, он реагирует со всеми металлами в последовательности электрохимического напряжения слева от водорода. Окислительные свойства разбавленной H2Итак.4 Не типично. Серная кислота образует два ряда солей: средний сульфат и сероводород, а также сложные эфиры. Пероксо-моносульфат (или кароевая кислота) H2Итак.5 и пероксокислота H2S2O8 Кислоты.
Серная кислота также реагирует с основными оксидами с образованием сульфатов и воды.
Растворы серной кислоты используются на металлообрабатывающих предприятиях для удаления оксидных слоев металла с поверхности металлических изделий, подвергшихся сильному нагреву в процессе производства. Например, оксид железа удаляется с поверхности стального листа под действием нагретого раствора серной кислоты.
Al, Cr и Fe пассивируются холодной густой серной кислотой (т.е. покрываются оксидной пленкой, которая предотвращает дальнейшие реакции). Реакции происходят только при нагревании.
Промышленное производство серной кислоты (контактный способ):
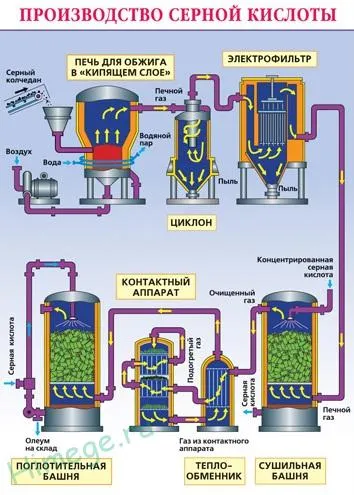
1) 4fes.2 + 11o2 → 2FE2 o3 + 8SO2
Дробленый и очищенный жидкий камин (серная металлургия) заливается в печь для сжигания в «кипящем слое». Насыщенный кислородом воздух поступает снизу (принцип противоположного тока). Печные газы, состав которых2, o2 его состав — это о, пар (огнеупор) и микроскопические частицы шлака (оксид железа). Газ очищается от твердых частиц (циклонный и электростатический фильтры) и водяного пара (сушильная башня). Контактор окисляется с помощью сульфидного газа с использованием c2 o5 (пентоксиды ванадия) для увеличения скорости реакции. Процесс окисления от одного оксида к другому является обратимым. В результате выбираются оптимальные условия для немедленной реакции — более высокое давление (поскольку немедленная реакция уменьшает общий объем) и температура ниже 500°C (реакция является экзотермической).
В абсорбционных башнях оксид серы (VI) поглощается плотной серной кислотой. Абсорбция не используется, поскольку оксид серы растворяется в воде и выделяется большое количество тепла. Поэтому серная кислота кипит и превращается в пар. Для предотвращения образования сернокислотного тумана используется 98% плотная серная кислота. Оксид серы очень хорошо растворяется в этой кислоте и образует масло: H2 SO.4 -nso3
Химические свойства серной кислоты:
h2 SO.4 — Это сильная двухосновная кислота, одна из самых мощных минеральных кислот из-за своей высокой полярности; связь H легко расщепляется.
(1) В водном растворе серная кислота растворяется с образованием ионов водорода и кислотного остатка: H2 SO.4 = H + + HSO4 — ; HSO4 — = h + + so4 2-. Уравнение влияния: h2 SO.4 = 2h + + поэтому4 2-.
2) Взаимодействие серной кислоты с минералами: разреженная серная кислота растворяет только оставшийся металл водорода в порядке тенденции: Zn 0 + H2 +1- так.4 (разбавление) → Zn +2 SO4 + h2
3) Реакция серной кислоты с основными оксидами: Cuo + H2 SO.4 → КУСО4 + h2 o
4) Взаимодействие серной кислоты с гидроксидами: H2 SO.4 + 2NAOH → NA2 SO.4 + 2H2 OH2 SO.4 + cu (ah)2 → КУСО4 + 2H2 o
5) Реакция солевого обмена: BACL2 + h2 SO.4 → Басо.4 Образование белого осадка, называемого ↓ + 2HCl базо4 (нерастворимый в кислоте) используется для обнаружения серной кислоты и растворимого сульфата (качественная реакция на сульфат-ионы).
Особые свойства концентрированной H 2 SO.4 :
1) концентрированная серная кислота является сильной окислительной средой — при взаимодействии с металлами (кроме Au и Pt) образуется S +4 o2, s 0 или h2 s -2 в зависимости от активности металла. Не реагирует с Fe, al или cr-пассивом без нагревания. При взаимодействии с металлами переменной валентности последние окисляются в более высокой степени.
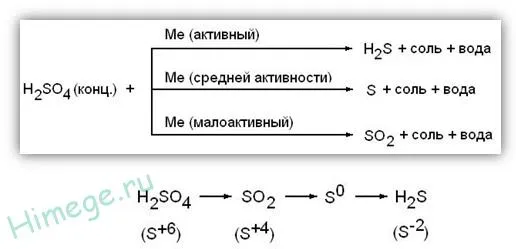
Активные металлы.
8 ал + 15 ч2 SO.4 (конденсация) →4 ал2 (так.4 )3 + 12 h2 о + 3 ч2 S4│2AL0-6 E-→2AL 3+ — окисление3│S6 ++ 8E→S 2- восстановление
Промежуточный металл
2cr + 4 h2 SO.4 (конденсация) →Cr2 (так.4 )3 + 4 ч.2 O + S1│2cr 0-6e → 2cr 3+ — окисление 1│S6+ + 6E → S 0 — восстановление
Неактивные металлы
2bi + 6h2 SO.4( Согласие. ) →bi.2 (так.4 )3 + 6H2 O + 3 SO21│2Bi0-6e→2Bi3+- окисление 3│S6++2e→S4+- восстановление
(2) Концентрированная серная кислота обычно окисляет некоторые неметаллы до их максимальной степени окисления и восстанавливается до S+4O.2 :.
3) Окисление композитных материалов: серная кислота окисляет HI и HBg до свободных галогенов: 2Qg + 2H2 SO.4 =К2 Итак.4 + SO2 + Bg2 + 2H2 O 2 KI + 2H2 Итак.4 =К2 SO.4 + SO2 + I2 + 2H2 ○ Концентрированная серная кислота не может окислить ионы хлора до свободного хлора, поэтому в результате реакции обмена NaCl+H образуется HCl.2 SO.4 (Концентрация) = NαHSO4 + HCL
Серная кислота удаляет химически связанную воду из органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты дает этилен: C2 Н5 OH = C2 Н4 +Н2 О.
Карбонизация сахара, целлюлозы, крахмала и других углеводов в контакте с серной кислотой также происходит за счет их дегидратации: C6 H12 o6 + 12 h2 SO.4 = 18H2 O + 12SO2 ↑ + 6CO2 ↑.
Теплота гидратации настолько велика, что смесь кипит, разбрызгивается и может вызвать ожоги. Поэтому в воду необходимо добавить кислоту. Не наоборот. При добавлении воды в кислоту на поверхности кислоты оказывается легкая вода, и все выделяемое тепло концентрируется.
Участие в окислительно-восстановительных взаимодействиях
Разбавленные растворы H2Итак.4 Реагирует с металлами, находящимися в диапазоне электрохимического напряжения металлов до H2, с образованием сульфатов и выделением водорода:
net H.2Итак.4 и H2Итак.4 В концентрированных растворах S+6 проявляет более сильные окислительные свойства.
В концентрированной H2Итак.4 реагирует с металлами (включая Cu, Ag и Hg) после H2 В ряду металлических тенденций он образует сульфаты, воду и продукты восстановления S +6: H2S, S, SO2. Концентрированная серная кислота не реагирует с драгоценными металлами из-за своей низкой активности и не реагирует с Al, Cr и Fe из-за пассивации. На поверхности этих металлов образуется защитная оксидная пленка, которая защищает их от дальнейшего окисления.

Глубина восстановления зависит от восстановительных свойств металла. Активные металлы снижают уровень H2Итак.4 До H2S:.

Менее активные металлы снижают уровень H2Итак.4 В то время2S:.

Концентрированная серная кислота также окисляет некоторые неметаллы. Например:.

Важным химическим свойством серной кислоты является ее способность действовать как дегидратирующий агент. Концентрированная серная кислота вступает в реакцию со многими органическими веществами и извлекает из них молекулы воды. Например.
Получение и применение серной кислоты
Промышленное производство серной кислоты включает в себя несколько этапов. Сырьем является сера S и сульфидная руда (в основном FeS кремнезем).2).
В процессе производства серной кислоты из кремнезема происходят три химические реакции.

Реакции являются обратимыми, экзотермическими и каталитическими (протекают в присутствии катализатора V)2O5 (при температуре около 450°C).
Оксиды серы (VI) (сернистый ангидрид) SO3 При нормальных условиях представляет собой летучую жидкость (t°.Температура кипения. = 44,8°C), растворим в воде. Оксид серы (VI) SO3 — представляет собой кислотный оксид, эквивалентный сильной серной кислоте.
В промышленности используется в качестве концентрированной H2Итак.4используемые в этой реакции, нефть H2Итак.4 — Итак.3При разбавлении образуется концентрированная H2Итак.4.
Серная кислота является одним из важнейших продуктов химической промышленности. Его основными областями применения являютсяПриложения.Минеральные удобрения, другие кислоты и соли, красители, пластмассы, текстиль, фармацевтика, нефтепродукты, металлургия.
Обзор курса «Соединения серы: серная кислота». Выберите дальнейшие действия.
Теплота гидратации настолько велика, что смесь кипит, разбрызгивается и может вызвать ожоги. Поэтому в воду необходимо добавить кислоту. Не наоборот. При добавлении воды в кислоту на поверхности кислоты оказывается легкая вода, и все выделяемое тепло концентрируется.
Общее описание
Серная кислота (H2Итак.4) обладает свойствами кислоты и является сильным окислителем. Это самая активная неорганическая кислота с температурой плавления 10°C. Кислота кипит при 296°C, выделяя воду и оксид серы SO3. Он может поглощать водяной пар и поэтому используется для осушения газа.

Рисунок 1.Серная кислота.
Серная кислота производится промышленным способом из диоксида серы (SO)2Он образуется при сгорании серы или диоксида серы. Два основных процесса образования кислоты:
- контактный (концентрация 94 %) – окисление диоксида серы до трёхокиси серы (SO3) с последующим гидролизом:
раствор SO3 в серной кислоте называется оливковой мельницей. Он также используется для производства серной кислоты.
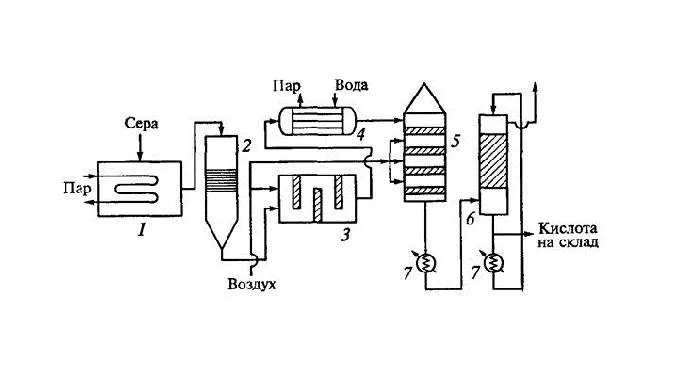
Рисунок 2.Процесс приготовления серной кислоты.
При реакции с водой выделяется большое количество тепла. Именно поэтому кислоты добавляют в воду, а не наоборот. Вода легче кислоты и остается на поверхности. При добавлении воды в кислоту вода сразу же закипает, а кислота выплескивается.
Свойства
Серная кислота образует два типа соли.
Химические свойства концентрированной серной кислоты приведены в таблице.
Что образуется.
Качественная реакция: H2Итак.4 + BaCl2 → BaSO4 (белый осадок) + 2HCl
Окисление композитных материалов
Карбонизация сахара (целлюлоза, крахмал, глюкоза)

Рисунок 3.Реакция с сахаром.
Разбавленные кислоты не окисляют слабореакционные металлы после водорода в электрохимическом ряду. При реакции с активными металлами (литий, калий, натрий, магний) выделяется водород и образуются соли. При нагревании концентрированные кислоты проявляют свойства окисления тяжелых металлов, щелочных и щелочноземельных металлов. Он не вступает в реакцию с золотом или платиной.
Серная кислота (разбавленная и концентрированная) на холоде не реагирует с железом, хромом, алюминием, титаном и никелем. Пассивация металлов (образование защитной оксидной пленки) позволяет переносить серную кислоту в металлические резервуары. Оксид железа разлагается при нагревании.
Во всем мире ежегодно используется до 160 тонн кислоты. Наибольшее применение эта жидкость находит в производстве минеральных удобрений. По этой причине сернокислотные установки, как правило, производятся вместе с установками по производству удобрений.
Вред для человеческого здоровья
Токсичная жидкость не только угрожает здоровью человека из-за риска попадания капель на кожные покровы, но и может повредить внутренние органы из-за нередкого присутствия едких сернистых газов. Он очень агрессивен, и его состав усиливает симптомы отравления. Безвредная доза H2SO4 в воздухе составляет 0,3 мг на квадратный метр.
Неосторожное обращение может привести к повреждению кожи, дыхательной системы и слизистых оболочек. Нередки случаи бронхита, ларингита и трахеита. Ожоги очень случайны и требуют длительного времени для заживления. Преждевременное обращение за медицинской помощью может привести к смерти. Опасная для жизни доза составляет 0,18 кубических сантиметров на литр или 5 миллиграммов при приеме внутрь.
Признаки отравления
- тошнота и рвота;
- болезненные ощущения в органах пищеварения;
- расстройства кишечника;
- проблемы со стулом;
- изменение цвета мочи на красный;
- появление бурых пятен на дёснах;
- чрезмерное слюноотделение;
- ожог слизистой глаз;
- повреждение дыхательных путей;
- кровотечение из носа;
- отёк горла и гортани, охриплость;
- посинение кожных покровов.
Сегодня серная кислота обычно производится на специальных предприятиях, но она по-прежнему необходима и составляет 100%. Например, в Италии на Сицилии можно увидеть, как со дна Мертвого моря вытекает H2SO4. Это место обычно называют Мертвым озером, и существ предупреждают, чтобы они держались от него подальше. Выделение серной кислоты со дна обусловлено наличием серебра в коре земли.
Серная кислота также может выделяться во время крупных вулканических извержений. Такие события очень опасны для людей и окружающей среды. Одним из последствий выбросов H2SO4 в атмосферу является изменение климата. Серная кислота считается основной причиной кислотных дождей и высвобождается в результате выделения диоксида серы в воздух.
Как упоминалось выше, серная кислота эффективно поглощает воду из воздуха. Благодаря этому свойству их можно использовать для осушения газов. Они переливали жидкость в небольшие контейнеры и оставляли их между окнами. Это помогло избежать размытия окон в комнате.








